Culaea inconstans (Kirtland, 1840)
Ручьевая колюшка (Rus),
Brook stickleback
(Eng)
Синонимы:
Eucalia inconstans (Kirtland, 1841)
Eucalia inconstans var. cayuga Jordan, 1876
Gasterosteus gymnetes Dawson, 1859
Gasterosteus inconstans Kirtland, 1840
Gasterosteus micropus Соре, 1865
Gasterosteus pygmaeus Agassiz, 1850
Декоративное рыбоводство. А.М.Кочетов 1991 г.
Ручьевая колюшка — Culaea inconstans (Kirtland, 1841). Родина — бассейн Великих озер Северной Америки; размер до 6 см. Брачная окраска карминово-красная.
Фауна СССР. Рыбы. Том V, вып. 1. Семейство Колюшковых (Gasterosteidae) мировой фауны. В.В.Зюганов 1991 г.
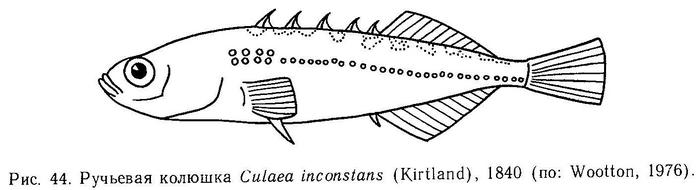
1. Culaea inconstans (Kirtland), 1840 — Ручьевая колюшка (рис. 44).
(Brook stickleback — ручьевая колюшка.)
— Gasterosteus inconstans Kirtland, 1840 : 273 (штат Огайо, Сев. Америка).
— Gasterosteus pygmaeus Agassiz, 1850 : 314, Т. IV, fig. 1—2 (оз. Верхнее, США).
— Gasterosteus gymnetes Dawson, 1859 : 221 (Монреаль, Канада).
— Gasterosteus micropus Соре, 1865 : 81 (штат Канзас, США).
— Eucalia inconstans Jordan, 1876 : 65 (штат Нью-Йорк, США).
— Eucalia inconstans var. cayuga Jordan, 1876 : 249 (оз. Каюга, штат Нью-Йорк, США).
— Eucalia inconstans Eigenmann, 1886 : 223 (систематическое положение); Bertin, 1925 : 165 (систематика, синонимия); Nelson, 1969 : 243 (экология, географическая изменчивость); 1971а : 427 (анатомия, морфология); Wootton, 1976 : 290 (образ жизни, анатомия, распространение); Bell, 1984 : 431—528 (генетика, морфология, географическая изменчивость).
D (IV) V—VI (VII) (Как исключение II или III.) 8—13, А 17—12, V I 1 (В ряде популяций Северо-Востока Канады брюшной колючки нет.), Р (9) 10 (11), С (11) 12, позвонков 30—35 (в среднем 32), 14 туловищных и 18 хвостовых. Жаберных тычинок 10—15 (в среднем 12.5).
Рыло короче заглазничного отдела головы. Хвостовой плавник в виде усеченного конуса и слегка закруглен. Мембраны спинных колючек пигментированы меланофорами, которые делают колючки броскими. Кожа голая, без чешуи. Вдоль боковой линии от головы до хвоста имеется ряд пластин (30—36), мелких, округлой формы, не налегающих друг на друга. Выше первых (передних) 5—6 пластин имеется дополнительный ряд из 5—6 пластин. Вне нерестового сезона окраска маскирующая — оливково-зеленое или коричневое тело с темными пятнами на спине и боках. У самца во время нереста развивается брачная окраска: радужная оболочка глаз приобретает желтый цвет, на глазах возникает вертикальная черная полоса, спинной, анальный плавники и спинные колючки становятся более темными. Длина до 65 мм.
Изменчивость. Есть клинальная изменчивость по длине спинных и брюшных колючек. Наиболее длинные колючки обнаружены в популяциях от штата Висконсин до Огайо (средний запад США), наиболее короткие — в канадских провинциях Альберта и Британская Колумбия (северо-восток ареала). По высоте тела также имеется географическая изменчивость: на юго-западе ареала Culaea inconstans относительно высокотела (там, где она симпатрична с более прогонистой Pungitius pungitius), а на северо-западе ареала Culaea inconstans более прогониста. Относительные размеры тазового пояса самые большие в популяциях, обитающих от Великих озер до штата Нью-Йорк, и наименьшие на северо-западе ареала. Ряд популяций в провинциях Альберта и Саскачеван (Канада) имеет высокую частоту особей с частично развитым или отсутствующим тазовым поясом, у всех этих особей нет брюшных колючек. Эти популяции рассеяны среди других, где тазовый пояс относительно малых размеров, но нормально развит. В ряде случаев Culaea inconstans без тазового пояса, симпатричны с Pungitius pungitius, также лишенных тазового пояса. Полагают (Nelson, 1969; Reist, 1980а, 1980b), что снижение пресса хищных рыб и увеличение пресса хищных насекомых приводят к редукции тазового пояса (см. разделы 1.6 и 4.5.4). Описание дано по указанным выше литературным источникам.
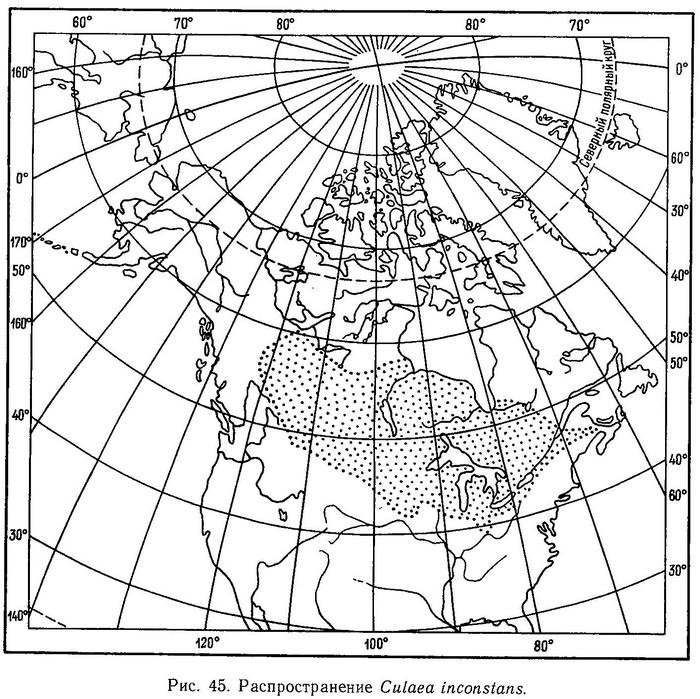
Распространение. Пресноводный эндемик континентальных вод Сев. Америки (рис. 45). Северо-восточная оконечность ареала — граница между канадскими провинциями Альберта и северо-западные территории (60° с. ш.), в районе р. Хэй и Большого Невольничьего озера. Южная граница — приблизительно 40° с. ш. На западе ареал ограничивают Скалистые горы, на востоке — оз. Эри (Великие озера) и реки зал. Св. Лаврентия. На основе анализа современного ареала Мак-Фейл и Линдсей (McPhail, Lindsey, 1970) полагают, что последнее (Висконсинское) оледенение в плейстоцене Culaea inconstans пережила в рефугиуме в долине р. Верхней Миссисипи.
Образ жизни. Пресноводная рыба. Найдена на побережье моря только в одном месте в районе Гудзонова залива. Среди всех колюшковых имеет наименьшую солеустойчивость (гибнет при солености свыше 21 ‰ при температуре 22 °С) (Armitage, Olund, 1962), однако обитает в ряде солоноватых североамериканских озер (Nelson, 1968b), и солеустойчивость ее выше, чем у всех генеративно-пресноводных североамериканских рыб.
Обитает в водоемах с холодной чистой водой, имеющих родниковое питание (ручьи, пруды, озера), но предпочитает держаться в зоне растительности на литорали (Winn, 1960). Встречается в водоемах на высоте 1667 м (Nelson, 1968а).
Живет 2—3 года, размножается с возраста 1 год. Весной мигрирует с больших глубин на мелководье или из главного русла реки в притоки. Предпочитаемые температуры при нересте 15—19 °С. Температура выше 19 °С ингибирует нерест. Размножение с апреля до конца июня или середины июля в зависимости от географической широты и температуры. Репродуктивный цикл в целом сходен с Gasterosteus aculeatus. Самец строит гнездо из растительности среди стеблей растений над грунтом и охраняет икру и личинок. За нерестовый сезон 4—5 нерестов. Питается водными личинками насекомых, мелкими ракообразными, улитками, олигохетами, водорослями, собственной икрой и икрой других рыб. Является объектом питания щуки, окуня, рыбоядных птиц, выдры. Хозяин 22 видов паразитов, относящихся к 5 типам (см. список в разделе 2.5). По сравнению с Gasterosteus aculeatus очень пугливая рыба, при появлении источника беспокойства затаивается в зарослях или даже зарывается и ил. В илу не только прячется от хищников, но и добывает питание, роясь рылом в грунте.
Практическое значение. Не имеет.
Окраска Culaea inconstans вне нерестового сезона имеет криптический характер: оливково-зеленое или коричневатое тело с темным пестрым рисунком на спине и боках. С приближением нереста самец темнеет. На радужной оболочке глаза — ирисе, имеющей желтую окраску, возникает черная полоса меланофоров, расположенная вертикально и простирающаяся через всю поверхность глаза. В отличие от Gasterosteus и Pungitius спинной и анальный плавники у Culaea, а также мембраны спинных колючек становятся интенсивно пигментированными меланофорами, что делает их более броскими (Reisman, Cade, 1967; Hall, 1956, — цит. по: Wootton, 1976). Самки тоже меняют окраску, и при созревании пестрота их окраски становится более выражена (Scott, Crossman, 1973).
Culaea inconstans в Канаде обнаруживает значительную изменчивость по числу спинных колючек (от 4 до 7, мода — 5), но не найдено какой-либо связи между числом колючек и факторами внешней среды (Moodie, 1977).
Нельсон (Nelson, 1969) исследовал изменчивость длины 1-й спинной и брюшной колючек у 62 популяций из Канады и США и нашел, что самые длинные колючки имели колюшки из района Великих Озер (от Висконсина до Огайо), и длина колючек уменьшалась на запад, север и восток от этого района. Самые короткие колючки у рыб были на северо-западе ареала этого вида. Автор полагает, что отсутствие альтернативных видов жертв на северо-западе ареала не позволяет хищникам переключиться на незащищенные колючками виды жертвы, и это переводит колючки Culaea inconstans в разряд неэффективного защитного механизма. Наоборот, в этом районе отбор благоприятствует короткоколючковым особям с прогонистым телом и легким тазовым скелетом и рыбам, более способным укрываться в густой растительности.
Culaea inconstans. Географическая изменчивость тазового пояса этого североамериканского эндемика изучена в основном благодаря работам Нельсона (Nelson, 1969, 1977; Nelson, Atton, 1971). В большинстве популяций pelvis развит полностью, но по длине брюшных колючек (как и по длине спинных) имеется клина к уменьшению колючек с юго-востока на северо-запад ареала. На «коротком» конце клины в Онтарио, Саскачеван, в провинциях Альберта (Канада) существуют популяции с высокой частотой редукции и утратой pelvis. Частота фенотипов, «редуцированных» в относительно нормальных популяциях, с развитым pelvis никогда не превышала в провинции Манитоба (Канада) 2.7 % (Moodie, 1977), в то время как частота колюшек, утративших pelvis, в некоторых популяциях из Альберты достигает 100 % (Nelson, Atton, 1971; Nelson, 1977). Степень редукции pelvis и форма редуцированных тазовых поясов имеют непрерывную серию промежуточных форм от полностью выраженного таза до полной его утраты, все эти переходы можно наблюдать внутри одной популяции (Nelson, Atton, 1971). Белл (Bell, 1984) на основании наблюдения индивидуального развития тазового пояса у Culaea пришел к выводу, что механизмом редукции pelvis является педоморфоз. Нельсон (Nelson, 1977) отмечал стабильность частот фенотипов с разной выраженностью развития тазового пояса в разные годы в одной и той же популяции. Он показал, что отсутствие тазового пояса находится под частичным генетическим контролем.
Что касается механизма, детерминирующего клину уменьшения длины брюшных и спинных колючек и относительной высоты тела Culaea к северозападным районам Канады, и причин существования популяций с редуцированным pelvis на северном окончании этой клины, то Нельсон (Nelson, 1969) и Белл (Bell, 1984) предполагают, что главным фактором отбора являются хищники. Большая длина брюшных, спинных колючек и большая высота тела колюшки в совокупности обеспечивают большую площадь сечения рыбы, что затрудняет проглатывание рыбы хищными позвоночными. Известно, что хищные рыбы (щука, окунь) при наличии выбора в эксперименте склонны скорее хватать рыб с мягкими лучами в плавниках, нежели колюшек (Hoogland et al., 1957). Нельсон (Nelson, 1969) полагает, что отсутствие альтернативных видов рыб-жертв с мягкими лучами в плавниках на севере не позволяет хищникам переключиться на эти виды, что влечет за собой перевод колючек Culaea в разряд неэффективного защитного механизма, и это приводит в итоге к укорочению колючек. Фенотипы Culaea с отсутствием таза чаще встречались в водоемах, где нет хищников (Nelson, 1977), что предполагает исключение отбора по тазовому поясу. Тем не менее популяции Culaea inconstans с редуцированным тазом не обнаруживают укорочения или уменьшения числа спинных колючек по сравнению с популяциями с нормальным тазом, как это происходит в большинстве случаев у трехиглой колюшки.
Интересную работу по выявлению селективных факторов поддержания полиморфизма по «тазовым» фенотипам провел Рейст (Reist, 1980а, 1980b, 1981) на популяции оз. Вакомао (провинция Альберта, Канада). Он сочетал наблюдения в природе с аквариальными экспериментами. Обнаружилось, что в ручьях, впадающих в озеро, частота рыб с нормальным pelvis (в сравнении с редуцированным фенотипом) существенно выше, чем в озере. После зимы также увеличивается частота рыб с нормальным тазом по сравнению с редуцированным фенотипом, но летом наблюдается возврат к первоначальному положению. Несмотря на сезонную динамику частот «тазовых» фенотипов в озере, они оставались стабильными за 7-летний период, что свидетельствует о различиях в приспособленности фенотипов на разных стадиях жизненного цикла. Экспериментально было выявлено, что смертность от дефицита кислорода была одинаковой у двух фенотипов. Однако было обнаружено, что в желудках крупных щук (Esox lucius) (более 18 см длиной) рыбы с нормальным тазом встречались с большей частотой, чем ожидаемая, а рыбы с редуцированным тазом — с меньшей. Аквариумные эксперименты выявили, что мелкие щуки (длиной 11—18 см) потребляли колюшек разных фенотипов в среднем случайно (в одинаковой степени), но когда в аквариумах были сделаны укрытия, то бестазовые колюшки выедались намного сильнее, чем дикий тип. Эксперименты эти хорошо согласуются с природными наблюдениями о том, что в ручьях, где больше укрытий по сравнению с озером, наблюдается избыток дикого типа. Однако Рейст в своих опытах пошел еще дальше: он предлагал щукам на выбор (при отсутствии укрытий в аквариуме) колюшек без таза и колюшек «дикого типа», но с отрезанными брюшными колючками — в этом случае селективно больше выедались искусственно «обесколюченные» рыбы. Отсутствие следов зубов щуки на теле оставшихся в живых в эксперименте указывает, что отнюдь не механическим преимуществом в выскальзывании изо рта хищника обладает бестазовый фенотип. Скорее всего, бестазовые рыбы компенсируют отсутствие колючек более скрытным, осторожным поведением.
Факт сезонных флюктуаций частот фенотипов объясняется действием других хищников — водных насекомых. Рейст (Reist, 1980а) в аквариумных опытах установил, что жук-плавунец Dytiscus селективно выедал «дикий тип» в том случае, если у рыб было 5, но не 6 спинных колючек, гигантский водяной жук Letocerus americanus и личинки стрекоз рода Aeshna не являются селективными хищниками по тазовым фенотипам. Рейст пришел к выводу, что наличие в водоемах обилия водных насекомых приводит к отбору на утерю тазового пояса, в то время как мелкие хищники-рыбы обеспечивают противодействующий отбор. Возможно, из-за разных соотношений этих двух факторов в разных водоемах и наблюдаются различия в частотах по тазовым фенотипам в разных популяциях Culaea inconstans. Кроме того, поскольку хищные рыбы также выедают водных насекомых, то при полном отсутствии хищных рыб эффект насекомых может проявляться в полной мере и приводить к 100%-ной утере тазового пояса в таких популяциях (Reimchen, 1980).
Уменьшение длины спинных колючек показано для Culaea inconstans и Pungitius tymensis, но вызвано оно у двух видов, по-видимому, разными причинами: у Pungitius tymensis переходом в новую адаптивную зону густой растительности, недоступной для лососевых рыб-хищников, а у Culaea inconstans из-за неэффективности колючек как средства защиты от хищников ввиду отсутствия на северо-западе Канады альтернативных видов—жертв.
Самки Culaea inconstans имеют репродуктивный цикл, сходный с таковым Gasterosteus aculeatus. После нереста яичники содержат маленькие ооциты; нерест у Culaea ингибируется температурой свыше 19° С (Lamsa, 1963), у самок резорбируется зрелая икра в ястыках. Формирование желтка в ооцитах начинается в сентябре, но вскоре наступает прекращение созревания до весны. При весеннем увеличении светового дня ооциты наполняются желтком, и в апреле—мае икра готова к откладке. Масса яичника зрелой самки составляет 10—20 % от массы тела (Braekvelt, McMillan, 1967). За нерестовый период самка продуцирует до 250 икринок (Winn, 1960). Диаметр икринки Gulaea 1.0—1.3 мм (Nelson, 1968а).
Кроме Gasterosteus aculeatus созревание самцов и сперматогенез подробно были изучены у Culaea inconstans (Ruby, McMillan, 1970, 1975) и Apeltes quadracus (Merriman, Schedl, 1941). Было показано принципиальное сходство в протекании этих процессов у исследованных видов. Как и у Gasterosteus aculeatus, у этих видов колюшковых созревание сперматозоидов индуцируется длинным световым днем и эффект света опосредован секрецией гонадотропина гипофизом и стимулирующим эффектом этого гормона на интерстициальные клетки семенников, секретирующих андрогены.
У Culaea inconstans в зависимости от температуры выклев происходит на 5—9-е сутки (Wootton, 1976), молодь Apeltes quadracus выводится за 8 дней при 18 °С (Rowland, 1974).
Culaea inconstans нерестится через год после своего рождения и живет до 3 лет (Winn, 1960).
Culaea inconstans имеет темп роста, сравнимый с Pungitius pungitius, и даже несколько меньший, чем у Pungitius pungitius. Достигая максимальной длины в 65 мм (Winn, 1960), Culaea имеет обычно меньшие размеры (40—50 мм) в возрасте 2—3 лет.
Пищевой спектр другого пресноводного североамериканского эндемика Culaea inconstans составляют в основном водные личинки насекомых, мелкие ракообразные, олигохеты, моллюски, водоросли и икра рыб (Winn, 1960). Culaea inconstans, ведущая скрытный зарослевый образ жизни в литоральной зоне, является бентофагом.
Culaea inconstans еще более осторожная рыба, чем даже Pungitius pungitius, у которой описан такой поведенческий ответ на опасность, как закапывание в грунт. Рыба резким броском уходит от источника опасности вниз вперед головой, погружаясь в ил, и с помощью быстрых движений хвоста зарывается в грунт, проползая в нем расстояние до 60 см, затем выходит наружу и уплывает прочь (Degraeve, 1970). Culaea inconstans подвергается хищничеству со стороны щуки, крачек, чаек, выдры (Winn, 1960).
Culaea inconstans имеет 22 вида паразитов. Ниже приведен их список (по: Hoffman, 1967).

Culaea inconstans — типичный пресноводный вид, обитающий в Сев. Америке, который имеет наименьшую солеустойчивость среди других колюшковых. Однако солеустойчивость Culaea выше, чем у многих других генеративно пресноводных видов рыб Сев. Америки (Winn, 1960; Nelson, 1968). Весной Culaea inconstans мигрирует с больших глубин водоема в меньшие. При таянии льда рыбы движутся вверх по течению и из главного русла рек устремляются в протоки и проточные пруды, заливы. Рыбы предпочитают температуру воды более высокую, чем в главном русле, но не выше 19 °С, и зону густой вегетации (Maclean, Gee, 1971).
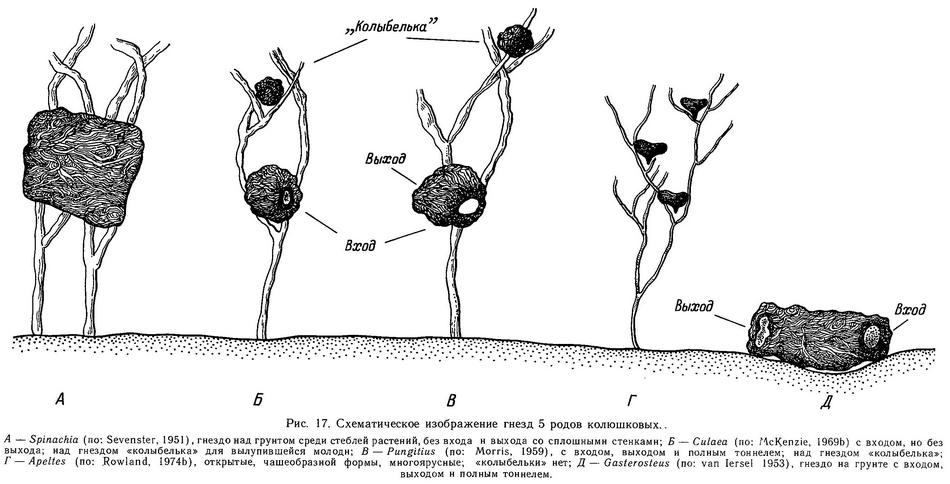
Гнездостроительное поведение самцов Culaea inconstans близко таковому Pungitius. Гнездо строится над грунтом среди растений, хотя в среднем оно ближе к грунту, чем у Pungitius, — на высоте 5—10 см. В отличие от Pungitius гнездо Culaea inconstans прикрепляется не к ветвям или листьям, а к главному стеблю или в развилке стебля (Reisman, Cade, 1967). Состоящее из нитей водорослей или иного растительного материала сферической формы гнездо Culaea inconstans имеет диаметр 1.5—3 см (Winn, 1960) — меньший, чем у Pungitius и Gasterosteus.
После выбора места для гнезда самец Culaea в отличие от Gasterosteus и Pungitius вначале откладывает на выбранное место клубок нитей клея, а уже затем приносится растительный материал и склеивается самцом. У Culaea, как и у Pungitius, имеется и поверхностное, и вставочное склеивание. В остальном все элементы гнездостроительного поведения Culaea сходны с Gasterosteus и Pungitius. У законченного гнезда Culaea нет полного туннеля и выхода из гнезда (Smith, 1970), в противоположность Gasterosteus и Pungitius. Лишь у Pungitius из оз. Гурон (США) некоторые гнезда не имели выхода, и в этом случае при нересте самка и самец покидали гнездо через вход (McKenzie, Keenleyside, 1970). Последнее отличие гнездостроительной фазы Culaea от двух других родов состоит в отсутствии элемента «проползание через гнездо», завершающего у Gasterosteus и Pungitius гнездостроительную фазу (Reisman, Cade, 1967).
Culaea inconstans. В отличие от Gasterosteus и Pungitius переход от гнездостроительной к сексуальной фазе у Culaea не маркирован «проползанием через» гнездо, так как у Culaea нет полного туннеля и выхода из гнезда. Сексуальное поведение самца Culaea, скорее, сходно с таковым Gasterosteus wheatlandi и Pungituis (хотя оно не менее агрессивно, чем у Gasterosteus), но содержат некоторые элементы, не характерные для Gasterosteus wheatlandi и Pungitius.
Так, при виде самки самец Culaea вместо «зигзаг»-танца медленно плывет к ней по прямой линии, выпрямив все колючки и быстро вибрируя грудными и хвостовыми плавниками. Находясь за 10—15 см на пути к ней, самец делает стремительный выпад и начинает «тузить» ее («pummeling»), нанося удары рылом в голову и бока тела самки. Самка в ответ оседает на дно. Второй элемент — «ведение к гнезду» — уникален для Culaea: самец медленно движется по извилистой линии, при этом хвост его опущен, и совершает латеральные биения; все колючки выпрямлены, рот открыт, спина выпукла. Самка следует за самцом, располагаясь несколько ниже его (как у Gasterosteus wheatlandi и Pungitius pungitius) . Показывая вход в гнездо, самец, подобно самцу Pungitius, помещает кончик рыла (рот открыт) над входом в гнездо и вентилирует гнездо грудными плавниками. После проникновения самки в гнездо самец «трясет» ее за бока, как и Gasterosteus, и Pungitius. Самка Culaea проводит намного больше времени в гнезде (7—9 мин), чем самка Gasterosteus и Pungitius (1—2 мин). Она покидает гнездо, взламывая заднюю стенку. Немедленно после этого самец проникает в гнездо и оплодотворяет икру (Reisman, Cade, 1967; McKenzie, 1969b). У Culaea нет элемента «dorsal pricking» (как у Gasterosteus), но есть дополнительный цикл «сверление» и «вентиляция гнезда», кроме того, наличие элемента «pummeling» (тужение) приближается Culaea к Gasterosteus по степени агрессивности (McKenzie, 1969b). Несомненно, характерное для Culaea приближение самца к самке, так же как «pummeling» и «ведение к гнезду», делает строгой репродуктивную изоляцию между Culaea и Pungitius pungitius, симпатричного с ней в Сев. Америке, несмотря на сходство их нерестовых биотопов и окраски самцов.
Culaea inconstans по родительской фазе самца весьма сходна с Pungitius pungitius. После оплодотворения самец в течение часа усиленно вентилирует гнездо, а затем занимается гнездостроительной деятельностью — заделывает выход из гнезда, проломленный в задней стенке самкой (поскольку самец изначально не делает выхода из гнезда). Кроме того, самец увеличивает гнездо, чтобы принять другую кладку икры (McKenzie, 1974). Вентиляция у Culaea подобна таковой у Gasterosteus и Pungitius, но по времени вентиляции Culaea сходна больше с Pungitius. Молодь вылупляется через 5—9 дней (в зависимости от температуры). Самец помещает молодь в «колыбельку», построенную, как у Pungitius, выше гнезда. Через 2—3 дня молодь расплывается, и самец заканчивает родительскую фазу. Налеты на гнезда и воровство яиц у Culaea также имеют место (McKenzie, 1974).
Площадь гнездовой территории самца Culaea (250—1600 см2) сравнима с таковой Gasterosteus и Pungitius (Reisman, Cade, 1967). Во время родительской фазы агрессивность самца возрастает (McKenzie, 1969а). Позы угрозы самца Culaea сходны с таковыми Gasterosteus и Pungitius, но в отличие от них Culaea еще может принимать специфическую «сигмоидную» позу, когда самец сгибает хвост по направлению к голове, искривляя таким ооразом бок тела (McKenzie, 1969а).

Culaea inconstans распространена в пресных континентальных водоемах Сев. Америки, ее ареал почти полностью перекрывается с распространением Pungitius pungitius, с севера и юга он ограничен широтами 60—40° с. ш., с запада — Скалистыми горами, с востока р. Св. Лаврентия (Nelson, 1969; Scott, Crossman, 1973). Мак-Фейл и Линдсей (McPhail, Lindsey, 1970) полагают, что Висконсинское оледенение в плейстоцене этот вид пережил в рефугиуме в верховьях Миссисипи (рис. 23).
Тазовый пояс. Генетика редукции тазового пояса лучше всего изучена у Culaea inconstans. Нельсон (1977) провел 19 индивидуальных и 4 групповых скрещивания Culaea с разными фенотипами тазового пояса. Особи для скрещиваний были взяты из полиморфной популяции оз.Астотин (провинция Альберта, Канада). Хотя между полной выраженностью тазового пояса и полной утратой его имеется непрерывная серия промежуточных форм, Нельсон (Nelson, 1977) использовал для скрещиваний 3 дискретных фенотипа. «А» (absence) — полное отсутствие обеих (левой и правой) половинок таза и колючек; «I» (intermediate) — промежуточный фенотип: есть только 1 половинка тазовой кости, но нет колючек, или есть обе половинки таза и только 1 (левая или правая) колючка; «С» (complete) — полная выраженность тазового пояса и обеих колючек. Индивидуальные скрещивания были выполнены в аквариумах, а групповые в искусственных прудах, и от 30 до 60 основателей было интродуцировано в каждый пруд. Результаты индивидуальных и групповых скрещиваний оказались сходными. В скрещиваниях типа «А» х «А» в F1 наблюдалось расщепление на все 3 фенотипа (60 % «А», 20 %, «I», 20 % «С») в пруду и (80 % «А», 17 % «I», 3 % «С») в аквариумах. В скрещиваниях типа «I» х «I» наблюдалось расщепление в F1 на все 3 фенотипа при соотношении примерно 2«А» : 1«I» : 1«С». Скрещивания «С» х «С» давали также расщепления на 3 фенотипа при их примерном соотношении 25 % «А», 10 % «I», 65 % «С». Скрещивания типа «С» х «А» не обнаружили доминирования «дикого типа» над редукцией, а в потомстве F1 произошло расщепление 50 %«А», 20 % «I», 30 % «С». Скрещивание «А» х «I» обнаружило расщепление: 60 % «А», 30 % «I», 10 % «С». Скрещивание «С» х «I» выполнено не было. Результаты скрещиваний не позволили Нельсону (Nelson, 1977) предложить какую-либо модель генетического контроля признака, автор лишь сделал осторожное заключение о наличии частичного генетического контроля признака и не пытался обсуждать свои данные. Он полагает, что температура воды и наличие кальция или фтора могут также влиять на изменчивость признака. Кроме того, в аквариумах была высокая смертность икры, а в прудах обитали хищные беспозвоночные, что могло исказить соотношения фенотипов в расщеплениях в скрещиваниях. Однако на основании результатов работы Нельсона (Nelson, 1977) можно предположить, что модель детерминации «тазовых» фенотипов включает 2 и более генов, каждый по крайней мере с 2 или более аллелями. Судя по расщеплениям в скрещиваниях «С» х «С» и «А» х «А», ни один из этих фенотипов не является гомозиготным, они оба гетерозиготны, а скрещивание «С» х «А» показало отсутствие доминирования «дикого типа» и наличие рецессивных аллелей в генотипе, его детерминирующем. Кирпичников (1979, с. 84) предполагает, что редукция pelvis у колюшковых, как и у других рыб, «определяется простой рецессивной мутацией». Судя поданным Нельсона (Nelson, 1977), у Culaea это отнюдь не так. К тому же, судя по наличию серии непрерывных переходов между фенотипами «С» и «А», полигены также участвуют в генетическом контроле признака.
Североамериканские авторы показали, что изменчивость по структуре тазового пояса и числа спинных колючек Culaea inconstans детерминируется давлением хищных рыб и хищных насекомых (Nelson, 1969, 1971b; Reist, 1980а).
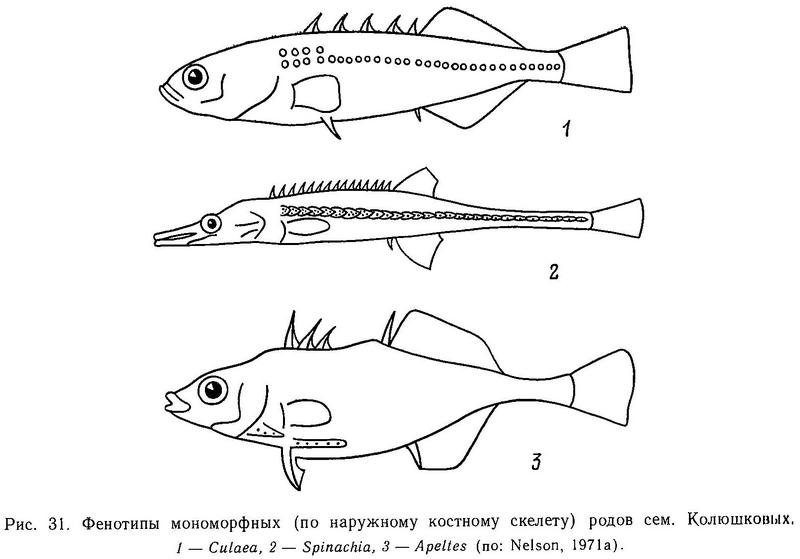
Фенотип Culaea inconstans не соответствует ни одному из 8 основных фенотипов, характерных для сем. Gasterosteidae в целом. Тело Culaea inconstans, на первый взгляд, голое и не покрыто типичными костными пластинами, характерными для других колюшек. Но при тщательном исследовании обнаруживается ряд из 30—36 очень мелких, не налегающих друг на друга костных бляшек, расположенных вдоль боковой линии, киля нет. В передней части тела имеется второй ряд пластин (обычно из 5 пластин), расположенный над основным рядом (Nelson, 1969, 1971а). Ареал Culaea inconstans — пресные воды в Сев. Америке в районе Великих Озер и Центральной Канады. Фенотип Culaea inconstans обнаруживает неожиданный параллелизм с фенотипом Pungitius platygaster aralensis из изолированной и бессточной р. Чу (Киргизия, СССР). Эта популяция описана Турдаковым и Пискаревым (1955), которые склонны выводить ее в самостоятельный подвид. У колюшек из р. Чу есть также 2 ряда мелких пластин, расположенных один над другим в передней части тела.
Рассмотрение фенотипов по признаку «костные пластины» в трех вышеуказанных родах показывает, что Spinachia и Apeltes в гомологическом ряду сем. Gasterosteidae занимают крайние положения, а Culaea inconstans и вовсе не вписывается в этот ряд (рис. 31).
Рассмотрение фенотипов по признаку «костные пластины» в трех вышеуказанных родах показывает, что Spinachia и Apeltes в гомологическом ряду сем. Gasterosteidae занимают крайние положения, а Culaea inconstans и вовсе не вписывается в этот ряд (рис. 31).
Жизнь животных. Том 4. Рыбы Под редакцией профессора Т.С.Расса 1971 г.
Ручьевая колюшка (Eucalia inconstans)
распространена в небольших речках
севера США. У нее 4—6 (обычно 5) шипов
перед спинным плавником. Длина тела
до 6 см. Этот вид очень активен и
многочислен. У всех ручьевых колюшек весной
самцы имеют ярко-красный брачный
наряд, строят гнезда и охраняют их, как
самцы трехиглой колюшки.





