(Gasterosteus Linnaeus, 1758) Род Гастеростеусы, Трёхиглые колюшки, Genus Gasterosteus Linnaeus, 1758 (Three-spined sticklebacks) 6 видов
Атлас аквариумных рыб. В.Каль, Б.Каль, Д.Фогт 2001 г.
К семейству Gasterosteidae принадлежит колюшка трехиглая рода Gasterosteus.
Фауна СССР. Рыбы. Том V, вып. 1. Семейство Колюшковых (Gasterosteidae) мировой фауны. В.В.Зюганов 1991 г.
1. Род GASTEROSTEUS Linne, 1758
— Gasterosteus Linne, 1758 : 295 (типовой вид Gasterosteus aculeatus Jordan, Gilbert, 1883 : 393, по последующему обозначению).
— Gasteracanthus Pallas, 1811 : 288 (типовой вид Gasteracanthus aculeatus Pallas, 1811 : 229, по первоначальному обозначению).
— Leiurus Swainsоn, 1839 : 242 (типовой вид Gasterosteus aculeatus Linne, 1758 : 295, по последующему обозначению).
— Gladinculus Jordan et Evermann, 1927 (типовой вид Gasterosteus gladinculus Kendall, 1896 : 623, по последующему обозначению).
— Gasterosteus: Берг, 1949 : 971 (синонимия, распространение); Nelson, 1971а : 427 (диагноз).
Супраклейтрум присутствует или отсутствует. Эктокоракоид простирается вперед дальше, чем клейтрум и соединяется с ним, образуя V-образную структуру с тупым углом. Задние отростки тазовой кости примыкают друг к другу, образуя брюшной щит; восходящий отросток — с насеченным дорсальным краем. Брюшная колючка зазубрена (редко гладкая), с 1 мягким лучом и расположена на уровне 5—6-го позвонка под серединой грудного плавника. Гипуральная пластина расщеплена на 2 части. Спинных колючек, расположенных на одной прямой линии, 3 (2 передние длинные и 3-я короткая), редко 2 и 4, как исключение 0, 1 или 5. Спинных колючек меньше, чем птеригиофоров, последних меньше, чем позвонков. Позвонков 28—33. Жаберные перепонки приращены к межжаберному промежутку. Тело голое или покрыто костными пластинами. Хвостовой стебель с килем или голый. Форма хвостового стебля в разрезе овальная, больше сжатая латерально, чем дорсовентрально.
ОПРЕДЕЛИТЕЛЬНАЯ ТАБЛИЦА ВИДОВ
1 (2). Брюшная колючка без заметного бугорка при основании. Gasterosteus aculeatus L., 1758, sp. complex
2 (1). Брюшная колючка с заметным бугорком при основании. Gasterosteus wheatlandi Putnam, 1867
Мне кажется, что и для родов Culaea и Gasterosteus хищники не являются общей причиной редукции таза. Вследствие того что роды занимают в водоеме разные ниши (более пелагическая и привязанная к открытым пространствам Gasterosteus aculeatus и придонная зарослевая Culaea inconstans), они несомненно имеют и разный набор хищников. Хищники эти применяют разную тактику охоты за жертвами, а жертвы разную тактику защиты. В частности, Gasterosteus aculeatus использует свои морфологические адаптации (крепкие и длинные спинные и брюшные колючки, скрепленные боковыми пластинками и восходящим отростком тазового пояса) и подпускает хищника на близкое расстояние (Hoogland et al., 1958), а Culaea inconstans, лишенная связи спинных и брюшных колючек посредством боковых пластин, должна использовать поведенческие адаптации, подобно такой же зарослевой форме, как Pungitius pungitius, которая, как известно, демонстрирует скрытное и осторожное поведение и реагирует на хищника с дальней дистанции (Wootton, 1976).
Нашу точку зрения подтверждает тот факт, что у Gasterosteus наблюдается четкая корреляция между редукцией таза и редукцией других защитных структур (спинными колючками, боковыми пластинами) (Campbell, 1979; Reimchen, 1980; Giles, 1983), а у Pungitius и Culaea такой корреляции нет, за исключением двух точек — в Ирландии (Nelson, 1971b) и Греции (Nelson, 1971b; Nelson, Atton, 1971; Stephanidis, 1971).
Обзор межродовой изменчивости колюшковых по числу боковых пластин выявляет 3 мономорфных рода, где нет заметной изменчивости по этому признаку (Spinachia, Culaea, Apeltes), и 2 чрезвычайно полиморфных рода Gasterosteus и Pungitius, включающих комплекс видов и форм, где в сумме реализованы 8 фенотипов, обнаруживающих удивительный межродовой параллелизм (Зюганов, 19836).
Все разнообразие морфологических вариантов по числу костных пластин в родах Gasterosteus и Pungitius по существу можно свести к 8 основным типам (рис. 4). Имеется всего 4 градации признака «пластины на теле»: 1) пластины полностью покрывают тело (20—30, чаще 25—27), 2) пластины частично покрывают тело (10—20, чаще 12—15), 3) пластин на теле мало (2—10, чаще 5—7), 4) пластин на теле нет (0). Это не условно выделяемые градации с плавным непрерывным переходом друг в друга, а реально существующие дискретные варианты в природных популяциях; если строить кривую распределения этого признака, суммируя множество популяций, то мы получим 4-модальную кривую с 4 пиками и 3 провалами между ними.

Имеется также 2 градации признака «киль на хвостовом стебле»: а) киль есть, б) киля нет. Более дробное разделение — киль сильно выражен и киль слабо выражен — мы не учитываем (здесь, как и в любой другой классификации живых объектов, неизбежно некоторое огрубление, поскольку чрезмерное дробление еще более опасно, чем огрубление).
Таким образом, все возможные сочетания 4 градаций пластин на теле и 2 градаций киля дают нам 8 возможных фенотипов (=морф, =морфотипов) у Pungitius и Gasterosteus. На основании литературных данных и собственных эксперименов по скрещиванию разных морф я полагаю, что пластины на теле и киль — два разных признака, детерминируемые разными локусами, но в ряде популяций эти локусы сцеплены (Зюганов, 1983 г.).
Как и всякая попытка формализации, эта схема не лишена некоторых элементов условности. Например, в полиморфных природных популяциях Gasterosteus aculeatus иногда трудно отнести некоторые особи к варианту 1 (а) (trachurus) или к 2 (а) (semiarmatus) в том случае, когда у этих особей имеется разрыв шириной в одну пластину между пластинами на теле и килем. Однако Хаген и Гильбертсон (Hagen, Gilbertson, 1973) отмечали, что скрещивания между такими особями давали расщепления в F1, характерные для trachurus. Скрещивания между особями с аналогичными разрывами, но шириной в 2 пластины (или более) давали расщепления, характерные для semiarmatus. Бывают случаи, когда с одной стороны тела у рыбы полный ряд пластин, а с другой — разрыв между килем и пластинами на теле. В этом случае, вероятно, надо при отнесении рыбы к тому или иному морфотипу ориентироваться на ту сторону, где признак наиболее развит, а другую сторону считать недоразвитием признака. Я не исключаю также возможности существования в ряде случаев фенокопий (модификация фенотипа, вызванная особыми условиями среды, напоминающая изменение фенотипа, обусловленное мутацией) (Майр, 1974), хотя до сих пор у трехиглой колюшки они обнаружены не были (Hagen, Gilbertson, 1973).
Как можно видеть из всего вышеизложенного, в изменчивости по боковым пластинам между родами Gasterosteus и Pungitius наблюдается поразительный параллелизм, и фенотипы по числу пластин в обоих родах образуют гомологические ряды.
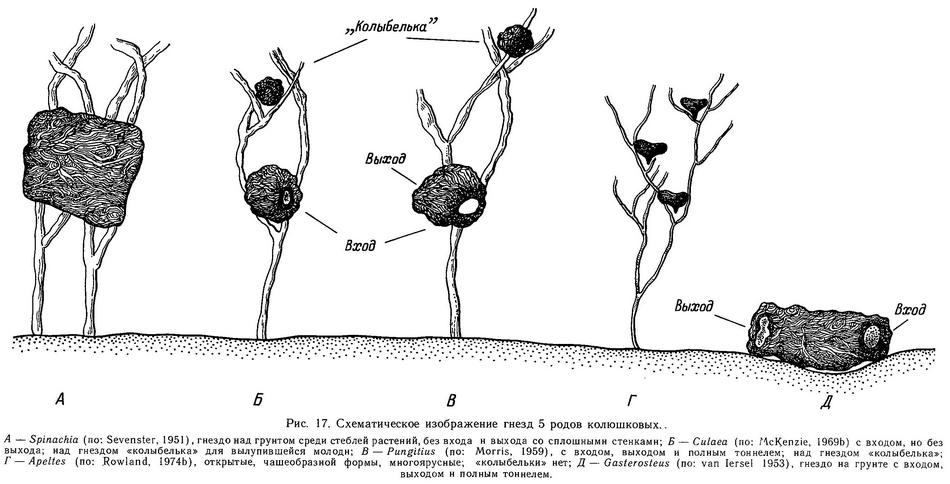
История описания и классификации видов внутри каждого рода колюшковых была не менее сложной. Например, для рода Gasterosteus сложилась такая ситуация, что к началу XX в. было описано 42 вида (табл. 7). Это произошло вследствие обнаружения высокой изменчивости трехиглой колюшки, необъятности ее ареала и господствующего в то время типологического подхода в систематике. Многие виды были описаны всего по нескольким экземплярам. Бертэну (Bertin, 1925) в результате тщательного анализа географической и экотипической изменчивости морфологии колюшки, а также всестороннего исследования биологии удалось показать, что все эти «виды» связаны многочисленными переходными формами. Часть изменчивости находится под прямым контролем внешней среды или является возрастной и половой. «Даже если рассматривать колюшек из одной популяции, одного поколения и из одной кладки икры — среди них невозможно найти 2 идентичные особи с разных точек зрения», — писал Бертэн (Bertin, 1925, с. 152).

Он свел все 42 вида в 1 (Gasterosteus aculeatus), выделил 6 признаков, имеющих альтернативные варианты (всего 17 вариантов), и определил, что различные комбинации этих вариантов в итоге дают 300 возможных фенотипов (правда, некоторые сочетания «запрещены», например trachura—apoda, — В. 3.).
Признаки, выделенные Бертэном, следующие.
Список видов рода Gasterosteus, синонимизированных Бертэном (Bertin, 1925) в Gasterosteus aculeatus
1. Степень вооружения боков пластинами: пластины идут от головы до хвостового плавника (trachura), пластины только спереди и на хвостовом стебле (semiarmata), то же, но хвост голый (gymnura = leiura), пластин и киля совсем нет (hologymna), тело голое, но киль есть (carinata).
2. Число колючек в D: 3 — teraculeata, 4 — tetracantha, 2 — biarmata.
3. Форма тела рыбы: высокая (brevis), удлиненная (gracilis).
4. Длина колючек в D: короткие — brachycentra, длинные — dolichocentra.
5. Длина колючек в V: короткие — brachypoda, длинные — dolichopoda, нет колючек — apoda.
6. Зазубренность колючек: гладкие — leiocentra, зазубренные — trachicentra.
Например, фенотип какой-либо колюшки можно охарактеризовать: gymnura — teraculeata — brevis — dolichocentra — dolychopoda — leiocentra.
Все эти фенотипы не имеют приуроченности к определенным географическим районам. В дальнейшем систематики согласились, что все разнообразие форм можно рассматривать как выражение изменчивости одного политипического и полиморфного таксономического вида Gasterosteus aculeatus-complex, и после работы Бертэна (Bertin, 1925) описание таксономических видов в роде Gasterosteus в целом прекратилось. Была, правда, недавно сделана одна такая попытка Хагеном (Hagen, 1967), который обнаружил в ручьях Британской Колумбии (Канада) репродуктивную изоляцию двух морфологически отличимых парапатрических форм: морской (trachurus) и жилой (leiurus). Морскую он назвал Gasterosteus trachurus, а жилую Gasterosteus aculeatus. Его классификацию не приняли, и Хаген в дальнейшем сам отказался от этой таксономической классификации (Hagen, McPhail, 1970). Тем не менее эта работа Хагена, а также последующие работы его и соавторов выявили интереснейшую эволюционную ситуацию, когда в одних местах формы ведут себя «как виды», а в других те же формы могут широко гибридизировать, вдлоть до слияния (Bell, 1984). Более подробно проблема вида в роде Gasterosteus будет рассмотрена в разделе 4.5.6.
В списке 42 видов трехиглых колюшек, которые Бертэн (Bertin, 1925) свел в 1 вид, под номером 27 (табл. 7) фигурировал Gasterosteus wheatlandi Putnam, 1866. Недавними исследованиями американских ихтиологов была доказана полная самостоятельность этого вида (Reisman, 1968b; Mclnerney, 1969).
Таким образом, сейчас в роде Gasterosteus признается 2 таксономических вида: Gasterosteus aculeatus species-complex и Gasterosteus wheatlandi (Wootton, 1976; Bell, 1984).
4.3. ПАЛЕОНТОЛОГИЧЕСКИЕ ДАННЫЕ
В связи с небольшим количеством находок ископаемых остатков Gasterosteidae история семейства остается до сих пор малоизвестной. Удивительно, что до сих пор были описаны только ископаемые родов Gasterosteus и Pungitius, самых продвинутых и, очевидно, молодых родов. Белл (Bell, 1984), один из специалистов по палеонтологии колюшковых, утверждает, что «ископаемые остатки Gasterosteus и Pungitius полностью неинформативны в отношении филогении» (с. 436). Все ископаемые датируются миоценом, плиоценом и плейстоценом и найдены в морских и пресноводных отложениях Западной Сибири, Северного Китая, Аляски, Калифорнии, Невады (США) и не обнаружены в хорошо изученной пресноводной палеоихтиофауне Европы. В целом можно сказать, что миоценово-плиоценовые ископаемые колюшек приурочены к бассейну Тихого океана и в меньшей степени Северного Ледовитого океана.
Род Gasterosteus. Впервые ископаемые остатки Gasterosteus были обнаружены в плиоценовых пресноводных отложениях штата Невада (США) Хэй (Hay, 1907) и Джорданом (Jordan, 1907, 1908). Джордан (Jordan, 1908) назвал ископаемый вид Gasterosteus doryssus. По его мнению, Gasterosteus doryssus отличается от Gasterosteus williamsoni (по терминологии Миллера и Хаббса — Miller, Hubbs, 1969 — Gasterosteus aculeatus williamsoni) более удлиненным телом и более длинными колючками. Мурал (Mural, 1973), изучивший голотип Gasterosteus doryssus, отмечал, что у древней колюшки отсутствуют боковые пластины, имеются 3 спинные колючки, нормально развитый тазовый пояс и несколько меньшее число лучей в спинном плавнике в сравнении с Gasterosteus aculeatus, что может быть связано с условиями захоронения. Таким образом, этот ископаемый вид почти не имеет отличий от Gasterosteus aculeatus.
Мурал (Mural, 1973) описал новый ископаемый вид из пресноводных плиоценовых отложений Невады — Gasterosteus apodus, отличающийся редукцией костных пластин, первой спинной колючки и тазового пояса. Однако у многих североамериканских популяций современной Gasterosteus aculeatus наблюдается редукция спинных и брюшных колючек, тазового пояса и боковых пластин (Bell, 1984), так что в этом смысле Gasterosteus apodus не выходит за рамки изменчивости Gasterosteus aculeatus. Дэвид (David, 1945, — цит. по: Bell, 1973) описал из среднеплиоценовых пресноводных отложений Калифорнии (США) ископаемый вид Pungitius haynesi, который Белл (Bell, 1973) переисследовал и отнес к Gasterosteus aculeatus на основании наличия расщепленной гипуральной пластины — важного диагностического признака Gasterosteus. У этого ископаемого отсутствуют костные пластины, частично редуцирован тазовый пояс и нет первой спинной колючки. У всех вышеописанных пресноводных плиоценовых колюшек, а также у описанной Беллом (Bell, 1973) плейстоценовой пресноводной колюшки отсутствовали боковые костные пластины или их число было сильно редуцировано, т. е. они принадлежали к морфам leiurus и hologymna. Однако в Восточной Канаде (Онтарио) Мак-Алистер с соавт. (McAlister et al., 1981) в плейстоценовых пресноводных отложениях обнаружили trachurus, и сейчас там в пресноводных водах доминирует trachurus.
В 1977 г. Белл описал из морских позднемиоценовых отложений (возраст 10 млн лет) Южной Калифорнии ископаемую Gasterosteus aculeatus (форма trachurus) (Bell, 1977). Она ничем не отличалась от современной морской формы trachurus трехиглой колюшки кроме взаимного расположения начала спинного и анального плавников. Если у современной Gasterosteus aculeatus спинной плавник сдвинут несколько вперед по сравнению с анальным, то у позднемиоценовой Gasterosteus aculeatus спинной плавник располагается точно над анальным (так же, как у современной Pungitius и Culaea) (Nelson, 1971). Белл (Bell, 1977) предположил, что миоценовая Gasterosteus aculeatus менее дивергировала от Pungitius и Culaea, но тут же сам себя опроверг, отметив, что у более примитивных родов Spinachia и Apeltes спинной плавник сдвинут вперед, так что изменение расположения D-плавника вряд ли отражает филогенетические отношения.
Белл и Хаглунд (Bell, Haglund, 1982) исследовали позднемиоценовую Truckee — формацию в штате Невада, содержащую остатки Gasterosteus doryssus в интервале 150 тыс. лет. Они обнаружили, что за интервал в 36 тыс. лет частота особей с 1 спинной колючкой падает с 69 до 21%., а доля «бесколючковых» особей за это время увеличивается с 29 до 79 %. Авторы рассчитали увеличение частоты бесколючковых особей — 0.137 х 10-3 в год при объеме выборки в несколько сотен особей (n = 450).
Ископаемые среднемиоценовые колюшки были недавно найдены на Дальнем Востоке (СССР) (Сычевская, Гречина, 1981). Один вид — Gasterosteus abnormis — был описан по 2 отпечаткам в среднемиоценовых морских отложениях Западного Сахалина (возраст их, очевидно, 16 млн лет — В. З.). Он имеет фенотип trachurus (38 пластин, что превышает верхний предел колебаний у современных trachurus — 35) и отличается от современных Gasterosteus aculeatus расположением, спинных колючек, передние 2 из которых у него сильно сближены, хотя Миллер и Хаббс (Miller, Hubbs, 1969) отмечали то же самое для калифорнийских современных колюшек Gasterosteus aculeatus williamsoni. Задний отросток брюшной пластины тазового пояса у Gasterosteus abnormis сильно укорочен, но редукции тазового пояса и брюшной колючки нет.
Другой вид — Gasterosteus orientalis был описан по 5 отпечаткам из среднемиоценовых пресноводных отложений бассейна р. Ковавля (Камчатка) и имел фенотип semiarmatus (10+8 боковых пластин). У него 4 спинные колючки, удлиненное рыло и 3 мягких луча в брюшном плавнике (Сычевская, Гречина, 1981). Линдсей (Lindsey, 1962) показал, что воздействие повышенной температуры в онтогенезе трехиглой колюшки может индуцировать фенотипы с 4 колючками; кроме того, Гросс (Gross, 1978), нашел, что в некоторых современных пресноводных популяциях Западной Европы встречаемость особей с 4 колючками достигает 17 %.
Из всех признаков этих 2 новых видов безусловно самый серьезный — наличие 3 мягких лучей в брюшном плавнике, все остальные особенности вполне «вписываются» в пределы колебаний признаков современных Gasterosteus aculeatus. 3 мягких луча в брюшном плавнике не встречаются ни у одного из современных родов Gasterosteidae (только 0—2 луча), но отмечено у неогеновой Pungitius, что дало основание Штылько (1934) выделить палеоколюшку в новый род Gasterosteops, но было поставлено под сомнение Бергом (1940). У близких родственников колюшек — представителей сем. Aulorhynchidae — 4 луча в этом плавнике (Nelson, 1971а), поэтому 3-лучевую Gasterosteus orientalis поданному признаку можно рассматривать как переходную между Aulorhynchidae и Gasterosteidae, однако серьезное филогенетическое значение это вряд ли имеет. В целом можно заключить, что все ископаемые находки Gasterosteus приурочены к азиатскому и североамериканскому побережьям Северной Пацифики — морские находки имеют возраст примерно 10—16 млн лет и представлены фенотипом trachurus, а пресноводные находки — 3—8 млн лет и представлены фенотипами hologymna и leiurus. Эти факты предполагают связь возникновения Gasterosteus именно с этим районом (вспомним, что Aulorhynchidae обитает также в этой части Тихого океана). Однако такое заключение вряд ли следует рассматривать как «истину в последней инстанции», и, возможно, более тщательные поиски ископаемых Gasterosteus в других районах увенчаются успехом и перевернут наши представления о центре возникновения рода.
Вопреки скептическому отношению Белла (Bell, 1984) к возможностям получения ценной (с точки зрения филогенеза) информации из скудных палеоданных по колюшковым, можно заключить, что эти данные помогли пролить свет на некоторые неясные моменты в картине исторического развития и направления эволюции в группе. Например, стало ясно, что род Gasterosteus сформировался в основном уже в среднем миоцене и исходным для него была прибрежно-морская форма trachurus с анадромным циклом, приуроченная к Североамериканскому и Азиатскому побережьям Северной Пацифики. Дифференциация Gasterosteus на анадромную trachurus и пресноводную leiurus — hologymna произошла уже в нижнем плиоцене, а не в плейстоцене, как это считал Мюнцинг (Münzing, 1959, 1963). Все находки неогеновых Gasterosteus не выходят за рамки современного его ареала, так что ареал в основном сформировался уже 10 млн. лет назад.
Неогеновые находки Gasterosteus и Pungitius позволяют сделать заключение о направлении эволюции по крайней мере по трем признакам: числу лучей в брюшном плавнике, числу спинных колючек и боковых пластин. По всем трем признакам несомненно шла редукция, причем, если в неогене колюшки имели 3 луча в брюшном плавнике, то в наше время ни один вид колюшковых не обладает этой особенностью, а по остальным двум признакам редукция имела место в ряде неогеновых популяций, а в некоторых — нет; имеет она место и в ряде современных популяций.
4. 5.1. ГЕНЕТИКА РАЗНЫХ ПРИЗНАКОВ
Полиморфизм по числу костных щитков трехиглой колюшки. Этот полиморфизм составляет одну из главных тем эволюционной генетики колюшки. Генетика полиморфизма изучалась многими авторами (Münzing, 1959; Lindsey, 1962а; Hagen, 1967, 1973; Hagen, Gilbertson, 1973; Avise, 1976; Paepke, 1982; Зюганов, 1983г).
Терминология морф (=морфотипов, =фенотипов) колюшек по числу боковых костных пластин дана в разделе 1.7. Необходимо напомнить, что термин «морфа» используется здесь и далее для обозначения фенотипического варианта (trachurus, semiarmatus, leiurus и т. д.) безотносительно к его популяционному или таксономическому статусу.
Генетическому анализу были подвергнуты лишь 4 основных фенотипа: trachurus, semiarmatus, leiurus, hologymna.
Мюнцинг (Münzing, 1959) на основании гибридологического анализа колюшек из полиморфной популяции р. Эльбы установил, что фенотипы определяются 1 локусом с 2 аллелями. Доминантная и рецессивная гомозиготы относятся к trachurus (АА) и leiurus (аа), а гетерозигота (Аа) к semiarmatus при неполном доминировании. Изменчивость по числу пластин внутри каждой морфы контролируется множеством мелких генов-модификаторов. Хаген и Гильбертсон (Hagen, Gilbertson, 1973) на популяциях колюшек из водоемов штата Вашингтон показали, что наследование числа пластин на теле определяется 2 локусами с 2 аллелями каждый («major genes»), причем кроме этого имеется много полигенов, поскольку внутри каждой морфы (trachurus, semiarmatus, leiurus) есть изменчивость по числу пластин на теле. В среднем коэффициент наследуемости пластин leiurus h2=0.84 при 20 °С и h2=0.50 при 16 °С. По Хагену и Гильбертсону (Hagen, Gilbertson, 1973), имеется всего 9 генотипов, контролирующих 3 фенотипа колюшки. Если в генотипе 3 и больше доминантных аллеля, то это complete=trachurus, 2 — partial=semiarmatus, 1 или 0 — low=leiurus (рис. 27). На основании типичного дигибридного характера расщепления морф в F1 и F2 авторы полагают, что локусы А и В аутосомные и несцепленные, взаимодействие их аддитивное.

Эвайс (Avise, 1976), который работал с «необычной» диморфной популяцией колюшек из Калифорнии «Фриант», где встречаются только фенотипы complete и low, установил, что complete в F1 полностью доминирует над low. Результаты его внутрипопуляционных скрещиваний хорошо описываются моногенной моделью с полным доминированием, если принять, что генотипы complete — АА и Аа, а генотип low — аа. Однако когда в скрещиваниях использовались родители фенотипов complete и low из других аллопатричных популяций: complete (Фриант) х low (Напа) или complete (Наварро) х low (Фриант), то в F1 помимо этих 2 фенотипов выщеплялись partial (=semiarmatus).
Похоже, что в разных популяциях колюшки наследование боковых пластин определяется по-разному: в р. Эльба — моногенно, с неполным доминированием, в Калифорнии — моногенно, с полным доминированием, а в штате Вашингтон — дигенно. Однако на основании анализа расщеплений, полученных упомянутыми выше авторами, была предложена новая модель наследования боковых пластин на теле, удовлетворительно объясняющая подавляющее большинство противоречивых, на первый взгляд, результатов скрещиваний, проведенных разными авторами (Зюганов, 1980). Я предположил, что отношения между аллелями А и а основного морфогенного локуса регулируются неаллельным, несцепленным локусом С (модификатором доминирования). Двойная доза рецессивного аллеля сс переводит доминирование А из неполного в полное, в то время как СС и Сс не влияют на доминирование А. В этой модели взаимоотношения между неаллельными генами А и С — эпистатические (рис. 28).

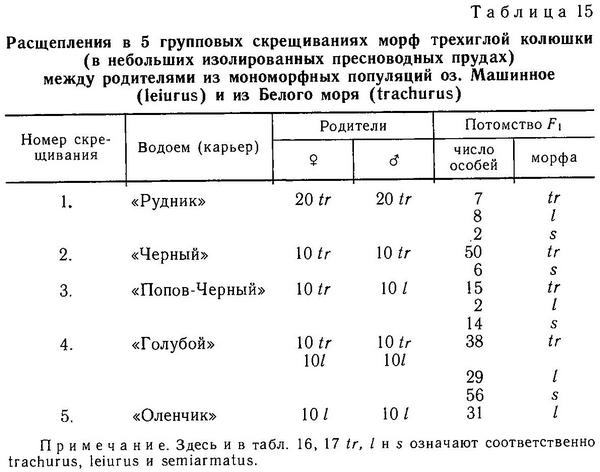
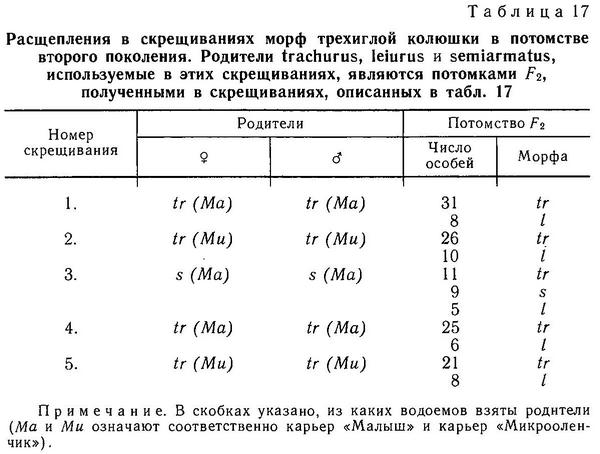
Полагаем, что в популяциях типа «Фриант» фиксирован аллель с и доминирование complete будет обязательно полным, а в других популяциях, где есть фенотипы complete, partial, low, такой фиксации не произошло и расщепления в скрещиваниях будут носить дигибридный характер, как это и получилось в некоторых скрещиваниях Мюнцинга (Münzing, 1959), Хагена и Гильбертсона (Hagen, Gilbertson, 1973) и межпопуляционных скрещиваниях Эвайса (Avise, 1976). Наша модель подтвердилась после проведенных скрещиваний 3 морф trachurus, leiurus и semiarmatus в аквариумах и водоемах бассейна Белого моря, карьерах, затопленных грунтовыми водами, где не было никаких рыб до экспериментов. В этих водоемах была проведена серия специальных скрещиваний (индивидуальных и групповых) и получено потомство F2 (табл. 15—17) (Зюганов, 1983г). Позже было получено F3, проведены анализирующие скрещивания, и сейчас в 2 карьерах имеются 2 диморфные популяции, подобные «необычной» популяции «Фриант», с генотипами trachurus ААсс и ААсс и leiurus аасс. Таким образом, сейчас мы располагаем линиями колюшек фенотипа leiurus, полностью гомозиготными по обоим локусам а и с. Эти линии аасс можно использовать для анализирующих скрещиваний с любыми фенотипами из любых участков ареала Gasterosteus aculeatus (Зюганов, 19856).

Росс (Ross, 1973) провел ряд скрещиваний между leiurus (3b) и hologymna. (4b) (по его терминологии, microcephalus и williamsoni). Leiurus обнаруживает частичное доминирование над hologymna, у которой костные пластины вообще отсутствуют. Хаген и Гильбертсон (Hagen, Gilbertson, 1973) при скрещивании «leiurus with a keel» (3а) (из мономорфной популяции «Квинаулт») саму на себя обнаружил, что в F1 нет расщепления во всех 4 экспериментах (n=182) (они относят «leiurus with a keel» к фенотипу partial). Фенотип partial, полученный от скрещивания complete х low, при скрещивании самого на себя всегда расщепляется в F2 на фенотипы complete, partial, low.
Мы полагаем, что киль является независимым признаком и детерминируется простой моногенной системой: КК и Кк — есть киль, кк — нет киля. В большинстве популяций ген «К» тесно сцеплен с геном «А», контролирующим пластины на теле, а ген «к» сцеплен с геном «а». Поэтому всегда фенотип trachurus имеет киль (найден всего 1 экз. trachurus без киля). Поэтому также всегда фенотип semiarmatus (= partial), который гетерозиготен и по гену «А», и по гену «К», расщепляется при скрещивании самого на себя на complete, partial, low. Однако в некоторых популяциях, мономорфных по фенотипу «leiurus with a keel» — «Изник» (Münzing, 1962) или «Квинаулт» (Hagen, Gilbertson, 1973), по нашему мнению, закрепился результат кроссинговера. Ген «а» оказался сцепленным с геном «К», поэтому колюшки такого фенотипа могут образовывать мономорфные популяции и не расщепляются при скрещивании сам на себя. Подтверждением гомозиготности «чистых» популяций partial служит факт их низкой изменчивости по числу пластин, обнаруженный Кинардом и Карри (Kynard, Curry, 1976) и Коадом и Повером (Coad, Power, 1974). В то же время в полиморфных популяциях partial всегда характеризуется большей изменчивостью вследствие несбалансированного генного комплекса, там, где partial является продуктом скрещивания leiurus и trachurus (Münzing, 1959; Зюганов, 1980; Paepke, 1982).
Схема наследования, предложенная нами, относится только к пластинам на теле, безотносительно к признаку «киль», и она также не учитывает существования фенотипа hologymna, поскольку мы не имели в распоряжении особей этого фенотипа в скрещиваниях.
Подводя итоги описаниям результатов скрещиваний морф Gasterosteus acculeatus, можно резюмировать, что схема наследования признака «боковые пластинки на теле» явно олигогенная. То же можно сказать о признаке «киль». Об олигогенности свидетельствует менделевский характер расщепления. Фенотип trachurus доминантен или полудоминантен, а фенотип leiurus — рецессивен, поскольку скрещивания leiurus х leiurus обычно никогда не дают расщепления (Münzing, 1959; Hagen, Gilbertson, 1973; Avise, 1976; Paepke, 1982; Зюганов, 1983г).
Изменчивость по числу пластин внутри каждой морфы контролируется полигенами и частично зависит от условий развития рыб. Так, Линдсей (Lindsey, 1962а) показал, что у потомства от скрещивания leiurus х leiurus низкие температуры выращивания икры вызывают незначительное уменьшение числа боковых пластин, а изменение солености не дает никаких эффектов.
Хэй (Hay, 1974; цит. по: Wootton, 1976) провел интересную работу по генетике Gasterosteus aculeatus. Во первых, он считает,что критерием отделения semiarmatus от leiurus является не наличие киля у первой (и с этим я полностью согласен — В. З.), а отсутствие особой боковой пластинки у последней. Если наиболее переднюю пластинку обозначать «А», а последующие «В», «С» и т. д., то у leiurus всегда отсутствует пластинка «I», которая неизменно присутствует у semiarmatus, безотносительно к тому, есть у нее киль или нет. Хэй показал, что обладание этой пластинкой «I» находится под генетическим контролем. Скрещивания между рыбами, имеющими пластинку «I», дают расщепление на потомство с «I»-пластинкой (semiarmatus) и без «I»-пластинки (leiurus). Скрещивания внутри leiurus никогда не дают рыб с «I»-пластинкой. К сожалению, я не располагаю этой работой Хэя, и не совсем явно, то ли «I»-пластинка — просто 9-я по счету (в соответствии с английским алфавитом), то ли она обладает какой-то особой формой у американских semiarmatus.
Рот (Roth, 1920) и Игараши (Igarashi, 1964) обнаружили, что во время развития trachurus проходит стадия leiurus и semiarmatus, т. е. у trachurus имеются два центра закладки пластин — первыми появляются пластины в грудном отделе и затем на хвостовом стебле, пластины на теле и киле в онтогенезе нарастают друг на друга. Игараши (Igarashi, 1964) предполагает, что leiurus и semiarmatus произошли от наиболее примитивного состояния признака — trachurus путем неотенизации. Белл (Bell, 1981) нашел сходную корреляцию между числом «грудных» и «килевых» пластин у неполовозрелых trachurus и у взрослых semiarmatus и также предположил возникновение leiurus и semiarmatus от trachurus путем педоморфоза (неотении). Он считает, что различия по числу пластин между leiurus и trachurus существуют благодаря разной скорости нарастания (увеличения числа) пластин, по отношению к размеру тела. Таким образом, локусы, детерминирующие морфы, контролируют собственно скорость нарастания пластин.
В разделе 1.3 уже упоминалась работа Пенчака (Penczak, 1961а) по регенерации пластин у колюшки, им было экспериментально выявлено, что полное удаление большого числа пластин приводило к их одновременной регенерации через 100—150 дней, а удаление только частей пластин приводило к еще более быстрой регенерации.

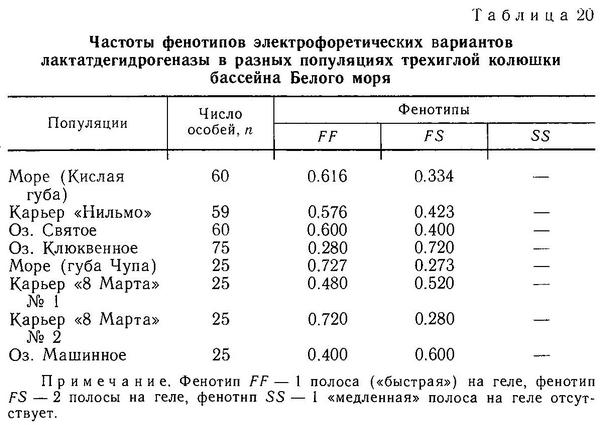
Так, в расщеплении типа 1 присутствует только фенотип hologymna (табл. 19) (нет пластин на теле) с пенетрантностью 100 %, что говорит о полном доминировании и даже, «сверхдоминировании» малого числа пластин над большим. У Gasterosteus в аналогичном скрещивании trachurus х leiurus (имеется в виду только признак «пластины на теле») фенотип hologymna никогда не выщеплялся, хотя скрещиваний подобного типа проведено несколько десятков разными авторами и в разных участках ареала, что исключает случайность. Ращепление типа 2 также показывает рецессивность фенотипа trachurus (=lb) у Pungitius. Расщепление типа 3 у Pungitius наиболее близко к расщеплению типа 6 у Gasterosteus (табл. 20), но все же у Pungitius в этом расщеплении присутствует фенотип hologymna с частотой 1/4, а у Gasterosteus этого нет. Можно полагать, что у Pungitius в отличие от Gasterosteus кроме основного гена «А» и модификатора «с» есть еще 1 или 2 гена, участвующих в детерминации признака «боковые пластины на теле».
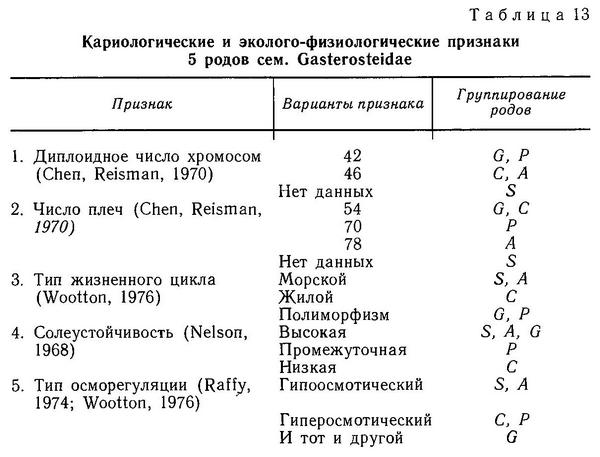
Gasterosteus aculeatus и Gasterosteus wheatlandi имеют 2n=42 хромосом и незначительно различаются по морфологии хромосом, у Gasterosteus wheatlandi меньше на 2 пары метацентрических хромосом и соответственно меньше на 2 число плеч (52 против 54 у Gasterosteus aculeatus) (табл. 13). Интересно, что у Gasterosteus wheatlandi найдена мужская гетерогаметность типа XY, а у Gasterosteus aculeatus гетерогаметный пол цитогенетически не выявляется. У Apeltes, наоборот, гетерогаметностью обладают самки — типа WZ (Chen, Reisman, 1970).
Эволюционно-таксономические отношения форм в роде Gasterosteus. Как уже отмечалось в разделе 4.1, важной вехой в истории классификации рода Gasterosteus явилась работа Бертэна (Bertin, 1925), синонимизировавшего все 42 «вида», выделенных ранее систематиками-типологами. Бертэн ввел все их в один политипический и полиморфный вид Gasterosteus aculeatus-complex. Впоследствии из него был выделен самостоятельный вид Gasterosteus wheatlandi, симпатричный с Gasterosteus aculeatus, на Атлантическом побережье Сев. Америки. Морфологически он очень трудно отличим от Gasterosteus aculeatus, но все же его можно отличить от последнего наличием бугорка у основания брюшной колючки, брачной окраской самцов и самок (Mclnerney, 1969). Доказано, что этологические изолирующие мехинизмы между двумя видами хорошо развиты и эффективно предотвращают обмен генами (Reisman, 1968b).
Итак, в настоящее время род Gasterosteus состоит из 2 номинальных видов: Gasterosteus aculeatus и Gasterosteus wheatlandi.
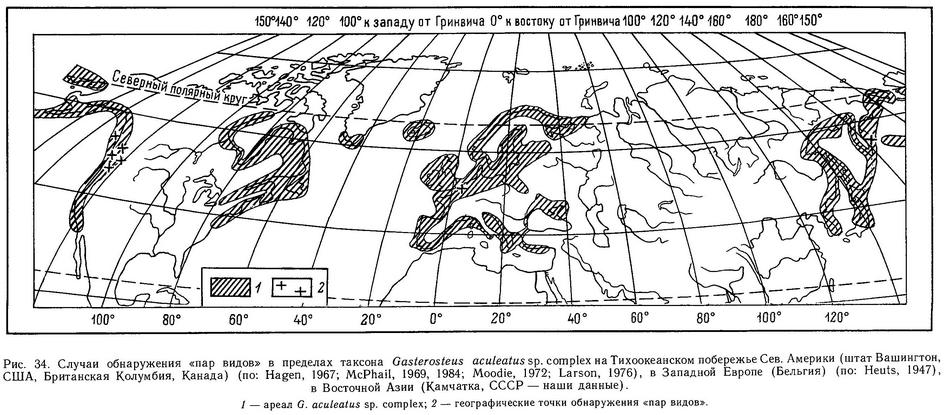
Хотя описание таксономических видов в роде Gasterosteus в основном прекратилось после работы Бертэна (1925), но полевыми и экспериментальными исследованиями во второй половине столетия выявилось много ситуаций, когда между разными формами Gasterosteus aculeatus обнаруживалась строгая репродуктивная изоляция. К настоящему времени на Тихоокеанском побережье Сев. Америки и Азии обнаружено 5 географических точек, где имеются такие ситуации (рис. 34).
Так, Хаген (Hagen, 1967) изучил подобную ситуацию в ручье Литтл Кэмпбелл (на границе между штатом Вашингтон (США) и Британской Колумбии (Канада). В верхней части ручья (длина которого 20 км) обитает leiurus, а в нижней нерестится проходная trachurus и на участке 1,5 км имеется гибридная зона. Две формы различались между собой морфологически: помимо боковых пластинок они различались по длине тела, числу жаберных тычинок, лучей спинного и анального плавника, позвонков, длине и форме брюшных колючек, окраске, э/ф спектру белков и другим признакам. Хаген (Hagen, 1967) выявил механизмы репродуктивной изоляции между ними: это сезонная и биотопическая изоляция. Хотя ему не удалось выявить в эксперименте этологической изоляции между ними, поскольку он использовал тесты по «ориентации» самки на самца, позднее Хэй и Мак-Фейл (Hay, McPhail, 1975) на том же материале, применив другую методику экспериментов, обнаружили, что в тестах по предпочтению в аквариумах самки trachurus намного чаще предпочитали скрещиваться с самцами trachurus, а самки leiurus соответственно с самцами своей формы. Интересно, что искусственно полученные гибриды leiurus х trachurus были вполне жизнеспособными и плодовитыми (Hagen, 1967).
Остальные случаи обнаружения генетической изоляции на Тихоокеанском побережье Сев. Америки относятся к разным формам морфы leiurus. Мак-Фейл (McPhail, 1969) в бассейне р. Чехэлис (п-ов Олимпия, штат Вашингтон, США) обнаружил две формы (обе относятся к морфе leiurus), различающиеся брачной окраской самцов («красные» и «черные»), числом жаберных тычинок, положением спинных колючек на теле, устойчивостью к высокой солености воды. Обе формы парапатричны (ареалы их слегка перекрываются), и возникновение «черной» формы Мак-Фейл (McPhail, 1969) и Хаген и др. (Hagen et al., 1972) объясняют таким фактором отбора, как обитание в р. Чэхэлис Novumbra hubbsi (см. разделы 1.4 и 4.5.4). Скрещивания между «черной» и «красной» формами показали, что самки-гибриды имеют пониженную жизнеспособность и плодовитость. Самцы-гибриды вяло вентилировали икру в гнездах, что приводило к повышенной гибели икры. Кроме частичной посткопуляционной изоляции наблюдалась и прекопуляционная. Так, самки «красной» формы предпочитали при наличии выбора в эксперименте нереститься с «красными» самцами, а самки «черной» формы также предпочитали самцов своего фенотипа. Это имело место, когда в скрещиваниях участвовали производители, взятые из парапатричных (соседних) популяций. Когда же для скрещиваний с «черными» самками использовали «красных» самцов из удаленной от р. Чехэлис популяции, то «черные» самки предпочитали их даже больше, чем «своих» самцов. Этот феномен Белл (Bell, 1976b) относит к эффекту «репродуктивного смещения признака», призванному защитить чистоту генофонда «черной» формы именно от соседней, парапатричной «красной» формы, т. е. репродуктивная изоляция в данном случае выработалась «на месте», на границе обитания двух форм. Таким образом, возникает интересная эволюционная ситуация, когда «черная» форма ведет себя как «вид» по отношению к соседней, граничащей с ней «красной», но не является видом по отношению к удаленной, аллопатричной «красной» форме.
Муди (Moodie, 1972а, 1972b), Муди и Реймчен (Moodie, Reimchen, 1973, 1976а, 1976b) исследовали взаимоотношения между двумя формами leiurus, обитающими в оз. Майер (острова Королевы Шарлотты, Канада). «Черная» колюшка живет в самом озере, a leiurus в ручьях; впадающих в него. «Черная» больше по размерам тела, чем leiurus, имеет более длинные брюшные колючки, более прогонистое тело, больше жаберных тычинок, позвонков, лучей в спинном, анальном плавниках. Авторы рассматривают характеристики «черной» колюшки (крупные размеры тела, отсутствие брачной окраски, длинные колючки) как адаптацию к жизни в пелагиале и ответ на сильное давление хищничества со стороны Salmo clarki и Cottus asper. Обе формы аллопатричны по отношению к морской trachurus (расстояние между озером и морем 16 км), Муди (Moodie, 1972а) в эксперименте выявил, что самки «черной» формы этологически изолированы от самцов leiurus. Хотя Муди (Moodie, 1972а) убежден, что в бассейне оз. Майер обитают 2 биологически изолированных вида, он воздерживается от придания им формального таксономического статуса.
Ларсон (Larson, 1976) исследовал 2 симпатрические формы колюшки в оз. Пакстон (о. Тексада, Тихоокеанское побережье Британской Колумбии, Канада). Он обнаружил, что одна форма является пелагической, стайной, неагрессивной, предпочитающей держаться у поверхности воды. Другая форма — бентическая, нестайная, агрессивная, держащаяся у дна. Первая форма — планктофаг, а вторая — бентофаг. В аквариумах обе формы занимали местообитания (при наличии выбора) в соответствии с их природными экологическими предпочтениями. Между формами обнаруживались существенные морфологические различия: пелагическая форма (морфа leiurus) имела 9—14 боковых пластин, нормально развитый тазовый пояс, спинные и брюшные колючки, число жаберных тычинок варьировало у нее от 18 до 25, в то время как бентическая форма (морфа hologymna) не имела боковых пластин, у части особей отсутствовала одна спинная колючка, она лишена брюшных колючек и тазового пояса, а число жаберных тычинок у нее 11—21. По мнению Ларсона (Larson, 1976), обе формы являются разными видами, но он воздерживается от придания им формального таксономического статуса.
Мак-Фейл (McPhail, 1984) исследовал 2 симпатрические формы колюшки в оз. Энос (о. Ванкувер, Тихоокеанское побережье Британской Колумбии, Канада). Как и в оз. Пакстон, исследованном Ларсоном (Larson, 1976), в оз. Энос обнаружены «пелагическая» и «бентическая» формы колюшки. Однако здесь обе формы принадлежат морфе leiurus (5 пластин на теле) и морфологически отличаются формой тела (бентическая форма более высокотела), числом лучей в анальном плавнике (у бентической меньше лучей), числом жаберных тычинок (у бентической 16—21, у пелагической 22—28), брачной окраской самцов (у самцов пелагической формы окраска типичная красная, у бентической — черная). Между ними также обнаружены отличия по 8 пластическим признакам (длина жаберных тычинок, брюшных колючек, рыла, головы и т. д.). Обе формы различались по э/ф-спектру трех белков. Интересно, что искусственно выращенные гибриды F1 и F2 были плодовиты и не обнаруживали пониженной жизнеспособности. Обсуждая взаимоотношения пелагической формы оз. Энос и оз. Пакстон (поскольку озера расположены неподалеку), Мак-Фейл (McPhail, 1984) приходит к выводу, что пелагическая форма оз. Энос — «уникальный дериватный вид», а бентическая форма обоих озер в принципе «одно и то же». Правда, читатель, сравнивая данные обеих работ, найдет, что бентическая форма в оз. Пакстон лишена пластин, тазового пояса, брюшных колючек в отличие от таковой оз. Энос, а в оз. Энос бентическая форма — меланист, но Мак-Фейл (McPhail, 1984) почему-то не придает значения таким отличиям. Несмотря на то что гибриды F1 и F2 между двумя формами в оз. Энос плодовиты и жизнеспособны, автор считает их различными «биологическими видами», предполагая, что «должен быть сильный отбор против гибридов и высокая степень положительной ассортативности в скрещиваниях внутри каждой формы». Его предположения были подтверждены, и вскоре Риджвэй и Мак-Фейл (Ridgway, McPhail, 1984) экспериментально показали наличие репродуктивной этологической изоляции между двумя формами. Самцы пелагической формы строят гнезда на открытом грунте, а бентической — в зоне растительности, хотя часто обе формы занимают соседние участки. Нерест между самцом одной формы и самкой другой прерывался на фазе «ведение к гнезду». Авторы отмечают, что этологическая изоляция между формами настолько сильна, что гибридов в озере встречается менее 1 %. Недавно нами (совместно с К. А. Савваитовой, Г. А. Головатюк и В. Ф. Бугаевым) были обнаружены генетически изолированные симпатрические группировки в оз. Азабачьем (бассейн р. Камчатка, п-ов Камчатка, — Зюганов и др., 1987). В озере постоянно обитает жилая морфа leiurus, а весной и летом туда на нерест из моря заходит нереститься типичная trachurus. Примечательно, что несмотря на нерест в одних и тех же местах, гибридов (semiarmatus) вообще обнаружено не было. Кроме боковых пластин обе формы отличаются по окраске, числу жаберных тычинок и другими пластическими признаками (Зюганов и др., 1987; Зюганов, 1988; Зюганов, Бугаев, 1988).
Таким образом, имеется 6 документированных ситуаций, когда формы ведут себя как «хорошие виды», т. е. генетически изолированы и не обмениваются генами, причем две из них — это пары trachurus—leiurus, а три — различные формы внутри морфы leiurus (рис. 34).
В Европе (Бельгия) был зарегистрирован только один случай частичной репродуктивной изоляции между trachurus и leiurus. Хойтс (Heuts, 1946, 1947b) показал, что leiurus занимает верхние участки рек, а морская trachurus приходит на размножение из моря и нерестится в эстуариях и нижних течениях рек. Зоны перекрывания между ними очень узкие, и гибриды редки, так что поток генов между двумя формами весьма ограничен. Хойтс (Heuts, 1946, 1947b) на основании экспериментов полагает, что различие в температурных и соленостных оптимумах развития икры между двумя формами является одним из факторов, ограничивающих поток генов между trachurus и leiurus. Обе формы различаются по числу позвонков, длине тела и другим признакам. Тем не менее Хойтс (Heuts, 1947b) не называет эти формы видами.
Вместе с тем во всех остальных изученных случаях в Европе обнаруживается широкая интрогрессия между trachurus и leiurus с образованием значительной доли semiarmatus (промежуточного фенотипа). Такие ситуации выявлены в бассейне Северного и Балтийского морей (Münzing, 1959, 1962, 1963, 1972; Penczak, 1965, 1966; Erkinaro-Eino, 1976; Gross, 1977; Paepke, 1982, и др.), Баренцева моря (Берг, 1949), Белого моря (Зюганов, 1978, 1980, 1983а), т. е. везде там, где встречаются обе формы — trachurus и leiurus. Судя по данным японских авторов, такая же широкая интрогрессия между двумя формами происходит в Японии, где также встречаются trachurus, leiurus и semiarmatus (Kobayashi, 1932; Ikeda, 1933, 1934; Igarashi, 1964, 1965, 1970, и др.).
Что касается Сев. Америки, то морфа leiurus встречается там преимущественно на западном побережье, на восточном отмечены всего лишь 4 находки leiurus (Bell, 1984). Там и в пресных водах доминирует морфа trachurus. Однако на Тихоокеанском побережье отмечено достаточно много случаев триморфизма в пресноводных популяциях, по крайней мере часть из которых можно трактовать как результат широкой интрогрессии между морской trachurus и пресноводной leiurus. Так, Нарвер (Narver, 1969) исследовал Gasterosteus aculeatus в озерах Чигник и Блэк на Аляске (США). Озеро Блэк, более удаленное от моря, соединяется рекой с оз. Чигник, из которого река впадает в море. Обе озерные популяции триморфны (t+s+l), причем trachurus подразделяется на два фенотипа: эстуарный и озерный. Первый имеет более широкие пластины и развитый киль. В оз. Блэк частота leiurus и semiarmatus больше, a trachurus меньше, чем в оз. Чигник. Эстуарные фенотипы (т. е. проходная trachurus) встречаются в оз. Чигник, но крайне редки в оз. Блэк. В эстуарии встречается только trachurus. Нарвер (Narver, 1969) полагает, что «эстуарный фенотип оказывает генетическое влияние на обе озерные популяции. Миллер и Хаббс (Miller, Hubbs, 1969) на основании исследования большого коллекционного материала обосновали возможность широкой интрогрессии между различными популяциями trachurus, leiurus и hologymna на западном побережье США. Множество полиморфных пресноводных популяций западного побережья США (от Аляски до Южной Калифорнии) описано Хагеном и Гильбертсоном (Hagen, Gilbertson, 1972), Беллом (Bell, 1976а, 1982, 1984), Эвайсом (Avise, 1976) и другими авторами.
Таким образом, начиная с 50-х гг. нашего века широкие популяционные исследования в природе при тщательном изучении изолирующих механизмов с привлечением экспериментальных методик выявили целый ряд сильно дивергировавших популяций (алло-, пара- и симпатричных) пресноводных колюшек (в основном в бассейне Тихого океана). Была установлена та или иная степень развития механизмов репродуктивной изоляции между разными формами — от отсутствия таковых до полной репродуктивной изоляции. Возникает такое положение, которое Майр (1974) образно назвал «кошмар для систематика — радость для эволюциониста». Вуттон (Wootton, 1976, с. 256) подчеркивал, что поскольку в таксоне Gasterosteus aculeatus идут, с одной стороны, процессы видообразования, а с другой — процессы реинтеграции в единый, морфологически менее вариабельный вид, то этот динамизм должен предостерегать систематиков от «применения строгих правил». В то же время Вуттон вряд ли прав, считая, что «только широкие эксперименты по скрещиваниям и морфологическое, анатомическое, биохимическое, физиологическое и поведенческое исследования дадут твердый базис для классификации трехиглой колюшки». Дело в том, что этот таксон уже достаточно хорошо изучен с применением подходов, указанных Вуттоном, и уже сейчас ясна невероятная сложность структуры этого таксона, и дальнейшие исследования несомненно только вскроют еще большую сложность и в смысле классификации не дадут ничего нового.
На мой взгляд, применение биологической концепции вида «виды — это группы действительно или потенциально скрещивающихся естественных популяций, репродуктйвно изолированные от других таких групп» (Майр, 1974) к таксону Gasterosteus aculeatus приводит к неизбежному заключению, что он не является биологическим видом, поскольку в этом таксоне обнаруживается множество популяций, скрещивания между которыми предотвращены той или иной степенью репродуктивной изоляции. Поэтому позиция объединителя в этом случае будет уязвима. С другой стороны, если мы попытаемся «раздробить» таксон на несколько видов меньшего объема: например, Gasterosteus trachurus, Gasterosteus leiurus, Gasterosteus hologymna и т. п., мы рискуем поднимать до видового ранга почти каждую изолированную популяцию, поскольку у Gasterosteus aculeatus весьма высока морфологическая и этологическая изменчивость. К тому же непременно столкнемся с тем, что ряд этих «видов» будет связан в областях контакта зонами интеградации. Поэтому позиция дробителя здесь также уязвима, как и объединителя. Не случайно большинство современных исследователей-популяционистов, описавших сильно дивергировавшие популяции трехиглой колюшки и установивших наличие репродуктивной изоляции, в ряде мест отказалось от возведения, в соответствии с правилами зоологической номенклатуры, этих популяций в ранг видов (McPhail, 1969; Moodie 1972а, 1972b; Larson, 1976; McPhail, 1984; Ridgway, McPhail, 1984). Единственным исключением явилась работа Хагена (Hagen, 1967), в которой автор предложил выделить морскую форму trachurus в самостоятельный вид Gasterosteus trachurus, а пресноводную форму именовать другим видом Gasterosteus aculeatus. Его в этом начинании никто не поддержал, и вскоре он сам отказался от такой классификации (Hagen, McPhail, 1970), признав, что «в одних местах они могут вести себя как виды, а в других как подвиды».
В этой же работе Хаген и Мак-Фейл (Hagen, McPhail, 1970) подвергли критике концепцию Миллера и Хаббса (Miller, Hubbs, 1969) считавших, что все морфологическое разнообразие Gasterosteus aculeatus на Тихоокеанском побережье Сев. Америки происходит от вторичной интерградации трех ранее разделенных подвидов Gasterosteus aculeatus aculeatus (trachurus), Gasterosteus aculeatus microcephalus (leiurus) и Gasterosteus aculeatus williamsoni (hologymna). Полемизируя с Миллером и Хаббсом (Miller, Hubbs, 1969), Хаген и Гильбертсон (Hagen, Gilbertson, 1972) приводят доказательства того, что обмен генами между анадромной trachurus и пресноводной leiurus не является главной причиной полиморфизма, поскольку ими найдены 4 изолированные и полиморфные (t+s+l) популяции колюшки, обитающие в озерах, расположенных в глубине материка и образовавшихся около 10 тыс. лет назад (озера Шелан, Бапато и др.). Авторы заключают, что эти морфы произошли в результате отбора и именуют ситуацию «сбалансированным полиморфизмом».
Белл (Bell, 1976а) показал, что подвиды Gasterosteus aculeatus williamsoni и Gasterosteus aculeatus microcephalus, выделенные Миллером и Хиббсом (Miller, Hubbs, 1969), на самом деле являются сборными таксонами и многие калифорнийские популяции leiurus и hologymna произошли от морской trachurus независимо друг от друга.
Белл (Bell, 1976а) обосновал точку зрения, в соответствии с которой комплекс форм в пределах Gasterosteus aculeatus является надвидом. Он установил, что фенотипическая дифференциация Gasterosteus aculeatus произошла уже в позднем миоцене, по крайней мере 10 млн. лет назад: все отпечатки leiurus, hologymna обнаружены в пресноводных отложениях, a trachurus — в морских. Судя по морфологии, trachurus существенно не изменилась за этот длительный срок. Белл предложил следующую модель становления надвида. Морская форма trachurus — это основная стволовая линия, от которой отщепились в разных местах и в разное время на протяжении 10 млн. лет пресноводные изоляты leiurus. Trachurus не изменилась с миоцена из-за стабильных условий в море; южная граница ее ареала определяется сочетанием высокой солености и высокой температуры воды. В плейстоцене, во время ледниковых периодов ее ареал пульсировал около 20 раз. Этим создавались хорошие возможности для изоляции отщепившихся пресноводных ручьевых популяций, а вторичный контакт с морской trachurus закреплял биологическую изоляцию. Таким образом, видообразование у колюшек аллопатрическое, механизм — локальный отбор в пресных водоемах, где условия более разнообразны, чем в море. Давление и направления отбора разные в разных географических изолятах. К настоящему времени, по мнению Белла (Bell, 1976а), часть этих изолятов — уже виды; часть — полувиды, находящиеся на пути к скорому завершению становления изолирующих механизмов. Морская trachurus является по существу и предковым, и сестринским видом по отношению к группе пресноводных видов и полувидов leiurus и hologymna (Bell, 1979а).
Для более полного понимания эволюции Gasterosteus aculeatus до последнего времени не хватало ответов на следующие важные вопросы: 1) каковы пусковые механизмы становления морфы leiurus в пресных водоемах и с какой скоростью идет образование этой морфы от морских рыб-основателей? 2) могут ли пресноводные популяции снова стать анадромными? (Bell, 1976а). Понятно, что ответить на эти вопросы было трудно, поскольку во всех случаях исследователи имели дело уже с результатами процесса микроэволюции. Для ответа на них стоило попытаться путем эксперимента в природных условиях воспроизвести вселение морских рыб в пресный водоем, где ранее не было колюшек, следить за такой навообразованной популяцией, а затем имитировать ее возврат в морские условия. Понятно, что в большинстве случаев сделать это технически трудно. Трудно было также предсказать, сколько потребуется времени, для того чтобы произошли интересующие нас события.
Нам удалось провести такие эксперименты в водоемах бассейна Белого моря (Зюганов, 1980, 1982, 1983а). Эти эксперименты описаны выше в разделах 2.7 и 4.5.4. Они показали, что пусковым механизмом образования морфы leiurus является изоляция небольшой группы основателей морских trachurus в пресноводном водоеме. Уже в первых нескольких поколениях происходит расщепление гетерозиготных trachurus на три морфы. Эксперименты также показали, что становление leiurus является необратимым процессом и эта морфа не может снова стать анадромной морской и при осолонении водоема вымрет. Физиологическим механизмом этого является открытое Гутсом (Guts, 1970) явление пассивной осморегуляции leiurus, не эффективной в морской воде при низких температурах, а также обнаруженный нами (Зюганов, Хлебович, 1979) эффект отсутствия активации спермиев leiurus в морской воде. Таким образом, в море невозможно существование самовоспроизводящейся группировки особей leiurus. Надвидовая концепция Белла (Bell, 1976а) «Gasterosteus aculeatus superspecies» не полностью описывает эволюционно-таксономическую ситуацию у Gasterosteus aculeatus, поскольку в ряде случаев trachurus и leiurus, достигшие видового и полувидового ранга, сосуществуют парапатрично и симпатрично (Hagen, 1967; McPhail, 1969; Hagen, McPhail, 1970; Moodie, 1972a, 1972b; Зюганов и др., 1987). Это противоречит определению надвида (надвид — монофилетическая группа близкородственных и в значительной мере или полностью аллопатрических видов, — Майр, 1971).
Грант (1980, с. 177) отмечал, что для обозначения популяционных систем, промежуточных между расами и видами в отношении скрещивания друг с другом, интерградации и репродуктивной изоляции, используют термин «полувид». Совокупность аллопатрических полувидов называют надвидом (Майр, 1971; Грант, 1980). Грант (1980) предлагает совокупность симпатрических или маргинально симпатрических (погранично-симпатрических, — В. З.) полувидов называть сингамеон. Сингамеон, по его мнению, более всеобъемлющая популяционная система, чем биологический вид. В применении к таксону Gasterosteus aculeatus концепция «сингамеон» также не полностью описывает ситуацию из-за существования популяций leiurus, аллопатричных по отношению друг к другу, но явно достигших полувидового или видового ранга (например, популяции оз. Майер, — Moodie, 1972а, 1972b; оз. Пакстон, — Larson, 1976; оз. Энос, Ridgway, McPhail, 1984, и др.). Описания таких популяций даны в обзоре Белла (Bell, 1984). Таким образом, таксону Gasterosteus aculeatus присущи черты и надвида, и сингамеона.
Недавно Степанян (1983) выдвинул новую концепцию для описания сложных эволюционно-таксономических ситуаций, которую он назвал «экс-конспециес» (былой единый вид). Экс-конспециес — монофилетическая группа таксонов, которым придается видовой ранг, хотя они связаны зонами вторичной гибридизации и поэтому могут считаться занимающими пограничное положение между видом и подвидом. К сожалению, и эта концепция описывает рассматриваемую ситуацию не полно, так как имеются примеры существования trachurus и leiurus в качестве внутрипопуляционных группировок (Avise, 1976; Зюганов, 1978, 1980, 1983а, 19836).
Таким образом, ни одна из существующих эволюционно-таксономических концепций (биологический вид, надвид, сингамеон, былой единый вид) не в состоянии описать ситуацию в таксоне Gasterosteus aculeatus. В роде Gasterosteus действительно существуют не биологические виды (за исключением Gasterosteus wheatlandi), а только популяции, находящиеся на разных стадиях генотипической и фенотипической изоляции. Принимая во внимание значительный возраст этого таксона (не менее 10 млн. лет), не похоже, что данная структура его сформировалась из-за незавершенности видообразования. За такое длительное время видообразование могло завершиться неоднократно. На мой взгляд, большинство изученных форм в этом таксоне не является зарождающимися видами in statu nascendi. Напротив, начавшаяся генетическая дивергенция фиксировалась на разных стадиях в разных частях ареала и дальше не пошла. Важно подчеркнуть, что эти формы «не стремятся» к завершению видообразования. Здесь мы наблюдаем не видообразование как динамический процесс, а квазистационарное состояние приостановившейся дивергенции, способной в ряде случаев к реверсии (Зюганов, 1988, 1989).
Такая структура характерна не только для Gasterosteus и Pungitius (см. след. раздел), но и для многих других групп рыб Coregonus, Salvelinus, Brachymystax, населяющих водоемы высоких широт с нестабильными условиями среды (Мина, Васильева, 1979; Решетников, 1980; Савваитова, 1982). Такая популяционная структура обеспечивает им большую стабильность. Пока остается открытым вопрос, на каких основах должна строиться классификация групп с такой структурой. В своей работе «Проблема вида у Gasterosteus aculeatus на Тихоокеанском побережье Северной Америки» Хаген и Мак-Фейл (1970, с. 154) ставили вопрос: «Одно и то же Gasterosteus aculeatus в Европе и Америке?». Мне кажется, на этот вопрос можно дать следующий ответ: «Да, морская trachurus и в Европе, и в Америке, и в Восточной Азии одно и то же». На удивительное однообразие и стандартность фенотипа trachurus у морских колюшек из разных морей обращал внимание еще Берг (1949). Действительно, по данным всех авторов, изучавших фенотипическую изменчивость trachurus, число пластин у этой формы колеблется от 30 до 35 (Ikeda, 1934; Heuts, 1947b; Münzing, 1963; Igarashi, 1970; Hagen, 1967; Miller, Hubbs, 1969; Igarashi, 1970; Hagen, Gilbertson, 1972; Coad, Power, 1973a; Bell, 1982; Paepke, 1982), всегда есть киль, всегда есть 3 колючки, pelvis, тело стандартной веретенообразной формы, относительно много жаберных тычинок. Судя по палеонтологическим данным (Bell, 1977), морская trachurus морфологически почти не изменилась с позднего миоцена. В любом море экологическая ниша у trachurus всегда одна и та же — планктофаг (отсюда большое число жаберных тычинок), пелагический образ жизни детерминирует веретенообразную форму тела.
Таким образом, морские условия поддерживают жесткий стабилизирующий отбор, действующий на морскую форму.
Иначе обстоит дело с пресноводной формой. Ясно, что генофонды популяций leiurus в разных географических точках далеко не идентичны, однако в каждой такой популяции зафиксированы аллели, определяющие число боковых пластин, характерное для leiurus. По существу leiurus из разных местообитаний и из разных районов объединяет только один признак — «уменьшенное число боковых пластин». Но этот признак — «признак-редукция», «признак-утрата». Майр (1971, с. 255) совершенно справедливо подчеркивал, что признаки-утраты имеют малый таксономический вес, поскольку утраты могут произойти независимо в филетических линиях, связанных более или менее отдаленным родством. Таксоны, основанные на утрате глаз, жилок крыла, пальцев, сегментов и т. д., нередко оказываются неестественными. По существу у leiurus из разных районов происходят независимо утраты не только боковых пластин, но и колючек спинных, брюшных, тазового пояса, красной брачной окраски, солеустойчивости и т. п. В то же время у leiurus варьируют форма тела, число жаберных тычинок, окраска, размеры тела и многие другие, признаки. Таким образом, leiurus из Америки и leiurus из Европы — не одно и то же.
В настоящее время трехиглую колюшку обозначают как таксон Gasterosteus aculeatus species-complex (Wootton, 1976; Nelson, 1977; Bell, 1984), с чем я согласен, поскольку ни объединение в один вид (Gasterosteus aculeatus), ни раздробление на ряд самостоятельных видов не соответствовало бы действительности.
Таким образом, я принимаю следующую классификацию рода Gasterosteus: этот род состоит из вида Gasterosteus wheatlandi и таксона Gasterosteus aculeatus species-complex (без подвидов).
Иллюстрированная энциклопедия рыб. Ст.Франк 1983 г.
К отряду относится семейство колюшковые (Gasterosteidae), включающее 5 родов. Три рода чисто морские, роды Gasterosteus и Pungitius - пресноводные, хотя первые два года их представители и живут в морской или солоноватой воде.
Словарь названий пресноводных рыб СССР. Г.У.Линдберг и А.С.Герд 1972 г.
20.1.0. Gasterosteus Linne, 1758 — Трехиглые колюшки.
Жизнь животных. Том 4. Рыбы Под редакцией профессора Т.С.Расса 1971 г.
Трехиглые колюшки (Gasterosteus)
распространены в Европе, Северной Африке
(Алжир), Северной Азии и Северной
Америке. В пределах СССР обитает один
вид — трехиглая колюшка (Gasterosteus
aculeatus).
Тело у трехиглых колюшек
сравнительно высокое, сжатое с боков, с коротким
хвостовым стеблем. Вместо чешуи бока
тела покрыты костными пластинками,
как панцирем. Голова заостренная. Рот
конечный, умеренной величины.
Жаберные перепонки приращены к
межжаберному промежутку, не образуя складки
поперек него. Перед спинным плавником
три больших шипа. Брюшные плавники
превращены в шипы. Спинные и брюшные
шипы в поднятом положении замыкаются
особой защелкой и представляют собой
грозное оружие. Трехиглые колюшки
живут в море и в пресных водах; живущие
в море обычно крупнее пресноводных,
сильнее вооружены, боковые кили на
хвостовом стебле хорошо развиты,
костные пластинки на боках тела образуют
полный ряд; у пресноводных форм эти
пластинки имеются только возле головы
и на хвостовом стебле.
У американского побережья
Атлантического океана, в море от Ньюфаундленда
до мыса Код, преимущественно в
солоноватых водах, встречается двуиглая колюшка
(Gasterosteus wheatlandi), которая
достигает длины 10 см.
Рыбы Японского моря и сопредельных частей Охотского и Желтого морей. Часть 2. (Acipenseriformes — Polynemiformes). Г.У.Линдберг, М.И.Легеза 1965 г.
1. Род GASTEROSTEUS LINNE, 1758
Gasterosteus Linne, Syst. Nat., ed. X, 1758 : 295 (тип: Gasterosteus aculeatus L.). — Берг, Рыбы пресных вод, 3, 1949 : 971 (описание, синонимия). — Matsubara, Fish Morphol. a. Hierar., 1955 : 407.
Перед спинным плавником 3 (редко 4, как исключение 2 или 5) колючек. Тело обычно покрыто костяными пластинками, иногда совсем отсутствующими. Хвостовой стебелек с килем, иногда слабо выраженным. Жаберные перепонки приращены к межжаберному промежутку. В остальном как Pungitius. Позвонков 27—33. (Берг, 1949 : 972).
2 вида, в водах Японского моря 1 вид (Gasterosteus aculeatus Linne, 1758).
Рыбы северных морей СССР. А.П.Андрияшев 1954 г.
3. Род GASTEROSTEUS LINNE
Gasterosteus Linne, Syst. Nat., ed. X, 1758 : 295 (тип: Gasterosteus aculeatus L.). — Берг, Рыбы пресн. вод СССР, III, 1949 : 971.
Тело сравнительно высокое, сжатое с боков, с коротким хвостовым стеблем. Рыло короткое. Перед спинным плавником обычно 3 колючки (реже 4, как исключение 2 или 5). Тазовые кости срощены в непарную брюшную пластинку. Жаберные перепонки узко приращены к межжаберному промежутку, не образуя складки поперек него. Позвонков 27—33.
2 вида с многими формами в Европе, сев. Африке (Алжире), сев. Азии и Сев. Америке, как в пресных водах, так и в морских. В пределах СССР один вид: Gasterosteus aculeatus Linne — Трехиглая колюшка.
Рыбы пресных вод СССР и сопредельных стран. Л.С.Берг 1948 г.
2. Род GASTEROSTEUS LINNE
Gasterosteus Linne, Syst. nat., ed. X, 1758, p. 295 (тип: Gasterosteus aculeatus).
Gasteracanthus Pallas, Zoogr. rosso-asiat., III, 1811, p. 288 (тип: Gasteracanthus aculeatus, излишняя перемена названия).
Gasterosteus Swainson, Nat. Hist., II, 1839, p. 242 (тип: Gasterosteus trachurus = aculeatus).
Leiurus Swainson, 1. с. (тип: Gasterosteus aculeatus).
Gladiunculus Jordan and Evermann, Proc. Calif. Acad. Sci. (4), XVI, 1927, p. 504 (тип: Gasterosteus gladiunculus Kendall 1896 = Gasterosteus bispinosus Jordan and Evermann, 1927, non Walbaum 1792 = Gasterosteus wheatlandi Putnam 1867, Massachusets).
Перед спинным плавником 3 (редко 4, как исключение, 2 или 5) колючек. Тело обычно покрыто костяными пластинками, иногда совсем отсутствующими. Хвостовой стебелек с килем, иногда слабо выраженным. Жаберные перепонки приращены к межжаберному промежутку. Длина до 10 см. В остальном — как Pungitius. Позвонков 27—33.
2 вида (Обзоры см.: С. Tate Regan, The species of three-spined sticklebacks. Ann. Mag. Nat. Hist. (8), IV, 1909, p. 435—437. — Вertin, 1. c., p. 153, — C. Hubbs, Occas. papers. Mus. of Zoology Univ. Michigan, № 200, 1929, p. 1—9 (o Gasterosteus wheatlandi).):
1) Gasterosteus aculeatus в Европе, Алжире, сев. Азии и Сев. Америке. На юге в Европе (Италия) и в Алжире (Gasterosteus algeriensis Sauvage 1874 = Gasterosteus hologymnus Regan 1909, Тибр) образует голые или почти голые формы, которые можно рассматривать как подвид Gasterosteus aculeatus algeriensis. Подобная же форма из пресных вод Калифорнии описана как Gasterosteus williamsoni Girard 1854 (= Gasterosteus santae-annae Regan 1909).
2) Gasterosteus wheatlandi Putnam 1867, от Ньюфаундленда до Массачузетса: брюшная колючка с заметным бугорком при основании, V I (1) 2, хвостовой стебель без киля; в пресную воду не входит (см. Hubbs, 1. с.).
Bertin (1925) признает все (свыше сорока) описанные виды рода Gasterosteus за один, различая в нем 15 форм («formes»), собственно — морф, не приуроченных к географическим районам:
1) по степени вооружения боков пластинками: пластинки покрывают тело сплошь и идут до хвостового плавника (trachura), пластинок мало, только спереди и на хвосте (semiarmata), тоже, но хвост голый (gymnura), пластинок совсем нет (hologymna);
2) по количеству колючек в D: с 3 (teraculeata), 4 (tetracantha), 2 (biarmata);
3) по длине колючек в D: с короткими колючками (brachycentra), с длинными (dolichocentra);
4) по длине колючек в V: с короткими (brachypoda), с длинными (dolichopoda);
5) по зазубренности колючек: гладкие (leiocentra) и зазубренные (trachycentra);
6) по форме тела: высокие (brepis) и удлиненные (gracilis).











