Gasterosteus aculeatus aculeatus Linnaeus, 1758
Трехиглая колюшка, колючка, баренцовоморская колюшка, беломорская ходовая колюшка, беломорская морская колюшка, тихоокеанская колюшка (Rus),
Three-spined stickleback, Tittlebat
(Eng)
Синонимы:
Gasteracanthus cataphractus Pallas, 1814
Gasterosteus aculeatus Linnaeus, 1758
Gasterosteus aculeatus messinicus Stephanidis, 1971
Gasterosteus algeriensis Sauvage, 1874
Gasterosteus argentatissimus Blanchard, 1866
Gasterosteus argyropomus Cuvier, 1829
Gasterosteus atkinsii Bean, 1879
Gasterosteus bailloni Blanchard, 1866
Gasterosteus biaculeatus Mitchill, 1815
Gasterosteus biarmatus Krynicki, 1840
Gasterosteus bispinosus Walbaum, 1792
Gasterosteus brachycentrus Cuvier, 1829
Gasterosteus cuvieri Girard, 1850
Gasterosteus dimidiatus Reinhardt, 1837
Gasterosteus elegans Blanchard, 1866
Gasterosteus hologymnus Regan, 1909
Gasterosteus inopinatus Girard, 1854
Gasterosteus insculptus Richardson, 1855
Gasterosteus intermedius Girard, 1856
Gasterosteus leiurus Cuvier, 1829
Gasterosteus loricatus Reinhardt, 1837
Gasterosteus nemausensis Crespon, 1844
Gasterosteus neoboracensis DeKay, 1842
Gasterosteus neustrianus Blanchard, 1866
Gasterosteus niger Cuvier, 1829
Gasterosteus noveboracensis Cuvier, 1829
Gasterosteus obolarius Cuvier, 1829
Gasterosteus plebeius Girard, 1854
Gasterosteus ponticus Nordmann, 1840
Gasterosteus pugetti Girard, 1856
Gasterosteus quadrispinosa Crespon, 1844
Gasterosteus semiarmatus Cuvier, 1829
Gasterosteus semiloricatus Cuvier, 1829
Gasterosteus serratus Ayres, 1855
Gasterosteus spinulosus Yarrell, 1835
Gasterosteus suppositus Sauvage, 1874
Gasterosteus teraculeatus Lacepède, 1801
Gasterosteus tetracanthus Cuvier, 1829
Gasterosteus texanus Sauvage, 1874
Gasterosteus trachurus Cuvier, 1829
Gastrosteus hologymnus Regan, 1909
Атлас аквариумных рыб. В.Каль, Б.Каль, Д.Фогт 2001 г.
Колюшка трехиглая (Gasterosteus aculeatus).
Строит гнездо из фрагментов растений в какой-нибудь пологой ямке, в котором самка нерестится. Самец с яркой окраской в период нереста занимает территорию, которую охраняет и яростно защищает кладку и проклюнувшееся потомство. Держат самца и нескольких самок. Аквариум от 80 см длиной, укрытия, хорошая аэрация, регулярная подмена воды.
Длина: около 10 см. Вода: температура 8-18°С (в комнатных аквариумах часто слишком тепло); рН 6-8; жесткость до 10° dH. Корм: только живой; мелкие рачки, черви, личинки комара. Ареал: Европа.
Рыбы открытого океана. Н.В.Парин 1998 г.
Большинство ксеноэпипелагических видов нормально обитают в неритической зоне, но, попав за ее пределы, они способны долго существовать (по-видимому, не размножаясь) и в практически неограниченном удалении от берегов. В северной части Тихого океана, в Баренцевом и Черном морях на большом расстоянии от берега можно наблюдать трехиглую колюшку, или колючку (Gasterosteus aculeatus), — обычного обитателя наших рек, озер и прибрежных морских вод. Как показал Б. И. Федоряко, эти и некоторые другие рыбы, будучи вынесенными в открытые воды еще на мальковой стадии, прекрасно чувствуют себя и вдали от берегов, там, где преобладающее большинство прибрежных рыб гибнет очень быстро. Способность к долгому выживанию в эпипелагиали, несомненно, содействует широкому расселению ксеноэпипелагических видов, для которых не существует барьеров в виде открытоводных пространств любого протяжения. Многие из них имеют поэтому циркумглобальные ареалы.
Атлас-определитель рыб: Книга для учащихся. Н.А.Мягков 1994 г.
Колюшка трехиглая — Gasterosteus aculeatus (Linnaeus, 1758)
Тело сильно сжатое с боков, которые покрыты крупными костными пластинками. Они образуют на хвостовом стебле мощный киль. Перед спинным плавником несколько свободных колючек, которые в момент опасности расправляются и «запираются» костной защелкой (играют защитную роль). D1 III—IV. D2 9—14. А I 7—11. Окраска тела зеленовато-желтая на спине и серебристая на боках. В период нереста брюшко самца становится малиновым, а спина зеленовато-синей. Строит «гнездо» из водной растительности. Длина тела до 9 см. Обычный вид в пресных и солоноватых водах бассейнов европейских морей. Отмечен в бассейне Амура, на Камчатке и в некоторых водоемах Сибири. Так, на востоке Чукотки, в Гильнимливсемских термоминеральных источниках (бассейн Мечигменской губы) обитает уникальная местная популяция, крайне малочисленная (!) и требующая тщательной охраны.
Декоративное рыбоводство. А.М.Кочетов 1991 г.
Трехиглая колюшка — Gasterosteus aculeatus Linnaeus, 1758. Родина — водоемы Европы, Северной Азии и Северной Африки; размер 4—11 см (морские формы крупнее). На спине три колючки. Окраска зеленовато-бурая (морские формы сине-черные). В период нереста грудь и брюхо у самцов красные, глаза синие. Самки с вертикальной штриховкой, низ тела у них желтоватый. Плодовитость до 500 икринок. Инкубационный период длится 1—2 недели. Корм — микропланктон. Малек серебристый, держится стаей. Гнездо рыбы строят на дне.
Фауна СССР. Рыбы. Том V, вып. 1. Семейство Колюшковых (Gasterosteidae) мировой фауны. В.В.Зюганов 1991 г.
1. Gasterosteus aculeatus Linne, 1758, sp. complex — Трехиглая колюшка (рис. 40).
— Gasterosteus aculeatus Linne, 1758 : 295 (Европа).
— Gasteracanthus aculeatus Pallas, 1811 : 229 (Черное море, побережье Северного Ледовитого океана).
— Gasteracanthus cataphractus Pallas, 1811 : 230 (Камчатка).
— Gasterosteus trachurus Cuvier, 1829 : 170 (Франция).
— Gasterosteus ponticus Nordmann, 1840 : 380 (Черное море).
— Gasterosteus biarmatus Krynicki in Nordmann 1840 : 381 (Крым: Тарханкут).
— Gasterosteus brachycentrus Heckel et Kner, 1858 : 41, fig. 17 .(Сев. Италия).
— Gasterosteus gymnurus Fatio, 1882 : 71 (Рейн у Базеля).
— Gasterosteus cataphractus: Jordan, Evermann, 1896 : 749 (от Сан-Франциско до Аляски и Камчатки); Т. et В. Bean, 1896 : 250 (о. Беринга).
— Gasterosteus aculeatus Bertin, 1925 : 153 (полная синонимика); Берг, 1949 : 972—976 (синонимы, описание, распространение); Wootton, 1976 : 487 (морфология, анатомия, биология, распространение, эволюция); Bell, 1984 : 431—528 (генетика, палеонтология, распространение, эволюция).

D III (Как исключение 0, I, II, IV, V.) (9) 10—14, А I (7) 8—10 (11), V I 1 (В некоторых популяциях Сев. Америки и Шотландии 0.), Р 10—11, С 12, позвонков 29—33 (туловищных 14—15, хвостовых 18—19).
На спине перед спинным плавником расположены обычно 3 колючки, первые 2 из них длиннее последней. Первая колючка расположена над основанием грудного плавника и впереди брюшной колючки.
Брюшная колючка без бугорка при основании. Посттемпорале и супраклейтрум присутствуют. Костных боковых пластин на боках тела 0—35. Рыло короче заглазничного отдела головы. Брачная окраска самца — красное брюхо, голубые глаза. Длина тела до 10—13 см. Вне нерестового сезона тело серебристо-белое, верх головы и спины синий.
Изменчивость. Подвержен многочисленным вариациям в отношении развития боковых пластин, киля, количества спинных колючек, их высоты, расположения; количества, длины и зазубренности брюшных колючек, структуры тазового пояса; количества позвонков и жаберных тычинок, окраски, длины и формы тела. Изменчивость морских популяций Gasterosteus aculeatus менее выражена, чем пресноводных. Морские колюшки отличаются более сильным развитием боковых пластин и киля (морфа trachurus), у них всегда имеются крепкие и длинные спинные и брюшные колючки, тазовый пояс. Жаберных тычинок у морской формы относительно больше, чем у пресноводной, сами жаберные тычинки длиннее. Тело веретенообразное, сжатое с боков. Все эти особенности морской формы отражают обитание в морских условиях, пелагический мигрирующий образ жизни, питание зоопланктоном. Пресноводные популяции более разнообразны, чем морские, по всем признакам, и обусловлено это разными направлениями отбора в разнообразных пресноводных местообитаниях: горных озерах, ручьях, прудах, болотах и т. п. В целом пресноводные колюшки мельче морских (хотя встречаются и исключения), пресноводные популяции могут быть мономорфные (leiurus или trachurus), диморфные (leiurus + trachurus или leiurus + semiarmatus), триморфные (leiurus + trachurus + semiarmatus), хотя чаще всего в пресноводных изолированных водоемах они представлены морфой leiurus. Спинные и брюшные колючки у пресноводных колюшек, как правило, более слабо развиты, чем у морских (хотя есть исключения). Форма тела варьирует в зависимости от местообитания и образа жизни (озерный, ручьевой и т. п.), хотя большинство пресноводных колюшек скорее бентофаги, чем планктофаги, и имеют менее прогонистое тело и меньше жаберных тычинок, чем морская форма. В южных участках ареала частота морфы leiurus увеличивается, но это не абсолютное правило, так как известны мономорфные популяции leiurus и с севера (Аляска, Камчатка, Кольский п-ов, Карелия, Гренландия). Известно много высокодивергентных пресноводных популяций leiurus (с черной брачной окраской самцов, без спинных колючек, тазового пояса и т.. п.). В ряде случаев выявлено существование репродуктивной изоляции между разцыми формами в природных условиях, так что, строго говоря, Gasterosteus aculeatus не является единым таксономическим видом, это, скорее, комплекс видов и форм. Поскольку одни и те же формы (фенотипические варианты) в разных частях ареала ведут себя или как виды, или как внутривидовые вариации, этот таксон целесообразно называть Gasterosteus aculeatus species complex.
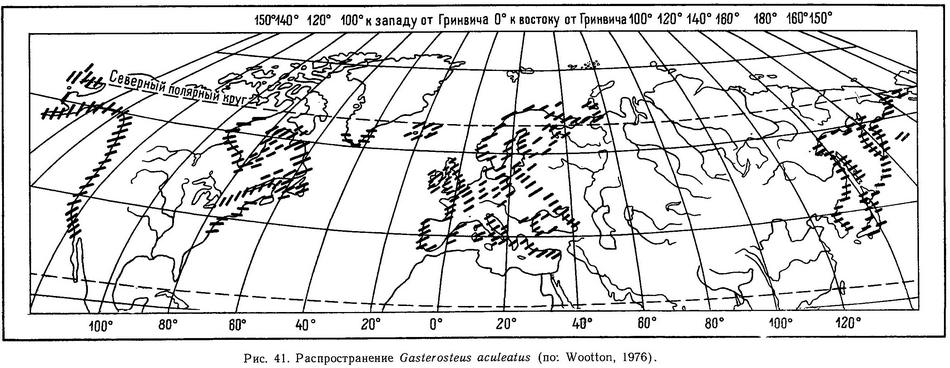
Распространение (рис. 41). Северная часть Атлантического и Тихого океанов: в Европе от Новой Земли, Белого моря, Кольского п-ова и Исландии до Средиземного и Черного морей; Балтийское море; в Америке от Гренландии до Нью-Йорка; в Тихом океане от Берингова пролива до Фусана (Корея) и Японии (о. Киушу), Курильские острова, по Американскому побережью от Аляски до Южной Калифорнии (р. Эль-Розарио на границе с Мексикой) . В реках Сибири от Печоры до Чукотки и в бассейнах Каспийского и Аральского морей отсутствует.
Образ жизни. Имеет три типа жизненного цикла. Морской тип: рыбы проводят весь жизненный цикл и размножаются в море в прибрежных участках на мелководье при солености до 20—25 ‰, например в Кандалакшском заливе Белого моря — наблюдения автора, на Тихоокеанском побережье Сев. Америки (Bell, 1984). Проходной (анадромный) тип: рыбы живут в море, но размножаются в весенне-летний период в пресных водах — ручьях, реках, озерах и т. п. После нереста взрослые особи гибнут или уходят обратно в море. Молодь (сеголетки) также скатывается в море. Пресноводный (жилой) тип: рыбы живут и размножаются в пресных водах, не выходя в море (за немногими исключениями, описанными для Калифорнии Беллом — Bell, 1979b, и для Италии Раунишем с соавт. — Raunich et al., 1972), даже если пресноводный водоем не изолирован от моря. Показано, что проходной и морской типы жизненного цикла взаимопереходящи, между морскими и проходными колюшками нет генетических различий (Зюганов, 1980). Очевидно, в морских прибрежных участках нерестятся особи проходной формы, которым не хватило места на пресноводных нерестилищах. Вместе с тем генетические различия между проходной и жилой формами доказаны (Heuts, 1947а; Münzing, 1959; Hagen, 1967; Зюганов, Хлебович, 1979).
Gasterosteus aculeatus живет 1—5 лет, в среднем 2—3 года. В некоторых популяциях наблюдается массовая гибель после первого нереста. Нерест в апреле-августе в зависимости от географической широты водоема, температурного и светового режимов. В Южной Калифорнии размножающиеся особи встречаются круглый год (Bell, 1984). Нерест порционный — до 10 актов размножения в сезон. Самец строит гнездо из растительных остатков, в которое самка откладывает икру, охраняемую затем самцом во время всего развития икры, и в течение 5—7 дней после выклева молоди самец охраняет личинок. Гнездо строится на дне. Спектр питания широк: зоопланктон, фитопланктон, бентос. Отличается прожорливостью — охотится на любые движущиеся объекты мелких размеров: личинок насекомых, червей, ракообразных. Морская форма зимует в море у берегов и вдали от них над большими глубинами. Пресноводная форма также покидает мелководье после нереста и уходит в пелагиаль водоема (если это водоем озерного типа). Служит объектом питания хищных рыб крупных размеров (свыше 20 см): лососевых родов Salmo и Salvelinus, щуки, окуня, трески и др., рыбоядных птиц и млекопитающих (норка, выдра). Является промежуточным и окончательным хозяином большого числа экто- и эндопаразитов: 94 вида, относящихся к 7 типам. Отличается эвригалинностью — обитает и в резко олиготрофных водоемах с минерализацией менее 10 мг/л (Giles, 1983), и в супергалинных водоемах соленостью до 100 ‰ (Bacesku, Mayer, 1956). Пределы эвритермности от 0 (и, возможно, ниже зимой в северных морях) до 32 °С в горячих источниках Камчатки (Rendahl, 1937).
Практическое значение. Имеет небольшое промысловое значение. Добывается в прибалтийских странах и в бассейне Северного моря. В последние годы в СССР интенсифицировался промысел ставными неводами и тралами на Балтике (Рижский, Финский, Куршский заливы), Азовском море и в связи со вспышкой численности на Камчатке. Используется для приготовления кормовой муки и жира. Жир применяется как медицинский препарат для лечения ран и ожогов. Будучи массовой формой, является серьезным пищевым конкурентом промысловых рыб.
1.4. ОКРАСКА
У колюшковых рыб наблюдается значительная изменчивость по окраске тела как между разными видами, так и между разными популяциями и даже внутри популяций одного вида. Кроме того, у ряда видов имеются еще и сезонные изменения окраски, связанные с периодом размножения (брачная окраска). Лучше всего изменчивость окраски исследована у трехиглой колюшки Gasterosteus aculeatus. На этом объекте выявлено селективное значение разных типов окраски и даже исследована генетика полиморфизма брачной окраски самцов (Hagen, Moodie, 1979). Поэтому мы более подробно остановимся на окраске трехиглой колюшки.
Поскольку трехиглая колюшка занимает разнообразные места обитания, где варьируют световые условия, характер грунта, растительности, плотность хищников, то закономерно варьирует и окраска среди локальных популяций (Hardy, 1978). Колюшка не является исключением среди костистых рыб, для многих видов которых, живущих в открытых водах, характерен серебристо-светлый низ тела и темный верх. Например, зимой морская форма колюшки имеет синий верх головы и спины, низ и бока серебристо-белые, летом задняя часть головы и верх тела вплоть до боковой линии черновато-серые (Берг, 1949, с. 974). Пресноводные колюшки из водоемов с темной водой (или с густой растительностью) темные сверху и светлые снизу, с серией темных пятен на теле. Темная окраска варьирует от коричневой до зеленой, а светлый брюшной участок тела имеет серебристый оттенок. В сильно окрашенной, богатой гуминовыми кислотами воде встречаются популяции-меланисты (Moodie, 1972а).
Итак, налицо защитная функция окраски. Все эти особенности окраски характерны как для самцов, так и для самок, и существенных межполовых различий не наблюдается вне периода размножения. Во время нереста же появляются разительные отличия между самцами и самками. Зрелые самки окрашены обычно, но при созревании икры брюшко самки раздувается и раздутый участок становится еще более белым. Драпкин (1956, с. 120) наблюдал появление брачного наряда самки за несколько секунд до того момента, как самка зашла в гнездо самца. «Брачный наряд появился в виде нескольких, следующих друг за другом от головы до хвоста крупных поперечных темных пятен ромбической формы. Основной фон, особенно жаберных крышек, отливает ярким металлическим блеском, какого у рыбы нет в обычное время». После икрометания самки теряли этот наряд. По мнению Драпкина, брачный наряд самки помогает самцу отличить самку, совершенно готовую к нересту, и является биологическим приспособлением вида, способствующим успеху нереста (Драпкин, 1956, с. 122).
Однако наибольший интерес представляет брачная окраска самца; ее всестороннее исследование привлекло внимание этологов и эволюционистов. Вот как описывал брачный наряд самца Золотницкий: «Ко времени нереста цвета его становятся очень красивы. Спина принимает синеватые оттенки, тело отливает серебром, брюшко, губы, щеки и основания плавников переходят всё в более и более красный цвет, пока наконец не сделаются совершенно шерлаховыми, киноварными, а глаза принимают такой чудный лазоревый или лилово-голубой цвет, какой не поддается никакому описанию. Словом, в это время самчик так красив, что по яркости красок походит скорее на прелестно расцвеченное насекомое, чем на рыбу» (Золотницкий, 1916, с. 373). Окраска самца появляется задолго до нереста и сохраняется на время постройки гнезда, икрометания, ухода за развивающейся икрой и молодью, т. е. на весь нерестовый сезон.
Как и другие вторичнополовые признаки, брачная окраска зависит от гормонального контроля. Если самец кастрирован и затем выдерживается в эксперименте в условиях освещенности дневным светом в течение 16 ч в сутки (условия, стимулирующие созревание), то у него не развиваются красная окраска брюшка и голубая окраска глаз. Но эта окраска у кастрированного самца может быть стимулирована гормональной терапией, например гормоном тестостероном (из группы андрогенов), продуцируемым семенниками (Hoar, 1962а, 1962b; Baggerman, 1966). В норме первый признак появления брачной окраски — развитие голубых участков на верхней части радужной оболочки глаза (ириса), и в итоге ирис становится целиком голубым. Голубоватый оттенок также развивается на спине. Когда глаз стал голубым, красная окраска появляется на горловом участке поверхности рыбы, поскольку в это время увеличивается число пигментов-эритрофоров. При максимальной выраженности брачной окраски красными становятся нижняя часть рта, горло, район жаберной крышки и даже внутренняя сторона брюшной полости, вентролатеральная поверхность головы и брюха, тазового пояса, основания брюшной колючки; вдоль боковой поверхности тела красная окраска распространяется от грудного плавника до начала анального. Остальные участки тела окрашены от неярко-голубого до радужно-зеленого. Из-за сжатия пигментных клеток меланофоров, содержащих черный пигмент, общий тон тела значительно светлеет. Голубая окраска глаза возникает благодаря уменьшению количества кристаллов гуанина (серебристый цвет) в гуанофорах (Titschack, 1922). Красную окраску детерминирует присутствие трех пигментов: наибольшая роль принадлежит пигменту моногидроксиксантофиллу, наименьшая — каротиноидам эстерксантину и астаксантину. Даже у незрелого самца первые два из этих пигментов присутствуют, хотя и в меньшей концентрации, что позволяет рассматривать причину возникновения красной окраски вследствие увеличения концентрации этих пигментов, а не их качественных изменений (Brilsh, Reisman, 1965).
Типичная брачная красная окраска наблюдается в большинстве изученных популяций трехиглой колюшки (Bell, 1984), однако в разных популяциях отмечены разные оттенки красного цвета (Hardy, 1978). Например, в некоторых пресноводных популяциях из Калифорнии (США) красная окраска ограничена вентральной поверхностью головы и плечевого пояса, в то время как колюшки морской формы у Лонг-Айленда (Нью-Йорк, США) имеют максимальное распространение красного цвета по телу, как было описано выше (Bell, 1984). Географическая изменчивость распределения красной окраски по телу практически не изучена.
Большой интерес представляют данные по внутрипопуляционному полиморфизму брачной окраски. Так, Гильбертсон (Gilbertson, 1980, — цит. по: Bell, 1984) описал озерную популяцию колюшки на Аляске (США), где выделил 4 фенотипа по брачной окраске. Все нерестовые самцы обнаруживали красную окраску внутри рта и в области рыла, но различались по окраске головы и тела. «Красный» фенотип имел красную окраску на вентролатеральном участке головы, «золотистый» фенотип — канареечно-желтую окраску по всему телу, «серый» — тускло-коричневую критическую окраску тела, «зеленый» — различные оттенки зеленой окраски тела. Гетерогенно и пространственное распределение этих фенотипов. Так, «красные» самцы более обычны в заливах, чем на побережье открытой части озера, но в пределах каждого залива «красные» и «серые» распространены чаще на илистом, чем на песчаном субстрате, а «золотистые» с равной частотой встречаются на илисто-песчаном и галечно- гравийном грунте. Были также выявлены корреляции между фенотипами по окраске и некоторыми морфологическими признаками. Гильбертсон (Gilbertson, 1980, — цит. по: Bell, 1984) полагает, что «красные» самцы могут обладать сексуальным преимуществом (поскольку известна положительная корреляция между интенсивностью красной окраски и уровнем «броскости» демонстраций элементов брачного танца, — Wootton, 1976), но подвергаться большому давлению хищников из-за демаскирующего эффекта.
Весьма интересны случаи меланизма брачной окраски, когда в популяциях все половозрелые самцы становятся целиком черными во время нереста, а красная окраска полностью отсутствует. В основном такие популяции встречаются на Тихоокеанском побережье (северо-запад США и Канады), но отмечены также и для Калифорнии (Bell, 1982). Наиболее полно изучены 2 случая меланизма: в оз. Майер (острова Королевы Шарлотты, Канада) (Moodie, 1972а, 1972b) и в бассейне р. Чехэлис и сопредельных районах (McPhail, 1969; Hagen, Moodie, 1979; Hagen et al., 1980). Мак-Фейл (McPhail, 1969) показал, что особи из аллопатричных «красносамцовых» и «черносамцовых» популяций скрещиваются в эксперименте и гибриды первого поколения промежуточны по окраске.
В бассейне р. Чехэлис «черносамцовые» популяции колюшек симпатричны с эндемичным видом Novumbra hubbsi (Umbridae), хищником по отношению к икре и молоди колюшки (Novumbra достигает сходных с колюшкой дефинитивных размеров и не является хищником взрослых колюшек). В этом же бассейне парапатрично по отношению к «черносамцовым» обитают типичные популяции «красных» колюшек. В эксперименте черные самцы имеют больший репродуктивный успех в охране потомства на гнездах, чем красные, поскольку территориальные самцы Novumbra (также темноокрашенные) чаще вторгались в территориальные участки красных самцов (Hagen et al., 1980). Очевидно, эволюция «черных» популяций в бассейне р. Чехэлис возникла как ответ на присутствие специфического хищника Novumbra.
1.6. КОЛЮЧКИ СПИННЫЕ И БРЮШНЫЕ
В норме у трехиглой колюшки 3 колючки: 2 передние длинные и зазубренные, а третья самая короткая, ее длина не составляет и половины длины любой из двух передних. Тем не менее общие пределы колебания по числу колючек для Gasterosteus aculeatus составляют 0—5. Работы по скрещиванию особей с разным числом колючек показали, что различия по числу колючек имеют существенную генетическую компоненту (Lindsey, 1962а; Gross, 1977; Campbell, 1979). Подробнее эти работы будут обсуждены в разделе 4.5. Однако Линдсей (Lindsey, 1962а) показал, что воздействие повышенной температуры при выращивании икры и молоди колюшки может индуцировать фенотипы с 4 колючками, что свидетельствует о влиянии условий среды на число колючек.
Гросс (Gross, 1978а) обследовал большое число европейских популяций и нашел, что суммарно около 98 % особей колюшки имеют 3 колючки. В отдельных популяциях, однако, особи с 2 колючками составляли до 11 %, а с 4 до 17 %. Этот же автор обнаружил, что пресноводная форма leiurus более изменчива по числу колючек, чем морская trachurus. В ряде пресноводных популяций частота особей с 2 и 4 колючками в 5—6 раз превышала таковую в морских популяциях (Gross, 1978а). Отмечено возрастание частоты колюшек с 2 колючками по мере продвижения на юг Европы (Penczak, 1965). Гросс (Gross, 1977) полагает, что большая частота фенотипов с 2 колючками на юге говорит о меньшей интенсивности давления хищников на колюшку.
Популяции колюшки с редуцированным числом спинных колючек часто встречаются на северо-западе США и Канады, на Тихоокеанском побережье, например в озерах на островах близ Британской Колумбии (Moodie, Reimchen, 1973, 1976а; Bell, 1984). В оз. Бультон (острова Королевы Шарлотты, Канада) рыбы с 1 и 2 колючками составляли 47 % популяции (Moodie, Reimchen, 1976а), а в озере на о. Тексадо (Канада) те же фенотипы составляли 40% популяции (Bell, 1974). Как правило, в этих популяциях у рыб утрачиваются 1-я и 2-я спинные колючки. У ископаемых колюшек с того же о. Тексадо была обнаружена полная редукция всех 3 колючек у 96% рыб (Bell, Haglund, 1982). Дефицит числа спинных колючек отмечен также для ряда шотландских популяций (Великобритания) (Campbell, 1979). Во всех перечисленных случаях параллельно происходят утрата брюшных колючек, редукция тазового пояса и числа боковых костных пластин.
Для объяснения этого феномена выдвигают 2 причины (не взаимоисключающие): 1) редукция числа колючек детерминируется ослаблением пресса хищников или их отсутствием (Moodie, Reimchen, 1976а; Campbell, 1979), а также наличием убежищ от хищных рыб (Larson, 1976); 2) редукция числа колючек детерминируется низкой концентрацией ионов кальция в олиготрофных озерах, так что идет отбор на низкое содержание кальция в наружном костном скелете (Giles, 1983).
Интересное исследование провел Реймчен (Reimchen, 1980) на оз. Бультон, где он выявил разнонаправленные давления отбора со стороны разных хищников на спинные и брюшные колючки трехиглой колюшки. Автор нашел, что нормальный фенотип (3 спинные и 2 брюшные колючки) чаще встречается в открытой части озера, где особи подвергаются давлению хищничества со стороны рыбоядных птиц, а редуцированный фенотип (2 спинные и 0 брюшных колючек) — около побережья на мелководье в зоне растений. Отсутствие хищных лососевых рыб в этом озере привело к обилию крупных беспозвоночных (рыбоядных насекомых; личинок стрекоз, водных, жуков и т. д.), которым легче схватывать, по мнению Реймчена, «околюченную» поверхность рыбы, чем гладкую. Поэтому пространственную гетерогенность фенотипов колюшки он интерпретирует как отражение давления хищных птиц в открытых водах и насекомых — в литоральной зоне. Эта несомненно привлекательная гипотеза нуждается в экспериментальной проверке.
Логично предположить, что эффективность защиты от хищников-рыб зависит не только от полного набора колючек, но и от их длины и степени зазубренности. Положительную корреляцию между крупными колючками и наличием хищных рыб в водоемах Хаген и Гильбертсон (Hagen, Gilbertson, 1972) нашли на тихоокеанском побережье Сев. Америки в пресных водах, Муди (Moodie, 1972b) и Муди и Реймчен (Moodie, Reimchen, 1976а) на островах Королевы Шарлотты в озерных популяциях, а Гросс (Gross, 1978а) в пресных водоемах Европы. Последний также обнаружил, что морские колюшки имеют более длинные и зазубренные колючки, чем пресноводные. Однако все это лишь косвенные доказательства отбора на длинные колючки. Прямые доказательства были получены лишь Муди (Moodie, 1972b): он нашел, что колюшки из желудков лосося Salmo clarki имели более короткие колючки, чем рыбы из озера.
Изменчивость тазового пояса у Gasterosteus aculeatus. Гросс (Gross, 1978а) показал, что восходящий отросток тазового пояса длиннее у морской формы колюшки на севере Европы, а также у пресноводных популяций, находящихся под прессом хищных рыб. Реймчен (Reimchen, 1983) отмечал положительную корреляцию между длиной спинной колючки и степенью перекрывания птеригофоров спинной колючки с боковыми пластинами, так что перекрывание это укрепляет прочность опоры спинной колючки. Чем длиннее восходящий отросток тазового пояса, тем больше степень перекрывания между ним и боковыми пластинками, так что это перекрывание может стабилизировать брюшные колючки при схватывании колюшки хищной рыбой.
Gasterosteus является одним из трех родов, где выражена та или иная степень редукции тазового пояса, вплоть до полной его утраты.
Большинство популяций с редуцированным поясом описаны с западного побережья Сев. Америки: островов Королевы Шарлотты (Moodie, Reimchen, 1973), о. Тексадо (Британская Колумбия, Канада) (Bell, 1974), у ископаемого позднемиоценового вида Gasterosteus doryssus (Невада, США). Однако Кэмпбелл (Campbell, 1979) описал редукцию пояса для озерных популяций колюшки на островах близ побережья Шотландии (Великобритания), что указывает на конвергентную природу и независимое возникновение этой редукции.
Кэмпбелл (Campbell, 1979) и Жиль (Giles, 1983), проведя скрещивания, продемонстрировали генетическую природу межпопуляционных различий фенотипов с разной степенью редукции тазового пояса. Белл (Bell, 1984) исследовал индивидуальное развитие тазового пояса у нормального (не редуцированного) фенотипа и обнаружил детальное сходство центров окостенения при формировании передних отростков тазового пояса с остатками тазового пояса в «редуцированных» популяциях. На основании этого он пришел к выводу о гомологии между ними, и редуцированные фенотипы он рассматривает как результат педоморфоза (неотении).
Часто наблюдается связь между редукцией тазового пояса и уменьшением числа спинных колючек. Выше была описана работа Реймчена (Reimchen, 1980), показавшая связь между обилием водных насекомых, имеющих хватательные придатки (личинки стрекоз), и утратой у колюшек спинных и брюшных колючек. Видимо, колючки увеличивают вероятность схватывания мальков рыб насекомыми — такой механизм Реймчен (Reimchen, 1980) предлагает для объяснения этого феномена. На западном побережье Сев. Америки Муди и Реймчен (Moodie, Reimchen, 1976а) и Белл (Bell, 1974) для многих популяций обнаружили существенную корреляцию между отсутствием хищных рыб в водоемах и отсутствием тазового пояса. Такая ситуация может быть результатом сдвига в селективной смертности: от доминирующей роли хищников к доминированию насекомых. Однако имеются и иные случаи: в оз. Пакстон (о. Тексадо, Канада) (Larson, 1976) и в некоторых шотландских популяциях (Campbell, 1979; Giles, 1983) обнаружены популяции колюшек с редуцированным тазовым поясом при наличии хищных рыб, симпатричных с колюшкой (Salmo clarki, Salmo trutta и другие лососевые). Эти озера имеют низкую концентрацию кальция (важнейшего элемента, необходимого для формирования костной ткани), в то же время соседние с ними озера с большей концентрацией кальция являются местообитаниями колюшек с нормальным тазовым поясом. Жиль (Giles, 1983) предлагает кальциевый механизм редукции тазового пояса (редукция таза вследствие трудностей изъятия кальция для постройки костной ткани тазового пояса из слабоминерализованной воды резко олиготрофных озер). Белл (Bell, 1984) предполагает, что редукция тазового пояса детерминируется обоими механизмами (недостатком кальция и отбором со стороны насекомых в отсутствие хищных рыб), но сам же приводит данные, противоречащие обеим гипотезам (на Аляске найдены колюшки с редуцированным тазовым поясом и нормальной выраженностью 3 спинных колючек).
К этому можно добавить, что, по моим наблюдениям, в бассейне Белого моря (Лоухский р-н КАССР) колюшки с 3 спинными колючками и нормальным тазовым поясом обитают в олиготрофных озерах при наличии хищников Salmo trutta, Perca fluviatilus (оз. Кривое и оз. Святое на о. Великом), в олиготрофных озерах при отсутствии хищников (озера Лобанежское, Безымянное), а также в эвтрофных озерах при наличии хищников (оз. Ваняево) и при отсутствии хищников (озера Крестовое, Машинное). Это еще более запутывает ситуацию. Видимо, в разных регионах действуют разные механизмы отбора на этот признак, и относительный вклад каждого механизма меняется как в пространстве, так и во временной шкале в эволюции вида.
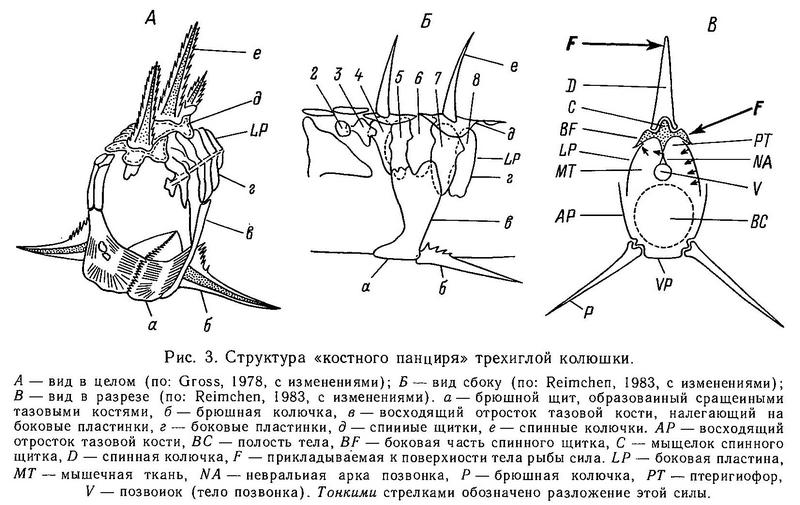
Адаптивное значение боковых пластин на теле до конца непонято. В принципе боковые пластины относятся многими авторами к разряду защитных структур (Bell, 1984), особенно это относится к видам Spinachia spinachia (морская форма), Gasterosteus aculeatus (морская форма) и Pungitius sinensis (пелагическая пресноводная форма). У перечисленных видов полный ряд пластин как бы заключает тело с боков в костный панцирь (хотя и не со всех сторон). Леа (Lea, 1968, — цит. по: Wootton, 1976) показал, что многопластинковые особи Gasterosteus aculeatus будто бы испытывали меньший урон после схватывания хищников, чем малопластинковые, но экспериментальных доказательств этого пока мало. К тому же на севере ареала в Европе, Азии и Америке малопластинковые колюшки сосуществуют с хищными рыбами (лососями) в тысячах озер. Реймчен (Reimchen, 1983) на трехиглой колюшке показал, что когда внешнее усилие прикладывается к первым двум спинным колючкам, то оно передается на боковые пластины, предотвращая отклонение спинных колючек в стороны (рис. 3). В разделе 1.6 описывался замковый механизм, обеспечивающий фиксацию колючек в выпрямленном состоянии и предотвращающий складывание колючек назад. Боковые же пластины обеспечивают предотвращение наклона колючек в стороны. Стабильность колючек весьма важна, когда хищная рыба пытается заглотить колюшку, поэтому 4—5 абдоминальных боковых пластин, связанных, с одной стороны, с восходящим отростком тазового пояса, а с другой — с птеригофорами спинных колючек, функционально очень важны, так как создают как бы жесткое кольцо вокруг передней части тела. Неясно, однако, какова роль других боковых пластин, лежащих спереди и сзади от этих 4—5 абдоминальных пластин. Кроме того, неясно, какова роль полного ряда относительно мелких пластин у Spinachia spinachia и Pungitius sinensis, не связанных с брюшными и спинными колючками, как у Gasterosteus aculeatus.
Межродовая изменчивость числа боковых пластин. В пределах всего семейства число боковых пластин варьирует от 0 до 41. Наибольшее число пластин (суммарно на теле + на киле) у Spinachia spinachia — 41. Судя по всему, этот вид не обнаруживает заметной изменчивости по числу пластин (Leiner, 1934; Nelson, 1971а; Wootton, 1976; Gross, 1978b).
У трехиглой колюшки число пластин колеблется (суммарно на теле + на киле) от 0 до 35. Огромная изменчивость пластин у представителей этого таксона и факторы, ее определяющие, рассмотрены в обширной литературе, более подробный анализ которой будет дан ниже. Можно привести лишь ссылки на некоторые обобщающие работы: Penczak, 1965, 1966; Miller, Hubbs, 1969; Hagen, McPhail, 1970; Wootton, 1976; Bell, 1976, 1984; Hagen, Moodie, 1979, 1980; Зюганов, 1983г. В ряде работ дан анализ наследования разных морф по числу пластин (Munzing, 1959; Lindsey, 1962а; Hagen, 1973; Hagen, Gilbertson, 1973; Avise, 1976; Ross, 1973; Paepke, 1982; Зюганов, 1983г.).
Обзор межродовой изменчивости колюшковых по числу боковых пластин выявляет 3 мономорфных рода, где нет заметной изменчивости по этому признаку (Spinachia, Culaea, Apeltes), и 2 чрезвычайно полиморфных рода Gasterosteus и Pungitius, включающих комплекс видов и форм, где в сумме реализованы 8 фенотипов, обнаруживающих удивительный межродовой параллелизм (Зюганов, 19836).
Все разнообразие морфологических вариантов по числу костных пластин в родах Gasterosteus и Pungitius по существу можно свести к 8 основным типам (рис. 4). Имеется всего 4 градации признака «пластины на теле»: 1) пластины полностью покрывают тело (20—30, чаще 25—27), 2) пластины частично покрывают тело (10—20, чаще 12—15), 3) пластин на теле мало (2—10, чаще 5—7), 4) пластин на теле нет (0). Это не условно выделяемые градации с плавным непрерывным переходом друг в друга, а реально существующие дискретные варианты в природных популяциях; если строить кривую распределения этого признака, суммируя множество популяций, то мы получим 4-модальную кривую с 4 пиками и 3 провалами между ними.

Имеется также 2 градации признака «киль на хвостовом стебле»: а) киль есть, б) киля нет. Более дробное разделение — киль сильно выражен и киль слабо выражен — мы не учитываем (здесь, как и в любой другой классификации живых объектов, неизбежно некоторое огрубление, поскольку чрезмерное дробление еще более опасно, чем огрубление).
Таким образом, все возможные сочетания 4 градаций пластин на теле и 2 градаций киля дают нам 8 возможных фенотипов (=морф, =морфотипов) у Pungitius и Gasterosteus. На основании литературных данных и собственных эксперименов по скрещиванию разных морф я полагаю, что пластины на теле и киль — два разных признака, детерминируемые разными локусами, но в ряде популяций эти локусы сцеплены (Зюганов, 1983 г.) (см. раздел 4.5).
Как и всякая попытка формализации, эта схема не лишена некоторых элементов условности. Например, в полиморфных природных популяциях Gasterosteus aculeatus иногда трудно отнести некоторые особи к варианту 1(а) (trachurus) или к 2(а) (semiarmatus) в том случае, когда у этих особей имеется разрыв шириной в одну пластину между пластинами на теле и килем. Однако Хаген и Гильбертсон (Hagen, Gilbertson, 1973) отмечали, что скрещивания между такими особями давали расщепления в F1, характерные для trachurus. Скрещивания между особями с аналогичными разрывами, но шириной в 2 пластины (или более) давали расщепления, характерные для semiarmatus. Бывают случаи, когда с одной стороны тела у рыбы полный ряд пластин, а с другой — разрыв между килем и пластинами на теле. В этом случае, вероятно, надо при отнесении рыбы к тому или иному морфотипу ориентироваться на ту сторону, где признак наиболее развит, а другую сторону считать недоразвитием признака. Я не исключаю также возможности существования в ряде случаев фенокопий (модификация фенотипа, вызванная особыми условиями среды, напоминающая изменение фенотипа, обусловленное мутацией) (Майр, 1974), хотя до сих пор у трехиглой колюшки они обнаружены не были (Hagen, Gilbertson, 1973).
Род Gasterosteus. У трехиглой колюшки Gasterosteus aculeatus наиболее полно реализованы 4 фенотипа: 1(a) (trachurus), 2(a) (semiarmatus), 3(b) (leiurus), 4(b) (hologymna) (рис. 4). Остальные фенотипы встречаются намного реже, а фенотип 4(a) (hologymna с килем) вообще до сих пор не найден в природных популяциях и никогда не выщеплялся в экспериментах по скрещиванию разных морф. Фенотип 1(b) (trachurus без киля) до недавнего времени также не был найден в природе. Лишь в 1983 г. мной был обнаружен 1 экз. трехиглой колюшки, представленный этим фенотипом (24 пластины на теле слева, 23 — справа, киля нет) в популяции «Карьер-солоноватый» на побережье губы Чупа (Кандалакшский залив, Белое море). Фенотип 2(b) (semiarmatus без киля) также представлен лишь 5 экз., пойманными в пресном оз. Марцы (о. Великий, Белое море), где обитает триморфная популяция (trachurus + semiarmatus + leiurus). Все 5 рыб не имели киля и имели от 15 до 17 пластин на теле (Зюганов, 1983 г). Данными о колюшках этого фенотипа из других мест я не располагаю. Фенотип 3(a) (leiurus с килем) обнаружен в турецком оз. Изник (Munzing, 1962). Популяция «Изник» мономорфна по этому фенотипу (3—7 пластин на теле, киль есть). Мономорфные популяции «leiurus с килем» описаны для некоторых озер Сев. Америки (Hagen, Gilbertson, 1972; Kynard, Curry, 1976; Coad, Power, 1974; Hagen, Moodie, 1982).
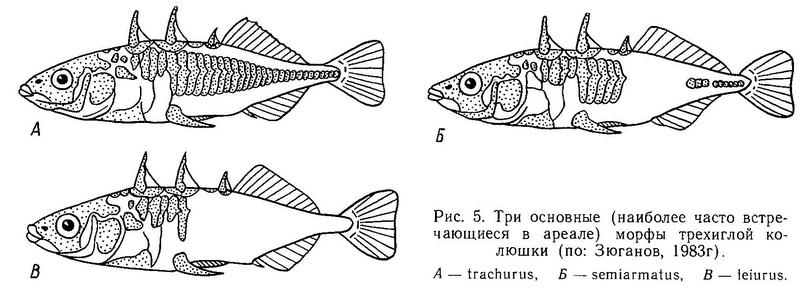
Классификация морф, принимаемых зарубежными авторами, несколько отличается от вышеизложенной классификации, принимаемой мной, хотя последняя базируется на классификации европейских авторов, просто она несколько расширена, в нее включены фенотипы, ранее неизвестные. Кроме того, главное ее отличие от других классификаций в том, что пластины на теле и на киле рассматриваются мной как разные признаки, а зарубежные авторы объединяют их в один признак. К тому же европейские и североамериканские авторы для обозначения одних и тех же морф используют разную терминологию.
Европейские авторы выделяют всего 4 фенотипа (trachurus, semiarmatus, leiurus, hologymna) (Bertin, 1925; Münzing, 1959; Wootton, 1976). Trachurus — тело полностью покрыто пластинами, переходящими на хвостовом стебле в киль; semiarmatus — пластины есть на теле и киле, но между первыми и последними всегда есть разрыв; leiurus (в старой литературе gymnurus) — пластины есть лишь в передней части тела, киля нет; hologymna — пластин на теле и киля нет. Таким образом, европейские авторы не выделяют фенотип «leiurus с килем», относя его к морфе semiarmatus (например, Мюнцинг, (Münzing, 1962) мономорфную популяцию «leiurus с килем» из оз. Изник называет semiarmatus-тип»),
В Европе большинство особей морфы trachurus образует анадромную морскую форму, морфа leiurus образует жилые пресноводные популяции, и в зоне пространственного перекрывания между ними (побережье западной части Балтийского моря и южной части Северного моря) наблюдается повышенная частота морфы semiarmatus, которую большинство европейских авторов трактует как результат интерградации (гибридизации) в послеледниковое время (Münzing, 1972; Paepke, 1982). Американские авторы считают, что в европейской терминологии термины trachurus, leiurus и semiarmatus приобрели нежелательные экологическое и эволюционное сопутствующие значения и что все это приводит к путанице, и воздерживаются от использования европейской классификации. Хаген и Муди (Hagen, Moodie, 1982) и Белл (Bell, 1984) используют свою классификацию морф: complete — полная серия пластин вдоль тела; partial — серия пластин в передней и хвостовой части тела, разделенная «неопластиненным» голым участком: low — серия пластин только в передней части тела. Нетрудно видеть, что complete, partial и low соответствуют trachurus, semiarmatus и leiurus по фенотипическому выражению. Однако американские авторы настаивают, что термином trachurus были обозначены все морские популяции, а термином leiurus — все жилые пресноводные популяции независимо от их фенотипической структуры; сюда же они предлагают включить и partial, и complete.
На мой взгляд, как раз это и будет вносить путаницу в терминологию, поскольку в Европе нет такой большой генетической дистанции, как в Америке, между пресноводной и морской группировками. Как будет показано ниже, пресноводная leiurus легко возникает из морской trachurus при определенных условиях.
У колюшки после заглатывания воздуха в первые дни жизни дальнейшая регуляция газов в пузыре происходит за счет секреции газов. Поскольку колюшка не может менять давление газа в пузыре посредством глотания, изменение давления достигается за счет секреции газа специальным органом — «чудесной сеткой» (сеть капилляров в стенке пузыря). У Gasterosteus aculeatus пузырь разделен на переднюю и заднюю части посредством диафрагмы. Передняя часть — секреторная, в ней расположено «красное тело», или газовая железа с «чудесной сеткой», а в задней части газ поглощается (резорбируется) (Fange, 1953; Строганов, 1962).
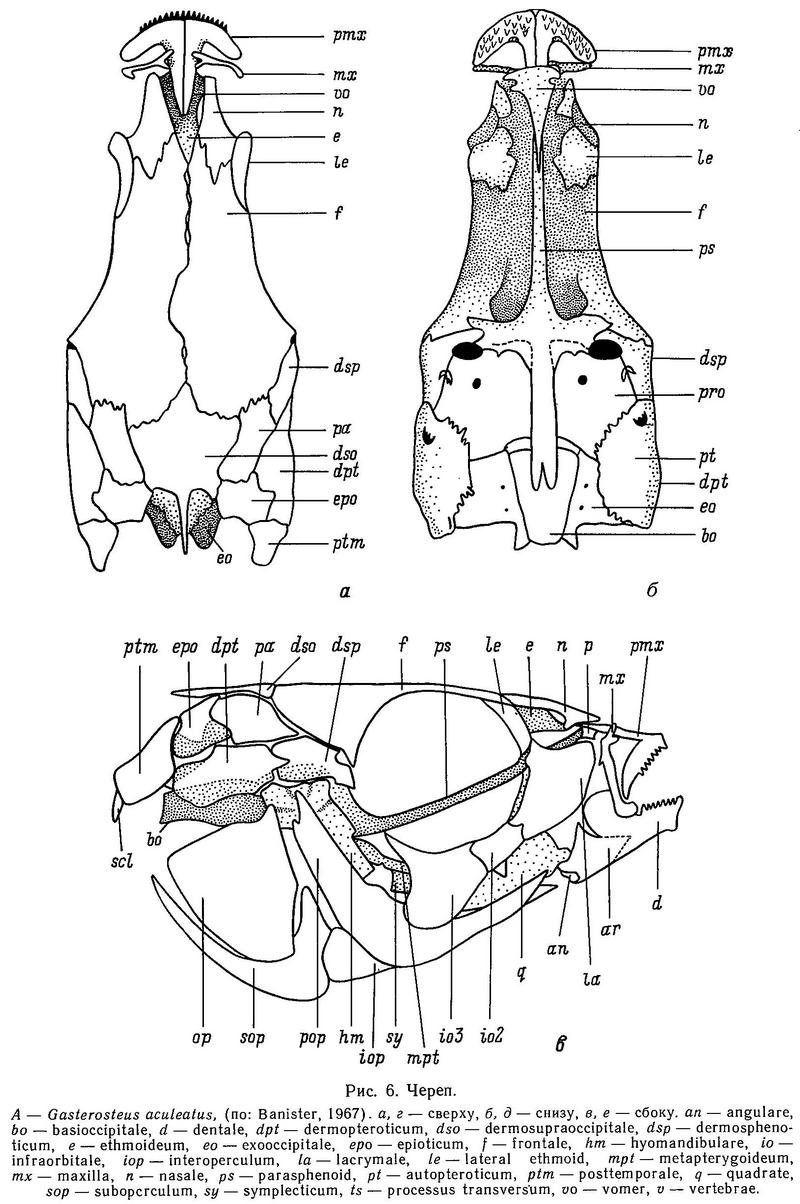
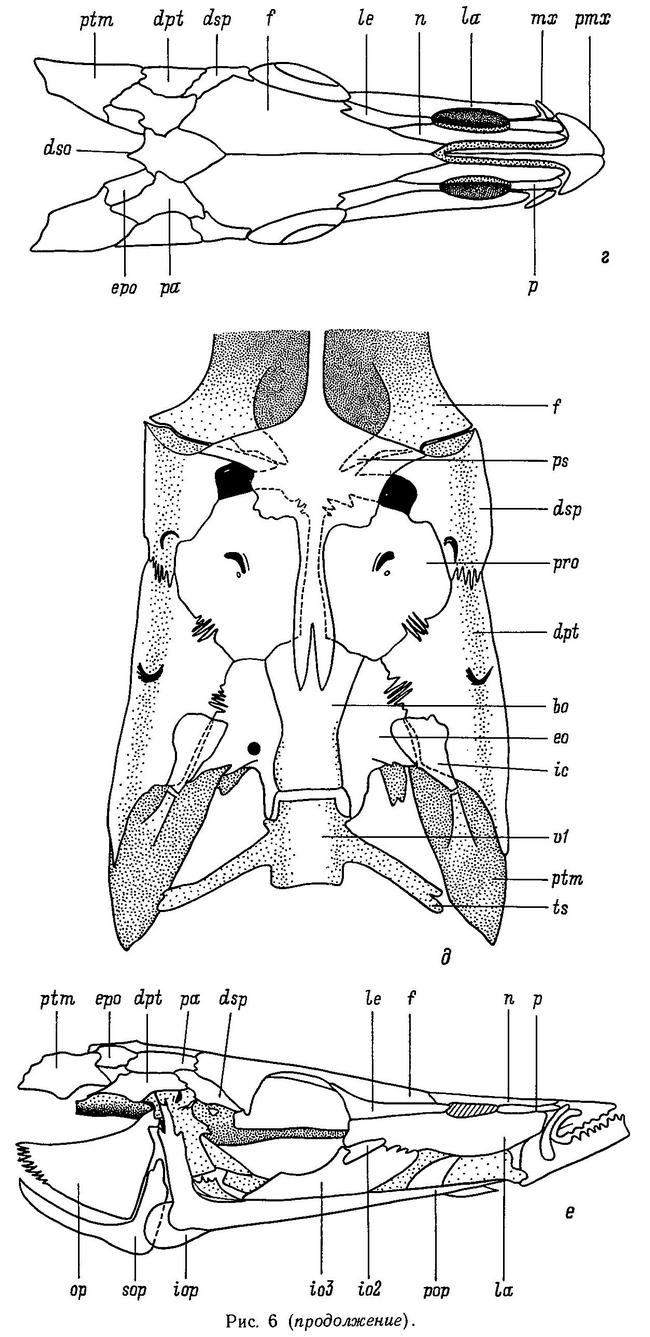
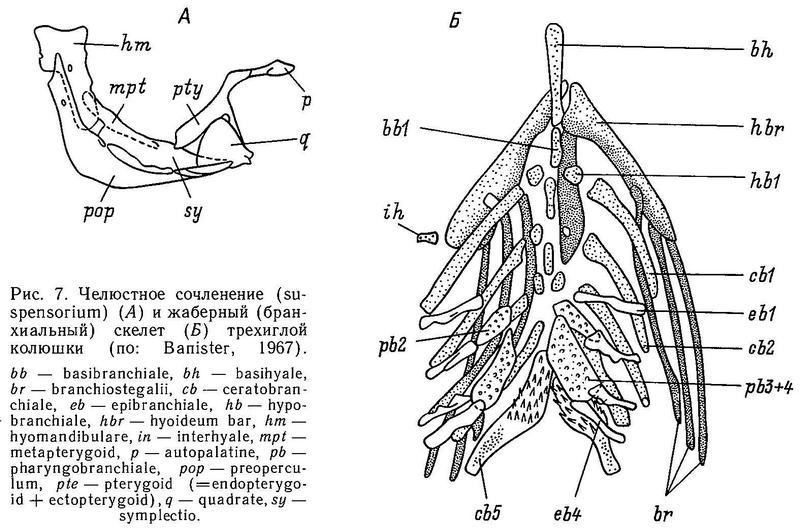
У трехиглой колюшки Gasterosteus aculeatus маленький конечный рот, однако нижняя челюсть несколько выдается за верхнюю. Парная верхняя челюсть состоит из 2 костей: premaxilla и maxilla, восходящий отросток premaxilla лежит на ростральном хряще. Парная нижняя челюсть состоит из 3 костей: dentale, angulare и articulare; последняя сочленяется с quadrate, формируя челюстное сочленение (рис. 6). Только premaxilla и dentale несут мелкие острые зубы, на остальных костях зубов нет. Связь между челюстями и neurocranium (мозговой коробкой) осуществляется через подвеску, состоящую из 6 костей: hyomandibulare, metaptherygoid, symplecticum, quadrate, pterygoid и autopalathine (рис. 7). В верхней дорсальной части центральной «рукоятки» hyomandibulare имеются две головки, которые сочленяются с мозговой коробкой (neurocranium): одна головка входит в полость у стыка autosphenoticum и костей prooticum,a другая головка входит во впадину на вентральной поверхности кости autopteroticum (есть еще третья головка, hyomandibulare, она сочленяется с operculum, образуя связь между челюстью и жаберным отделом головы, — Wootton, 1976).
Особенность устройства челюстного сочленения колюшки состоит в том, что у нее отсутствуют челюстные связки (ligamentum), которые перекрещивались бы со связками между ethmoid-блоком и palatine, premaxilla и maxilla. Это связано со способностью колюшки к выпячиванию верхней челюсти при захвате пищи. Механизм этого выпячивания описан Александером (Alexander, 1967). В исходном положении, когда рот закрыт, premaxilla втянута (отведена назад), но когда колюшка открывает рот, чтобы схватить жертву, premaxilla выпячивается и остается в таком же положении даже когда жертва схвачена и рот уже закрыт. Выпячивание достигается двумя способами. 1. При открывании рта maxilla поворачивается вперед так, что соединяется с каракоидным отростком нижней челюсти, вследствие этого premaxilla сдвигается относительно maxilla. Это вызывает сжатие рострального хряща с этмоидным хрящом и таким образом premaxilla выпячивается. 2. При открывании рта натягивается артикулярно-максиллярная связка (лигамент); натяжение этой связки поворачивает maxilla вдоль ее продольной оси, двигая мыщелок maxilla вперед. Ткань хрящевая, связывающая premaxilla с премаксиллярным мыщелком maxilla, также связана с ростральным хрящом, так что поворот maxilla вокруг своей продольной оси влечет за собой выпячивание premaxilla (Alexander, 1967). Выдвижной рот обычно имеют рыбы, питающиеся мелкими объектами (Алеев, 1963).
Выпячивание челюстей дает колюшке при питании немалые преимущества. Во-первых, рот колюшки выдвигается очень быстро и резко приближается к пищевому объекту, так что жертве остается меньше шансов увернуться от рта. Во-вторых, выпячивание облегчает колюшке сбор пищи со дна, когда тело рыбы находится под углом ко дну. В-третьих, при питании мелким планктоном можно втянуть в рот больший объем воды. И, в-четвертых, это облегчает глотание (Alexander, 1967).
Другим (передним) краем hyomandibulare сочленяется с metaptherygoid — следующей костью в подвесной системе. У Gasterosteus hyomandibulare образует с продольной осью тела угол 80°, а «сфенотическая» и «оперкулярная» головки расположены относительно рукоятки под острым углом.
Следующая кость в подвесной системе — metaptherygoid; она простирается от переднего конца hyomardibulare и наклонена вниз к symplecticum, примыкая к ее боковой поверхности. В свою очередь symplecticum своим передним концом сочленяется с quadrate. Эта кость формирует переднюю часть челюстного сочленения. У Gasterosteus symplecticum имеет относительно широкий задний конец и суживается кпереди. И дорсальная и вентральная части symplecticum имеют костяные выступы (гребни), но гребень дорсальной части значительно шире. Culaea имеет сходный symplecticum, но дорсальный гребень выражен слабее, чем у Gasterosteus.
Сочленение с передним концом symplecticum обеспечивает кость quadrate. Именно эта кость вкупе с другими сочленовными костями формирует челюстное сочленение. Quadrate имеет форму развернутого веера с длинным тонким вентральным отростком, который прикрепляется к переднему концу preoperculum (одной из костей жаберной крышки). Сзади от quadrate расположен pterygoid. У костистых рыб эта кость обычно состоит фактически из 3 костей: meta-, endo- и ectopterygoid, но у сем. Gasterosteidae имеется только две из них — metapterygoid и трехлучевой pterygoid. Банистер (Banister, 1967, — цит. по: Wootton, 1976) полагает, что трехлучевой pterygoid колюшек фактически представлен слившимися endo- и ectopterygoid. Однако Мурал (Mural, 1973) считает, что endopterygoid у колюшек утерян и трехлучевая кость есть не что иное, как ectopterygoid.
Задний широкий отросток pterygoid контактирует с symplectic, маленький средний отросток примыкает к quadrate, а передний отросток (называемый палатинным) прилегает к autopalatine.
Gasterosteus имеет относительно широкий pterygoid.
Крыша черепа. Череп у колюшковых удлиненной формы и суживается кпереди (конусообразный) (Anker, 1974). Топографически череп делится на 4 отдела: этмоидальный, орбитальный, отический и затылочный (Anker, 1974). Крыша черепа сформирована костями: nasale, frontale, parietale, dermosupraoccipitale (рис. 6). Ha palatine отсутствуют зубцы. Особенностью черепа колюшковых являются большие размеры глазниц. Глазные орбиты окаймляют следующие кости: дорсальную часть окаймляет frontale, переднюю часть глазниц — lacrymale и 2-я + 3-я infraorbital, а заднее окаймление глазниц у колюшек необычно в сравнении с другими костистыми, поскольку есть редукция некоторых костей infraorbital. У колюшек заднюю стенку глазницы формирует нисходящий отросток frontale, который контактирует со спинным выступом parasphenoid. Supraethmoid отсутствует, что также не характерно в целом для костистых рыб. У колюшек неполная серия инфраорбитальных костей, причем меньше всего инфраорбитальных костей у Apeltes. Pterosphenoid у колюшек также отсутствует (Wootton, 1976).
Жабры. Жабры колюшковых защищены от внешней среды жаберной крышкой, фактически состоящей из 4 кожных костей: sub-, inter-, preoperculum и operculum (Anker, 1974). У колюшек имеется 5 жаберных дужек, но только 4 из них несут жабры. В норме каждая дужка состоит из дорсального (epibranchiale) и вентрального элементов (ceratobranchiale). Каркасом, который скрепляет эти элементы, является pharyngobranchiale, который расположен дорсальнее epibrachiale; роль каркаса выполняют также hypo- и basibranchiale, которые расположены вентральнее ceratobranchiale. У Gasterosteus epibranchiale имеются на дужках от 1-й до 4-й, ceratobranchiale — от 1-й до 5-й, в то время как hypobranchiale и basibranchiale найдены на дужках от 1-й до 3-й. Pharyngobranchiale имеется на 2-й дужке (рис. 7).
На внутренних сторонах жаберных дужек имеются выступы — жаберные тычинки, а на внешних — жаберные лучи, к которым прикреплены жаберные лепестки. Жаберные лепестки свободно висят в жаберной полости, они покрыты тонкими, поперечно стоящими складочками (вторичные пластинки), которые называются лепесточками. Служат они для увеличения площади поверхности диффузии кислорода. Обе стороны лепесточков имеют эпителий, состоящий из плоских клеток, есть также опорные клетки, разделяющие обе стороны лепесточков. Края этих опорных клеток ограничивают кровяной промежуток в лепесточках. Такое устройство лепесточков укорачивает путь, который должен пройти кислород, чтобы диффундировать в кровь. Хлоридные клетки, принимающие участие в осморегуляции (см. раздел 2.7), расположены у основания лепестков и изредка в лепесточках (Matthiessen, Brafield, 1973).
У Gasterosteus и Culaea operculum имеет прямоугольную форму с хорошо развитыми передним и задним отростками. Все виды колюшковых имеют серповидный suboperculum и по его форме распадаются на две группы: Gasterosteus, Culaea, Spinachia и Apeltes, Pungitius. Interoperculum имеет заострение в передней части и широкий задний сегмент, сходный у всех родов. Preoperculum завершает серию жаберных костей. Эта кость имеет вертикальный сегмент и горизонтальную рукоятку, так что напоминает по форме букву Г. У Culaea и Gasterosteus угол между сегментами прямой, а у Pungitius и Spinachia меньше 90°, в то время как у Apeltes больше 90°. Таким образом, по строению жаберной крышки, с одной стороны,объединяются Gasterosteus и Culaea, а с другой — Pungitius и Spinachia (Mural, 1973).
Число жаберных тычинок на 1-й жаберной дужке является таксономическим признаком. Изменчивость по этому признаку у колюшковых будет рассмотрена в разделе 4.5.
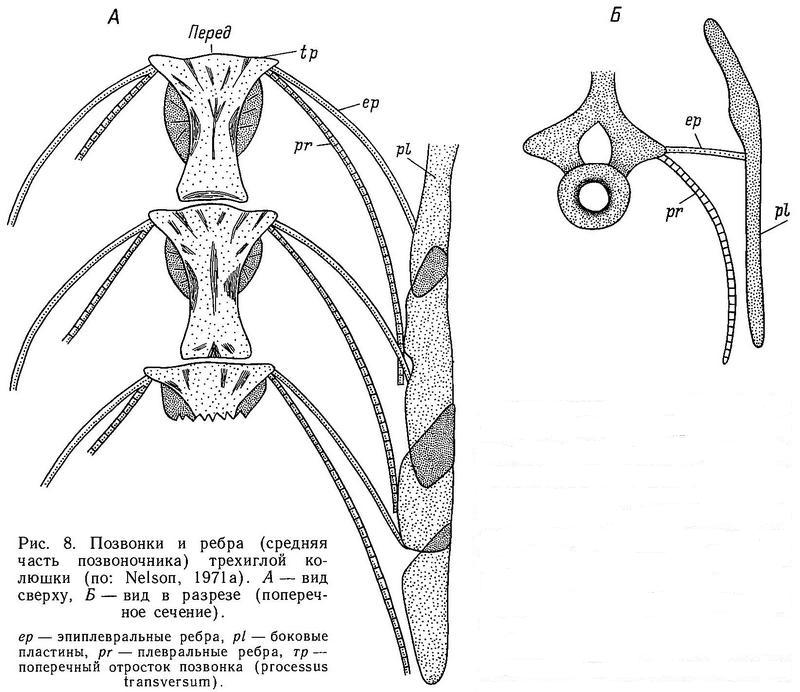
Позвонки. Первый позвонок сочленяется с затылочным мыщелком (occipitale condyle), который сформирован только костью basioccipitale. У трехиглой колюшки обычно 14 прекаудальных (абдоминальных) и 18 каудальных позвонков, так что 1-я гемальная дуга обычно начинается с 15-го позвонка. Эпиплевральные ребра находятся, как правило, на первых 13 позвонках, а плевральные ребра с 3-го по 14-й позвонок (рис. 8).
Хвостовой плавник у колюшковых, как и у других костистых рыб, поддерживается гипуральными костями, которые представляют собой увеличенные гемальные арки последнего каудального позвонка. У Gasterosteus aculeatus и Gasterosteus wheatlandi гипуральная пластина расщеплена на верхнюю и нижнюю. Эта особенность является диагностическим признаком рода Gasterosteus (Nelson, 1971а). Гипуральная пластина Spinachia выглядит как единая (Nelson, 1971а). Другие элементы скелета хвостового плавника также обнаруживают межродовую изменчивость. Для Gasterosteus обычна лишь 1 эпиуралия, для Pungitius 2, но они находятся в тесном контакте и представляются как одна косточка; у Culaea эпиуралии разделенные; Spinachia также имеет 2 эпиуралии, Apeltes 1 (Mural, 1973).
Тазовый (брюшной) пояс. Описание тазового пояса было дано ранее в разделе 1.6. Можно лишь напомнить, что по структуре брюшного пояса в одну группу объединяются роды Gasterosteus, Pungitius, Culaea, а 2 остальных рода (Spinachia и Apeltes), не имеющие восходящего отростка пояса и имеющие другой тип строения брюшной пластины, хорошо отличимы от первой группы и сильно различаются между собой (Nelson, 1971а).
Плечевой пояс колюшковых состоит из следующих костей: cleithrum, scapula, coracoid и ectocoracoid, а также костей posttemporale и supracleithrum, связывающих грудной скелет с черепом (рис. 9). Лучи грудного плавника, за исключением самого верхнего, сочленены с 4 actinost (radialii), которые расположены сразу же за scapula и coracoid. Наиболее дорсально расположенная posttemporale (на самом деле являющаяся костью головного отдела) примыкает к черепу. Связь posttemporale с черепом самая прочная у Gasterosteus aculeatus, а самая непрочная у Culaea; у других родов степень прочности сочленения промежуточна. У Gasterosteus wheatlandi posttemporale отсутствует, у Gasterosteus aculeatus она имеет ромбическую форму. Supracleithrum — маленькая узкая кость, которая связана с posttemporale и cleithrum. Cleithrum у всех колюшковых имеет вид длинной и прямой рукоятки с широкой треугольной головкой в верхней дорсальной части кости (Nelson, 1971а). Gasterosteus, Spinachia и Pungitius имеют cleithrum сходной формы: широкий край заднего конца рукоятки с острым дорсальным выступом на головке. Pungitius и Gasterosteus имеют гребень на заднем конце scapula, а под ним расположены несколько actinost. Coracoid расположен под scapula. В переднем отделе coracoid колюшковых нет отверстия, но следы его обнаружены у Apeltes, Culaea и Pungitius. У ближайших родственников колюшек — рыб сем. Aulorhynchidae — отверстие coracoid хорошо развито. Ectocoracoid (= infracleithrum) — наиболее вентрально расположенная кость плечевого скелета. У взрослых особей колюшек она частично сливается с вентральной частью coracoid. У Gasterosteus, Pungitius и Spinachia ectocoracoid вытянут вперед, вниз и по направлению к срединной линии тела рыбы.
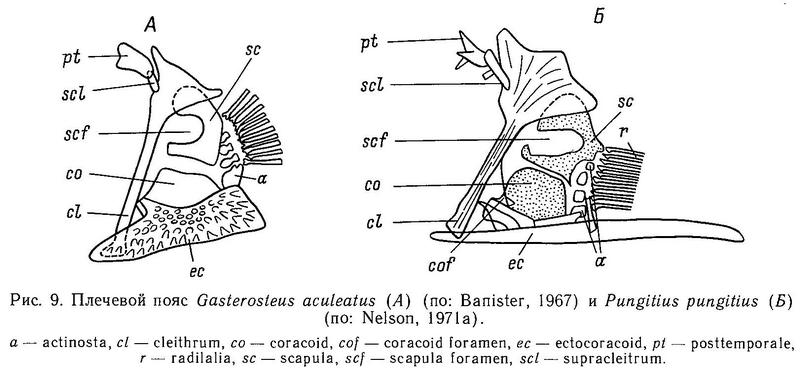
Ectocoracoid у Gasterosteus имеет треугольную форму, а у Pungitius и Spinachia — эта длинная и тонкая кость.
В целом наиболее сходные грудные скелеты (плечевые пояса) имеют Gasterosteus и Pungitius.
Зрение является одним из самых важных органов чувств у колюшек. Зрительная поверхность у Gasterosteus aculeatus составляет 3.5% от общей поверхности тела (Beukema, 1968). Поведенческие исследования показали, что Gasterosteus aculeatus имеет цветное зрение с пиком чувствительности к свету 510—594 нм для самок и 502—594 нм для самцов (Cronly-Dillon, Sharma, 1968); показано, что колюшки хорошо различают геометрические фигуры (Meesters, 1940).
Обоняние. Обонятельный эпителий у Gasterosteus aculeatus составляет 0.4% от общей поверхности тела (Teichmann, 1954). Колюшковые рыбы относятся к микросматикам (рыбы, у которых обоняние играет незначительную роль среди других органов чувств) (Голубев, Марусов, 1979). На рыле колюшковых имеются 2 носовых отверстия, ведущих в обонятельную полость, в которой обонятельный эпителий образует всего лишь 2 складки. Вода входит и выходит из обонятельной полости из-за периодического изменения давления, связанного с дыхательными движениями (Wootton, 1976).
2.1.1. СОЗРЕВАНИЕ САМОК
Строение и развитие яичника. У трехиглой колюшки длиной менее 9—10 мм гонады еще невозможно дифференцировать на мужские и женские. Зачатковые клетки заключены в парные генитальные гребни, расположенные вентральнее пронефроса (головной части почки), и хорошо отличимы от окружающих их тканей. Эти генитальные гребни принимают форму дефинитивных яичников по достижении самкой длины свыше 10 мм. С ростом рыбы овидукты от каждого яичника сливаются в общий овидукт, открывающийся в клоаку (Swarup, 1958а). Стенка яичника трехслойная. Наружный слой эпителиальный, в середине — толстый слой соединительной ткани и самый внутренний слой — собственно зародышевый эпителий, из которого формируется яичник. Полость яичника постепенно переходит в овидукт. В дальнейшем стенки яичника впячиваются в его полость, формируя поперечные пластины, и в этих пластинах развиваются ооциты (Stanworth, 1953).
Овогенез. Зародышевые клетки, оогонии, делятся митотическим делением, продуцируя ооциты. В ооците можно видеть ядро и множество ядрышек. Каждый ооцит окружен несколькими слоями клеток: текой (дериватом соединительной ткани), фолликулярным эпителием (дериватом зародышевого эпителия) и вителлиновой мембраной (= хорионом). Созревающий ооцит начинает наполняться желтком (процесс, называемый вителлогенезом). На периферии цитоплазмы появляются вакуоли, содержащие желток, которые в конечном счете заполняют всю цитоплазму ооцита. Последующие мейотические деления приводят к гаплоидизации хромосомного набора, это событие происходит непосредственно перед нерестом (Tromp-Blom, 1959).
Колюшковые рыбы — порционно-нерестующие, и поэтому ооциты созревают с разной скоростью. Например, сразу же после первого нереста зрелая икра отсутствует в яичнике, но там остаются ооциты на разных стадиях развития (Stanworth, 1953).
В нерестовый период масса яичника Gasterosteus aculeatus может составлять до 30 % от общей массы тела, тогда как в зимний период она равна 4 % (Meakins, 1974).
Факторы контроля созревания. На созревание половых продуктов влияют 3 главных фактора: температура, продолжительность светового дня и обеспеченность пищей. На основании многочисленной серии экспериментов Баггерман (Baggerman, 1957) показала, что самыми благоприятными условиями для созревания самок трехиглой колюшки из Нидерландов являются температура 20° С и световой режим 16 ч света и 8 ч темноты в сутки (16 С + 8 Т). Самки, пойманные в природе в осенне-зимний период (с ноября по апрель), все созрели в аквариумах при этом режиме. Время созревания «ноябрьских» самок составило 31 сут, а «апрельских» — всего 2 сут. Интересно, что световой режим играет более важную роль в созревании, чем температурный: длинный световой день индуцировал созревание рыб даже при температуре 5° С (Baggerman, 1957), напротив, короткий день (8 С + 16 Т) при высокой температуре (20 °С) слабо индуцировал созревание.
Интенсивность света, по мнению Баггерман (Baggerman, 1957, 1969), также имеет значение: самая благоприятная интенсивность 300 лк, и дальнейшее увеличение интенсивности света не ускоряет созревания, однако Мак-Инерней и Эванс (Mclnerney, Evans, 1970) на канадских колюшках показали, что свет интенсивностью 5 лк индуцирует нормальное созревание гонад, причем независимо от длины волны света (рыбы в эксперименте освещались зеленым, голубым, пурпурным и красным светом и обнаружили сходные скорости созревания гонад).
Описанные выше эксперименты, на мой взгляд, хорошо отражают широкую норму реакции Gasterosteus aculeatus по способности к созреванию в различных световых и температурных условиях. Ведь таксон Gasterosteus aculeatus имеет огромный ареал в широтном отношении от южной Европы, южной Калифорнии и южной Кореи до Аляски, Гренландии, Новой Земли и Чукотки, т. е. районов высокоарктических. В водоемах высокоарктических районов сезон, свободный ото льда, включает буквально несколько недель, и температуры воды даже летом сравнительно низкие, однако световой день очень длинный. Поэтому колюшки в описанных экспериментах созревали даже при низкой температуре при условии длинного светового дня. То же самое можно сказать и об интенсивности света: поскольку колюшки обитают в водоемах с разной окраской и прозрачностью воды (в чистых олиготрофных озерах и в болотистых водоемах с темной непрозрачной водой), то для созревания им достаточно интенсивности света в 5 лк независимо от его окрашенности.
Возвращаясь снова к вышеописанным экспериментам по влиянию света на созревание колюшек, отметим, что наблюдалось 2 исключения из правил положительного влияния длины светового дня на созревание (Baggerman, 1957). Ювенильные колюшки менее 22 мм длиной и посленерестовые рыбы в течение 1.5 мес после нереста не реагировали созреванием на высокие температуры и длинный световой день. Баггерман (Baggerman, 1972) полагает, что в обоих случаях яичники находились на стадии начального периода деления оогониев и формирования ооцитов, отсюда отсутствие эффекта температуры и света на созревание рыб. В целом же при благоприятных световых и температурных условиях, при хорошей обеспеченности пищей в аквариуме колюшки могут созревать за 4 мес (Baggerman, 1972).
Как и у других рыб, длина светового дня и повышенные температуры стимулируют созревание колюшковых рыб посредством гормональной системы. Xoap (Hoar, 1962b) стимулировал созревание колюшек, содержавшихся в неблагоприятных для созревания условиях (8 С + 16 Т), путем инъекций гормонов из группы гонадотропинов (лютеинизирующим гормоном — ЛГ). Инъекция сырого экстракта гипофиза лосося также стимулировала созревание гонад. Следовательно, длинный световой день стимулирует продуцирование гипофизом гонадотропина, а тот в свою очередь стимулирует развитие гонад. Исследования на других видах рыб показывают, что гонадотропин не действует на ранние стадии развития икры, а действует только тогда, когда в ооците происходит формирование желтка (вителлогенез), поэтому, видимо, гонадотропин стимулирует завершение созревания яичника (Hoar, 1926b).
Обеспеченность пищей — важный фактор созревания гонад. Вуттон (Wootton, 1973а, 1973b) экспериментально показал, что низкий уровень обеспеченности пищей задерживал созревание гонад, а созревшие самки были меньшего размера, чем самки, хорошо снабжавшиеся пищей. Самки, которых не кормили после первого нереста, продуцировали еще лишь одну кладку икры.
Плодовитость. Колюшки порционно-нерестующие рыбы, поэтому их плодовитость складывается из 2 компонент: одноразовой плодовитости и числа нерестов. Оба эти показателя положительно коррелируют с размером самки — крупные самки продуцируют больше икры за 1 нерест и нерестятся большее число раз за сезон, чем мелкие, при одинаковой обеспеченности пищей (Wootton, 1973а, 1973b). Вуттон (Wootton, 1976), много занимавшийся плодовитостью трехиглой колюшки, приводит такие цифры: одноразовая плодовитость мелких рыб, имеющих минимальную массу половозрелой стадии (0,4 г), составляет 20—30 икринок, а крупные самки, весящие 3 г и более, продуцируют за 1 нерест 300—400 икринок. Плодовитость Gasterosteus aculeatus Белого моря Мухомедияров (1966) оценивает от 300 икринок у мелких рыб (длиной в 62—72 мм) до 530 у крупных (длиной 83—86 мм); общий предел изменчивости плодовитости 477—923 (в среднем в порции 324) икринок. При этом Мухомедияров учитывал и крупную икру (созревшую), и икру незрелых порций. Смирнов (1951) оценивает максимальную плодовитость Gasterosteus aculeatus Черного моря в 1400 икринок (учитывая все порции — всего 6), размах колебаний плодовитости 782—1381 икринка. Диаметр икринок в яичниках колебался от 0.2 до 1.95 мм. Баггерман (Baggerman, 1957) показала, что у самок трехиглой колюшки, выдерживавшихся в аквариумах при температуре 20 °С и световом режиме 16 С + 8 Т, продолжительность нереста составляла 60 дней; в среднем они продуцировали за это время 15 кладок икры. При температуре 20 °С и световом режиме 8 С + 16 Т сезон размножения составлял лишь 6.5 дней, при 2 отложенных кладках икры за это время. По данным Вуттона (Wootton, 1976), самка трехиглой колюшки массой в 1 г при хорошей обеспеченности может нереститься в сезон до 20 раз.
Вуттон (Wootton, 1973а) не нашел связи между уровнем обеспеченности пищей и размером икринок, а также между размером самки и диаметром икринок, откладываемых самкой. Однако Потапова и соавт. (1968) обнаружили у трехиглой колюшки дифференциацию самок на быстро- и медленнорастущих. В нерестовый сезон быстрорастущие самки весили больше и продуцировали больше икры, но икринки их имели меньшую массу и меньшее содержание липидов и белков, чем икринки медленнорастущих рыб.
2.1.2. СОЗРЕВАНИЕ САМЦОВ
Морфология семенников. Парные семенники расположены в вентральной области брюшной полости. У зрелого самца трехиглой колюшки длина кобласовидного семенника в среднем 1.5 мм и диаметр 0.8—0.9 мм, масса семенников составляет около 1 % от массы тела. Снаружи семенники обильно пигментированы. Они снабжаются кровью генитальной артерии, дорсальйо входящей в семенник. Парные семявыводящие протоки vas deferens сливаются в общий проток, открывающийся в клоаку между анальным отверстием и выходом мочеточника (Craig-Bennett, 1931).
Кроме продуцирования спермы семенник производит стероидные гормоны андрогены, влияющие на вторичнополовые признаки самца.
В каждом семеннике участок, продуцирующий сперму, содержит 150—200 трубочек, расположенных радиально. Они сливаются в дорсальный каналец, который переходит в vas deferens. Стенки трубочек содержат слой эпителиальных клеток и слой соединительной ткани. Сперматогонии расположены в трубочках, а интерстициальные клетки, продуцирующие андрогены, расположены между трубочками (Courrier, 1922; Stanworth, 1953).
У мальков дифференциация генитальных (зародышевых) гребней начинается по достижении рыбы 14 мм длины, и при длине 25 мм семенники становятся полностью дифференцированными и содержат сперматоциты и сперматиды (Swarup, 1958а). Однако самец становится полностью половозрелым по достижении длины 40 мм (Wootton, 1976).
Созревание сперматозоидов у колюшковых происходит так же, как и у других костистых рыб: сперматогонии — сперматоциты I порядка — сперматоциты II порядка — сперматиды — сперматозоиды. Зрелые сперматозиоды трехиглой колюшки имеют плоскую дисковидную головку, хорошо диффенцированную среднюю часть и типичный жгутиковидный хвост (Swarup, 1958а).
У самцов деление сперматогониев начинается сразу же после предыдущего нереста, и при достаточно высокой температуре воды уже зимой в семенниках присутствуют зрелые спермии (Craig-Bennett, 1931). Условия высокой температуры воды и короткого светового дня ингибируют сперматогенез (Hoar, 1962b). Как и созревание самок, созревание самцов зависит от увеличивающегося светового дня. Только при длинном световом дне интерстициальные клетки начинают секретировать достаточное количество андрогенов, чтобы самец стал полностью половозрелым (Baggerman, 1957). В условиях короткого дня (8 С + 16 Т) инъекция лютеинизирующего гормона млекопитающих (андрогена) стимулировала сперматогенез и развитие вторичнополовых признаков трехиглой колюшки (Hoar, 1926b). Следовательно, удлинение светового дня влияет на нервную систему колюшек, в свою очередь нервная система активирует продуцирование гипофизом гонадотропного гормона, который активирует созревание сперматозоидов и продукцию андрогенов интерстициальными клетками. Андргены же стимулируют развитие вторичнополовых признаков (брачную окраску, продуцирование клея), без которых невозможен нерест самца.
2.1.3. РАЗВИТИЕ ИКРЫ И МОЛОДИ
Кладки икры у колюшковых рыб всех без исключения видов развиваются в гнезде под охраной самца. Кроме того, самец вентилирует икру в гнезде и убирает неоплодотворенные и погибшие икринки, а после выклева молодь в течение нескольких дней также находится под защитой самца. В силу этого выживаемость икры у колюшковых рыб колеблется между 90 и 100 %, что намного превышает аналогичный показатель у ряда других групп костистых рыб, не имеющих заботы о потомстве.
Икра трехиглой колюшки окрашена в желтый цвет за счет каротиноидного пигмента, который принимает участие в окислительных процессах, связанных с дыханием зародыша.
Каждая икринка покрыта оболочкой, называемой вителлиновой мембраной, или хорионом. В этой мембране есть поры, называемые микропиле. При оплодотворении спермий проникает в икру через микропиле. После оплодотворения в течение 1 ч икра колюшки обнаруживает обычную для костистых рыб кортикальную реакцию (образование перивителлинового пространства), блокирующую проникновение в икру других спермиев.
Ниже приводится описание стадий эмбрионального и личиночного развития трехиглой колюшки при температуре воды 17—18 °С (Swarup, 1985b; Петина, 1973) (рис. 11).
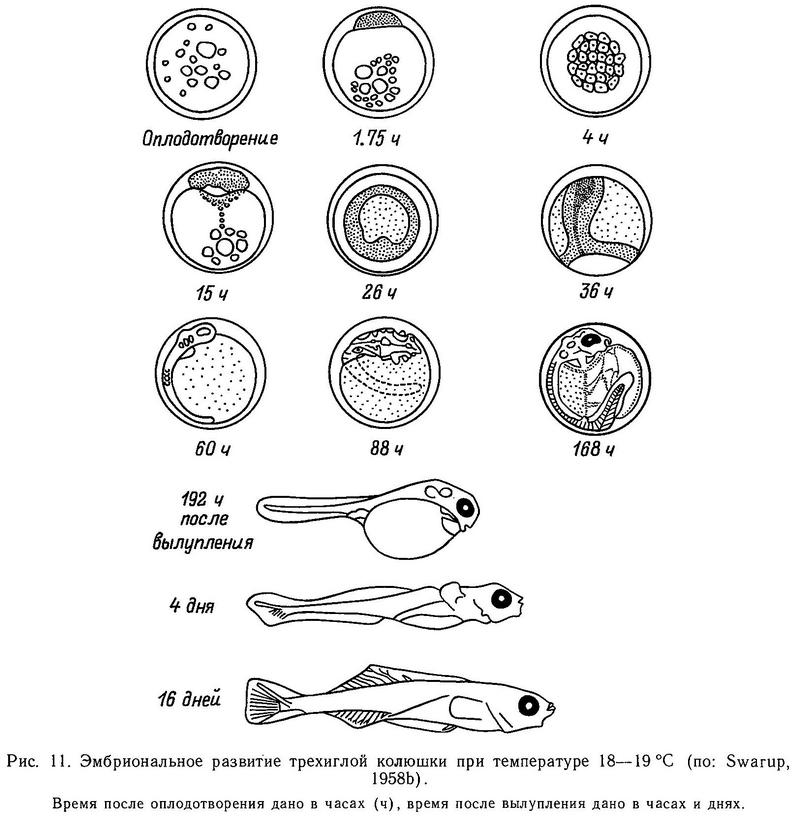
I. Образование перивителлинового пространства. При образовании перивителлинового пространства в результате оводнения яйца и растяжения яйцевой оболочки диаметр икринок увеличивается с 1.6 до 1.8 мм. Цитоплазма концентрируется на анимальном полюсе, образуя плазменный бугорок. Этот процесс продолжается около 75 мин и заканчивается формированием бластодермального диска.
II. Дробление бластодиска (бластуляция). Через 1.6—2 ч после оплодотворения бластодермальный диск начинает делиться и образует сначала 2 бластомера, затем 4, 8 и в возрасте 3—3.5 ч 16 бластомеров. Желток не затрагивается этим делением. В возрасте 6 ч происходит образование крупноклеточной морулы, 7.5 ч — среднеклеточной и 14 ч — мелкоклеточной морулы. В возрасте 17 ч зародыш находится на стадии бластулы, бластодерма куполообразно выступает над поверхностью желтка. В процессе интенсивного деления клеток между бластодермой и желтком формируется синцитиальный слой (перибласт), ядра которого принимают участие в питании клеток развивающегося зародыша. В возрасте 21 ч бластодерма отделена от перибласта узкой щелью (бластоцелем, или субгерминально-подзародышевым пространством). Клетки краевой зоны бластодиска начинают наползать на желток и подворачиваться (инвагинировать).
III. Гаструляция. В самом начале гаструляции заметны волнообразные движения поверхности яйца, обусловленные периодическим сокращением перибласта. Это приводит к вращению яйца внутри оболочки и постоянному перемешиванию перивителлиновой жидкости, особенно интенсивному на анимальном полюсе яйца, что улучшает газообмен развивающегося зародыша. В возрасте 34 ч гаструляция продолжается: бластодерма продолжает обрастать желточный мешок. На одном из участков краевой зоны нарастания образуется бугорок, клетки которого интенсивно делятся, и бластодерма подворачивается внутрь. В этом месте образуется зачаток тела зародыша, который постепенно расслаивается на зародышевые пласты — экто-, эндо- и мезодерму. Тело зародыша удлиняется и утолщается.
IV. Органогенез. В возрасте 48 ч края бластодермы, обрастающей желток, смыкаются. В головном отделе зародыша образуются два выпячивания — глазные пузыри, производные промежуточного мозга. Становятся различимыми передний, средний и задний отделы головного мозга. В хвостовом отделе виден Купферов пузырек, а в средней части зародыша закладываются первые три сегмента тела зародыша (сомита).
В возрасте 56—63 ч в глазных пузырях появляются щелевидные углубления, они начинают прогибаться внутрь, образуя глазные бокалы. Виден зачаток хорды. В возрасте 72 ч происходит образование слуховых капсул, продолжается дифференциация на 5 отделов зачатка мозга, появляются обонятельные ямки, в глазах образуются хрусталики. У зародыша имеется уже 10—20 сомитов.
V. Функционирование кровообращения. В возрасте 80—90 ч появляется зачаток сердца. Обонятельные ямки начинают преобразовываться в обонятельные капсулы. Сердце начинает пульсировать. Тело зародыша начинает пигментироваться. Продолжается дифференциация головного мозга. Происходит образование сосудов кровеносной системы зародыша. Появляются подкишечно-желточная вена (vena subintestinalis vitellina), спинная аорта (aorta dorsalis). Появляются зачатки грудных плавников.
VI. Подвижное состояние зародыша. В возрасте 100—112 ч продолжается формирование кровеносной системы, появляется пигмент в форменных элементах крови. В слуховых капсулах закладываются отолиты. Хвост начинает отделяться от желточного мешка, и тело приобретает подвижность, начинаются биения хвоста. На желточном мешке образуется разветвленная кровеносная сеть. Продолжается дифференциация головного мозга. Глаза сильно пигментированы. Желудочки мозга начинают покрываться крышей.
В возрасте 130 ч сердце хорошо дифференцировано на желудочки, предсерие и sinus venosus. Появляются жаберные щели. В возрасте 160 ч передний желудочек мозга закрывается, и головной отдел эмбриона полностью сформирован. Видны все отделы головного мозга: передний — tel-, промежуточный — dien-, средний — mesencephalon, мозжечок — cerebrellum, продолговатый мозг — medulla oblongata. Перикардиум и сердце продолжают увеличиваться в размере. В возрасте 182 ч кровеносная система на желточном мешке развита очень мощно. В венозный синус (sinus venosus) сердца с левой стороны зародыша впадает желточный Кювьеров проток (ductus Cuvieri vitellina). С левой стороны по желточному мешку проходит крупный непарный сосуд — подкишечно-желточная вена (vena subintestinalis vitellina), которая впадает в левый желточный Кювьеров проток. Из сердца кровь по парным мандибулярным дугам аорты (arcus mandibularis aortae) течет в голову и спинную аорту (aorta dorsalis). Спинная аорта переходит в хвостовую артерию (arteria caudalis), которая загибается в хвосте в виде восьмерки и несет кровь в хвостовую вену (vena caudalis). Хвостовая вена переходит в подкишечную вену (vena subintestinalis), которая выходит на желточный мешок и образует сеть мелких желточных сосудов и один крупный — подкишечно-желточную вену. Из головного отдела кровь течет по передним кардинальным венам (vena cardinalis anterior) и впадает в Кювьеровы протоки.
Сосудистая сеть на желточном мешке является одним из эмбриональных органов дыхания, и сильное ее развитие является дополнительным приспособлением к не совсем благоприятным кислородным условиям внутри кладки икры, лежащей в гнезде (несмотря на усиленную вентиляцию самцом гнезда). Биение хвоста эмбриона способствует перемешиванию перивителлиновой жидкости и улучшению газообмена.
VII. Вылупление. При температуре 18—19 °С вылупление эмбриона происходит на 7—8-е сутки после оплодотворения. Биения хвостового и вибрирование грудных плавников приводят к тому, что эмбрион толкается головой в яйцевую оболочку. На голове эмбриона развиваются железы вылупления. Их лизирующий секрет ослабляет прочность яйцевой оболочки. Эта оболочка после резких движений хвоста прорывается. Сначала освобождается хвостовой отдел, затем голова зародыша.
Вылупившиеся предличинки имеют длину 4—6 мм. На теле имеются 14—17 туловищных и 12—14 хвостовых сегментов. На желточном мешке сильно развита кровеносная система, длина желточного мешка составляет 1/3 длины тела. Подкишечная вена (vena subintestinalis) теперь несет кровь в печень, а не в желточный мешок. Связь хвостовой вены с подкишечной прерывается, и она (vena caudalis) теперь продолжается непосредственно в заднюю кардинальную вену (vena cardinalis posterior), которая, сливаясь, с передними кардинальными венами (vena cardinalis anterior), впадает в Кювьеровы протоки. В жаберном отделе заметны сосуды, несущие кровь к жабрам, в грудных плавниках проходит парная подключичная артерия (arteria subclavia). Рот неподвижен и закрыт (Vrat, 1949; Петина, 1973). Тело окаймлено непарной плавниковой складкой. Кишечник залегает над желтком, около анального отверстия закладывается мочевой пузырь. Печень также расположена над желтком. Глаза открыты. В желтке сохраняются две крупные жировые капли, выполняющие гидростатическую функцию.
Только что вылупившиеся предличинки активно плавают благодаря быстрым движениям хвостового плавника и вибрации грудных плавников. После каждого периода плавания предличинка ложится на дно на бок, но и в это время грудные плавники продолжают двигаться.
VIII. Формирование челюстного аппарата. В возрасте 190—240 ч у свободных эмбрионов наблюдается резорбция желтка. Начинается формирование челюстного аппарата. Меланофоры густо покрывают поверхность тела. Грудной (плечевой) пояс дифференцирован на scapula и coracoid. В течение 4 сут после выклева желток исчезает. Челюстной аппарат развивается, и рот может открываться и закрываться.
IX. Смешанное питание. В возрасте 5—6 сут после вылупления предличинка начинает переходить на активное питание, становясь личинкой. Над кишечником выпячивается плавательный пузырь, и для наполнения пузыря воздухом личинка плывет к поверхности и заглатывает воздух. В это же время формируется жаберная крышка. У личинки еще имеется небольшой остаток желтка, по-прежнему имеется общая плавниковая складка. В хвостовом отделе плавниковой складки формируются мезенхимные зачатки плавниковых лучей. Личинки активно плавают.
В последующие 8 дней личинки теряют личиночные признаки и принимают взрослую форму при длине 11 мм. Плавниковая складка дифференцируется на спинной, хвостовой и анальный плавники. После появления лучей в хвостовом плавнике лучи появляются в спинном и анальном плавниках. Первой проявляется брюшная колючка, затем анальная и 3-я спинная, затем 1-я и 2-я спинные колючки (Swarup, 1958b).
После резорбции желтка молодь начинает есть инфузорий, личинок копепод и другую планктонную пищу, имеющую достаточно малые размеры (см. раздел 2.3).
Сроки вылупления и темпы развития трехиглой колюшки зависят от температуры воды: при 8 °С вылупление происходит на 40-й день, а при 25 °С на 6-й (Heuts, 1956). Если развивающуюся икру Gasterosteus aculeatus подвергать температурному шоку высокими (33 °С) и низкими (0 °С) температурами, то наблюдаются ненормальное развитие эмбрионов (уродства) и триплоидизация: у колюшек вместо нормы 2п = 42 хромосомы образуются 63 хромосомы (Swarup, 1959).
В эксперименте молодь трехиглой колюшки достигала длины 17 мм за 1 мес после вылупления. При температуре воды 20 °С и хорошей обеспеченности пищей колюшку можно довести до состояния половозрелости за 4 месяца при длине 45 мм и массе 1 г (Van Mullem, 1967). В природных же популяциях трехиглая колюшка достигает половозрелости как минимум за 1 год (см. раздел 2.2).
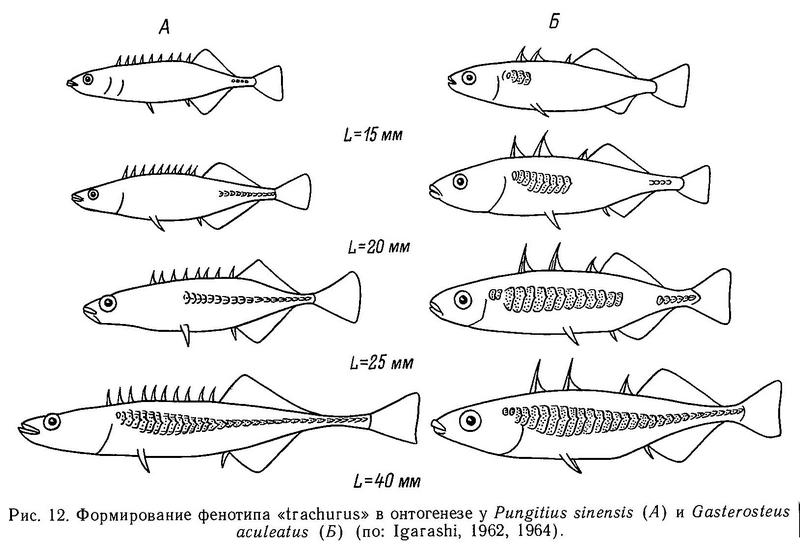
В заключение этого раздела рассмотрим онтогенез важного образования, являющегося таксономическим признаком колюшковых — боковых костных пластин. Развитие пластин исследовано у нескольких видов: Gasterosteus aculeatus (Igarashi, 1964, 1970), Pungitius pungitius, Pungitius sinensis, Pungitius sp. (Igarashi, 1962, 1963, 1968).
У всех исследованных видов развитие пластин начинается, когда рыбы достигают длины тела 15 мм, и заканчивается при длине 35—40 мм. Однако если у Pungitius sinensis закладка пластин начинается с хвостового стебля и продолжается по направлению к голове, то у Gasterosteus aculeatus формирование полного ряда пластин происходит иначе. Начинается одновременная закладка 4 пластин в передней части тела. От этих образований закладка продолжается и к передней, и к задней части (по направлению к хвосту). На хвостовом стебле независимо появляется другой центр закладки (при длине рыбы в 20 мм). Затем ряд пластин нарастает по направлению к переднему отделу тела, и при длине рыб 40 мм пластины на теле и киле соединяются (рис. 12). Существование двух центров формирования пластин, по мнению Игараши (Igarashi, 1964), — уникальный случай среди костистых рыб. Таким образом, морфа trachurus у трехиглой колюшки в индивидуальном развитии проходит последовательно стадии hologymna, leiurus и semiarmatus. Морфа trachurus у Pungitius развивается, как видно из предыдущего, иным путем. Эволюционное значение этих межродовых различий будет обсуждено в разделе 4.5.5.
2.2. ВОЗРАСТ И ТЕМП РОСТА
Все виды колюшковых имеют небольшие размеры и являются короткоцикловыми рыбами. Поэтому трудно ожидать у колюшковых сложной возрастной структуры. Действительно, исследование возраста и роста колюшковых в природных популяциях и экспериментальных условиях (аквариумы) согласуется с этой парадигмой. Лучше других возраст и рост исследован у трехиглой колюшки (Jones, Hynes, 1950).
Джонс и Хайнс изучили возрастную структуру морфы leiurus Gasterosteus aculeatus из реки Биркет (Северо-Западная Англия) и морфы trachurus из солоноватого карьера, расположенного поблизости. По их данным, колюшки обоих морф живут максимум 4 года, и большинство начинает нереститься в годовалом возрасте при длине 36 мм. Сходную возрастную структуру и время первого нереста имеют пресноводные колюшки из небольшого пресного пруда «Придди Пул» на юго-западе Англии (Pennyquic, 1971) и оз. Дальнего (Камчатка, СССР) (Тиллер, 1972). Пресноводные колюшки морфы leiurus из озер на о. Кадьяк (Аляска, США) начинают нереститься в годовалом возрасте и живут до 4 лет (Greenbank, Nelson, 1959). Сходную продолжительность жизни обнаруживают пресноводные колюшки морф trachurus и semiarmatus из Восточной Канады (провинция Квебек) (Coad, Power, 1973b).
Колюшки морской формы trachurus, иследованной на побережье Нидерландов (Van Mullem, Van der Vlugt, 1964), нерестятся в годовалом возрасте, и большинство из них после нереста гибнут. Колюшки leiurus, обитающие в ручьях Южной Англии, также гибнут после первого же нереста в годовалом возрасте (Mann, 1971). Вместе с тем балтийские колюшки морф trachurus и semiarmatus живут до 4 лет, но начинают нереститься лишь по достижении двухгодовалого возраста (Апеег, 1973).

По данным Мухомедиярова (1966), морская форма trachurus трехиглой колюшки Кандалакшского залива Белого моря (СССР) живет до 4—5 лет, основу нерестового стада составляют двух- и трехгодовики (85—99 %). По моим данным (Зюганов, 1980), основу нерестового стада составляют трех- и четырехгодовики (80%) (табл. 3). По данным Мухомедиярова (1966), а также по моим данным (Зюганов, 1980), годовики в нерестовом стаде отсутствуют, видимо они не участвуют в нересте. В пресноводных озерах на побережье Кандалакшского залива возрастная структура колюшек морф trachurus и leiurus сходна с возрастной структурой морских колюшек: рыбы живут до 4—5 лет и созревают в двухгодовалом возрасте (табл. 3). Только в оз. Клюквенном (табл. 4), где обитают сразу обе морфы — жилая trachurus и leiurus, наблюдалось некоторое различие между ними по возрастной структуре. У leiurus не было пятигодовиков, а четырехгодовики составляли 2 %, в то время как у trachurus четырехгодовики составляют 12 %, и встречаются также пятигодовики.
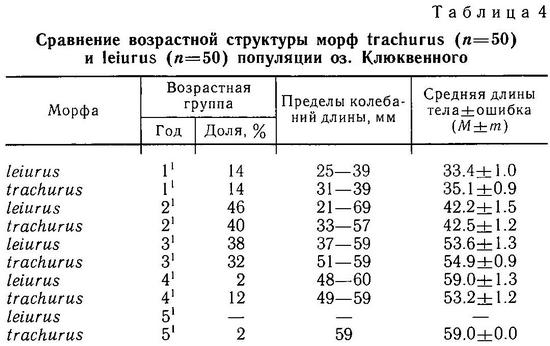
Интересно, что интродукция морских колюшек trachurus из Кандалакшского залива в пресноводные небольшие изолированные водоемы, где не было раньше колюшек (карьеры, затопленные грунтовыми водами), приводила к тому, что потомки 1-го поколения от запущенных основателей начинали нереститься в годовалом возрасте при длине 40—45 мм (Зюганов, 1983 г). Сходные результаты наблюдались при акклиматизации в эти водоемы и пресноводных колюшек leiurus из близлежащих озер (Зюганов, 1983 г). Видимо, вступление годовиков в фазу половозрелости в этих карьерах объясняется хорошей обеспеченностью пищей и небольшой плотностью колюшек в первые годы жизни в этих водоемах, пока популяции там не достигали высокой численности и плотности.
Выше (см. раздел 2.1.3) уже упоминалось, что в аквариумных условиях колюшек удавалось доводить до половозрелости при хорошей обеспеченности пищи за 4 мес (Van Mullem, 1967).
Подводя итоги этой части раздела, можно заключить, что норма реакции по предельному возрасту у морской и пресноводной форм такова, что рыбы могут жить от 1 до 5 лет и первый нерест может иметь место в возрасте 1 или 2 лет. Колюшки не созревают, пока не достигнут в длину 36—40 мм (Craig-Bennett, 1931; Baggerman, 1957; McPhail, 1977). Это хорошо согласуется с концепцией Никольского (1974) о критической длине тела рыбы, при которой происходит ее созревание. Таким образом, возраст первого нереста зависит от темпа роста рыбы. Если эта критическая длина не достигается рыбой на следующее лето после рождения, то она начнет нереститься только через год.
Однако неясно, почему в некоторых популяциях наблюдается гибель всех или почти всех особей после нереста (Van Mullem, Van der Vlugt, 1964; Hagen, 1967; Mann, 1971). В этих популяциях предельный возраст определяется возрастом первого созревания. Возможно, адаптивное значение этой массовой гибели такое же, как и у лососей рода Oncorhynchus: обильное развитие кормовых объектов на трупах родителей обеспечивает лучшее выживание потомству.
Темпы роста. У колюшковых темп роста лучше изучен на трехиглой колюшке. Темп роста у нее варьирует как внутри, так и между популяциями. В некоторых популяциях в пределах одного возрастного класса самки значительно крупнее самцов (Van Mullem, Van der Vlugt, 1964), так что межпопуляционная изменчивость по соотношению полов может быть причиной межпопуляционной изменчивости по темпу роста. Экстенсивность и интенсивность инвазии паразитами также влияют на рост рыб (влияние паразитизма на рост колюшек будет обсуждено в разделе 2.5). Другим важнейшим фактором, влияющим на рост колюшек, является обеспеченность пищей. Температура, соленость и световые условия в водоеме также влияют на рост рыб.
Например, в р. Биркет (Англия), где нерест в мае, колюшки-сеголетки leiurus достигали в длину в среднем 15 мм (к концу июля), двухлетки 42.7, трехлетки 45.6, четырехлетки 51.4 мм. Самый высокий темп роста — на первом году жизни, а потом он резко замедляется (Jones, Hynes, 1950). Несмотря на хорошую обеспеченность пищей в р. Биркет (обильная фауна планктонных и бентосных беспозвоночных), рост колюшек в этом водоеме самый слабый в сравнении с другими изученными случаями из Англии, Канады и США (Wootton, 1976), а также в сравнении с популяциями бассейна Белого моря (Зюганов, 1980) (рис. 13).
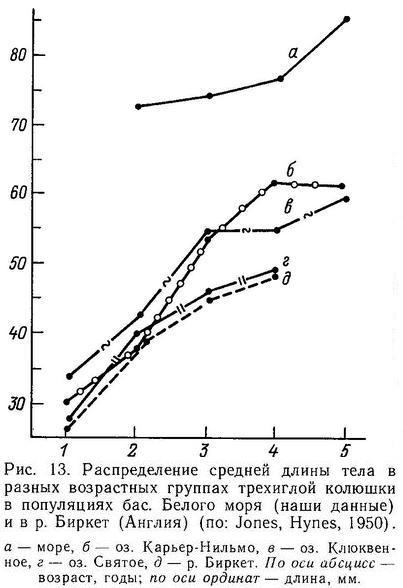
Интересен вопрос о различиях в темпе роста между морфами trachurus и leiurus. Хаген (Hagen, 1967) в р. Литтл Кэмпбелл (Британская Колумбия, Канада), где обитает жилая leiurus и туда же на нерест приходит морская trachurus, нашел, что trachurus растет быстрее, чем leiurus. Это может быть обусловлено двумя причинами: 1) генетическими различиями по темпу роста (в этой реке обе формы генетически изолированы) и 2) лучшей обеспеченностью пищей trachurus в море в нагульный период. В Западной Европе в смешанных популяциях вдоль побережья Северного моря морфы trachurus, semiarmatus и leiurus не различаются в размерах (Heuts, 1947а; Münzing, 1959; Van Mullem, Van der Vlugt, 1964). Популяции leiurus в двух озерах Аляски Бэйр и Карлук (Greenbank, Nelson, 1959) обнаруживают сходный темп роста рыб с особями trachurus и semiarmatus из пресных озер Квебека (Coad, Power, 1973b). В пресном оз. Клюквенное (бассейн Кандалакшского залива Белого моря, о. Великий) обитает триморфная популяция (trachurus + semiarmatus + leiurus). Сравнение размеров trachurus и leiurus в разных годовых классах показало сходство в средних размерах обеих морф по каждому годовому классу при незначительном превосходстве длин trachurus в младших годовых классах (годовики, двух- и трехгодовики) (Зюганов, 1980). Похоже, что превосходство в размерах морских trachurus над пресноводными leiurus обусловливается, скорее, более благоприятными условиями нагула в море, хотя для окончательного ответа на этот вопрос необходимы эксперименты в контролируемых условиях.
2.3. ПИТАНИЕ
Колюшковые рыбы являются эврифагами, питающимися разнообразными кормами. Кроме того, несмотря на их малые размеры, их можно, скорее, назвать хищными рыбами, чем мирными, поскольку колюшки охотятся за движущимися пищевыми объектами, ориентируясь главным образом с помощью зрения. Вылупившиеся предличинки едят инфузорий, а затем мелких ракообразных по мере роста. Лучше других питание изучено у трехиглой и девятииглой колюшек.
Большинство кратких сообщений о питании Gasterosteus aculeatus, разбросанных в многочисленных работах, дает лишь качественный анализ. Однако есть несколько работ, где даются количественный анализ и сезонная изменчивость питания (Hynes, 1950; Абдель-Малек, 1963, 1968; Walkey, 1967). Спектр питания колюшек морфы leiurus в р. Биркет (табл. 5) очень широк: ракообразные (Cladocera, Copepoda, Ostracoda), членистоногие (личинки Chironomidae, Trichoptera, Coleoptera), моллюски, олигохеты, личинки и икра рыб, диатомовые водоросли. У этих колюшек обнаружены сезонные изменения в питании. Так, Cladocera, Copepoda и личинки Chironomidae составляют значительную долю в летнем рационе. Зимой же большую роль в рационе начинают играть моллюски и высшие растения. Пик питания диатомовыми водорослями приходится на сентябрь. Доля пустых желудков увеличивается в зимнее время, а в начале нереста интенсивность питания увеличивалась. Cladocera, Copepoda и личинки Chironomidae играли самую важную роль в питании колюшек leiurus из озер Северо-Восточной Англии (Walkey, 1967), озер северо-запада Англии (Hynes, 1950) и о. Кадьяк (Аляска, США) (Greenbank, Nelson, 1959).
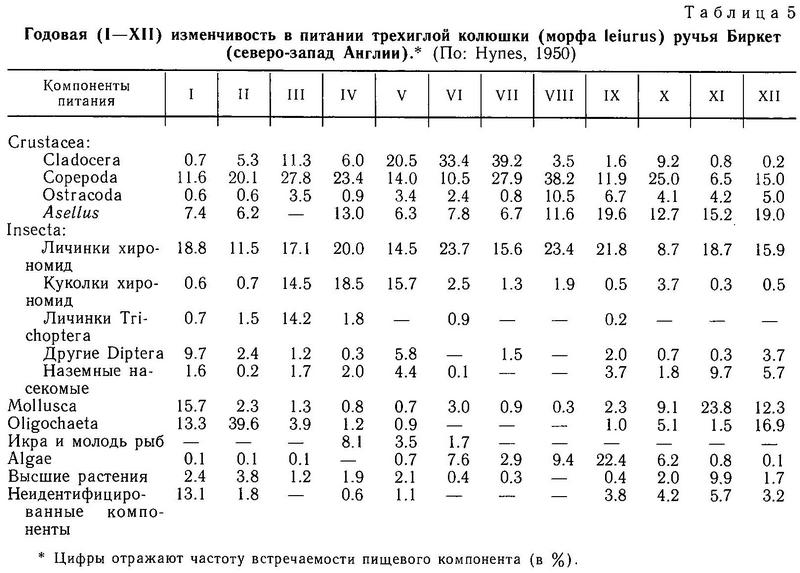
Саундерс (Saunders, 1914) отмечал, что крупные колюшки из прудов близ Кембриджа (Англия) круглый год питались в основном диатомовыми Nitzschia sygmoidea, но более мелкие рыбы питались личинками насекомых и мелкими ракообразными.
Для морских колюшек trachurus на побережье Дании, собранных среди зарослей зостеры, было отмечено питание Gammaridae, Amphipoda, Isopoda (Isotea faera), Amphipoda (Corophium), личинками насекомых и насекомыми, упавшими в воду (Blegwad, 1917). Абдель-Малек (1968) исследовал пищевой спектр морской формы trachurus из Кандалакшского залива Белого моря. Было обнаружено, что предличинки начинали питаться преимущественно Copepoda (nauplii), но по мере роста молодь колюшек переходила на копеподитные стадии копепод, в основном Harpacticus unermis. Уже при длине рыб 15 мм и выше колюшки обладали полным спектром питания, характерным для половозрелых стадий: высшие ракообразные, Copepoda, личинки Chironomidae, Annelida. По моим данным, в пресноводном изолированном водоеме резко олиготрофного типа — карьере «Нильмо», расположенном в том же районе, где работал Абдель-Малек (1968), колюшки жилой формы trachurus питались Polychaeta, Crustacea (Cladocera: Bosmina, Chydorus, Alona, Copepoda: Cyclops, Harpacticus), личинками Chironomidae, воздушными насекомыми — Thysanoptera, Hymenoptera, Coleoptera, Lepidoptera, собственными мальками, Diatomea.
Основной объект питания — упавшие в воду воздушные насекомые (Thysanoptera, Diptera, Coleoptera, Hymenoptera, Lepidoptera) 48.6 % по массе, планктон Cladocera и Copepoda 17.3, личинки стрекоз Aeshna grandis 9.7, мальки Gasterosteus aculeatus 11.5 %.
Мухомедияров (1966) указывает, что морская форма трехиглой колюшки Белого моря в весенне-летний период питается в основном личинками хирономид, планктонными рачками (Copepoda и Cladocera) и молодью рыб (в том числе собственной). Кроме того, незначительную часть пищевого спектра у нее составляли икра ивановской сельди, ракушечные рачки Ostracoda и воздушные насекомые.
Пресноводная жилая колюшка из Каунасского водохранилища, по данным Бубинас (1979), весной питалась в основном личинками Chironomidae и воздушными насекомыми, летом — личинками Chironomidae, Gammaridae, Cladocera и Copepoda, а осенью основу пищи составляли Cladocera.
В пресном оз. Дальнее (Камчатка) трехиглая колюшка является планктофагом и факультативным бентофагом (Марковцев, 1972). Пищевой спектр колюшки весьма широк: насекомые, ракообразные, моллюски и в период нереста собственная икра. Среди насекомых преобладали личинки и куколки Chironomidae. В зимние месяцы в желудках колюшки численно преобладали планктонные ракообразные, причем циклопы составляли 55—90 % от общего количества рачков. В желудках колюшки на литорали озера резко преобладали бентосные организмы, личинки Chironomidae, Gammarus и икра колюшки.
Таким образом, пищевой спектр трехиглой колюшки из разных районов Европы, Азии и Сев. Америки довольно широк, и преобладание в спектре тех или иных пищевых компонентов зависит от конкретных пищевых ресурсов в каждом водоеме. Такой широкий спектр питания трехиглой колюшки приводит к неизбежной конкуренции с другими видами рыб, и прежде всего с девятииглой колюшкой Pungitius pungitius.
В р. Биркет (Англия) Gasterosteus aculeatus и Pungitius pungitius имеют сходные спектры питания и даже сходные количественные соотношения пищевых объектов по частоте встречаемости и по весовому выражению, за исключением того, что Pungitius pungitius меньше питается водорослями. Однако в сезон размножения Gasterosteus aculeatus предпочитает более открытые места, а Pungitius pungitius уходит в зону густой вегетации водных растений в литоральной зоне водоема, что уменьшает конкуренцию между ними.
В оз. Матамек (провинция Квебек, Канада), где Pungitius pungitius и Gasterosteus aculeatus также симпатричны, Pungitius pungitius питается кладоцерами и хирономидами в литоральной зоне, a Gasterosteus aculeatus — пелагическим зоопланктоном (Coad, Power, 1973d). Личинки хирономид, кладоцеры, копеподы и другие виды зоопланктона формируют летний спектр питания Pungitius pungitius из оз. Икроавик (Аляска, США) (Cameron et al., 1973). Напротив, Pungitius pungitius из оз. Верхнее (Великие Озера, США) питается главным образом амфиподой Pontoporea affinis и мизидой Mysis relicta, а кладоцеры и личинки хирономид составляют незначительную долю в ее питании (Griswold, Smith, 1973).
Поскольку ареал трехиглой колюшки в значительной степени перекрывается с ареалами хозяйственно ценных видов лососевых рыб, особый интерес представляет рассмотрение пищевой конкуренции колюшки с лососевыми рыбами. Пищевая конкуренция Gasterosteus aculeatus и молоди Oncorhynchus nerka имеет место в озерах Аляски (США) и Камчатки, где оба вида многочисленны. Молодь нерки обычно проводит 1 год в озерах перед миграцией в море. В озерах бассейна р. Вуд (Западная Аляска) колюшки и молодь нерки имеют сходные спектры питания в пелагиали и литоральной части озер (Rogers, 1968). На литорали оба вида питаются мелкими ракообразными (кладоцера, копепода) и личинками хирономид. Но между обоими видами есть различия в относительном значении для них разных пищевых объектов. Так, колюшка в большей мере добывает корм со дна, а нерка — с поверхности воды. Колюшки в большей мере потребляют личинок хирономид, моллюсков, одноклеточных водорослей и собственную икру, тогда как молодь нерки — насекомых и коллембол, падающих в воду. В пелагиали оба вида потребляют зоопланктон, но нерка в основном поедает Dafnia и Bosmina, а колюшки — копепод. Пищевой спектр нерки шире спектра колюшки. Таким образом, налицо количественное смещение спектров питания, уменьшающее конкуренцию. Тем не менее Роджерс (Rogers, 1968) полагает, что при недостатке пищевых ресурсов конкуренция между этими видами может обостриться.
В оз. Дальнем (Камчатка) также симпатрично обитают колюшки и молодь нерки. Пищевой спектр колюшки приводился выше в этом разделе, и он достаточно широк, а пищевой спектр нерки в оз. Дальнем значительно уже, чем у колюшки (Марковцев, 1972). В спектр нерки входят ракообразные (Dafnia, Cyclops, Neutrodiaptomus) и насекомые (личинки и куколки хирономид и воздушные насекомые). Степень сходства пищевых спектров обоих видов имеет сезонные колебания. В зимние месяцы коэффициенты сходства (СП-коэффициенты) нарастают с 28 до 90 % в апреле, когда спектры обоих видов практически совпадают. В летние месяцы коэффициенты в целом снижаются и колеблются в зависимости от биотопа. Если в пелагиали они остаются высокими (более 80 %), то на литорали они не превышают 13 %. Основываясь на этих данных, Марковцев (1972) приходит к выводу, что между молодью нерки и колюшки в годы их высокой численности в пелагиали озера должны складываться весьма напряженные конкурентные взаимоотношения.
Расчеты, проведенные Крохиным (1970) для колюшки оз. Дальнее, показали, что колюшка в пик своей численности потребляет 1/3 от общего потребления пелагических ракообразных рыбами-планктофагами, а во время депрессии своей численности — 5—10 %. Численность колюшки по этим расчетам колеблется от 1 до 6 млн особей, или в весовом выражении 2—12 т. Численность же молоди нерки в весовом выражении колеблется от 15 до 30 т. Крохин (1970) подчеркивал, что это только грубые оценки. Однако, несмотря на это, влияние колюшки на биоценоз оз. Дальнее представляется впечатляющим.
Не менее впечатляюще влияние колюшки на ихтиоценозы Балтийского моря. Так, по данным Костричкиной (1970), популяция колюшки в Рижском заливе выедает за год около 200 тыс. т планктона и нектобентоса, а вблизи нерестилищ колюшка выедает значительное количество икры и личинок других видов рыб. В Куршском заливе колюшка потребляет только в июне около 150 т зоопланктона (Носкова, 1975) и уничтожает на нерестилищах щуки около 40 % ее икры. По мнению Мухомедиярова (1966), это является одним из факторов, влияющих на численность сельди в Белом море.
Наиболее важными хищниками колюшковых являются хищные рыбы. Так, в Европе главными хищниками колюшковых являются щука (Esox lucius), окунь (Perca fluviatilus), семга (Salmo salar), голец (Salvelinus alpinus), голавль (Leuciscus cephalus), кумжа (Salmo trutta), сом (Silurus glanis), судак (Lucioperca lucioperca), налим (Lota lota), угорь (Anguilla anguilla), треска (Gadus morhua) (Фортунатова, 1959; Гофман-Кадошников и др., 1963; Gross, 1978а). В Сев. Америке, по данным Хагена и Гильбертсона (Hagen, Gilbertson, 1972), колюшкой питаются щука, индейская рыба Ptychoheilus oregonensis, лососевые рода Salmo, Salvelinus, Novumbra hubbsi.
На Дальнем Востоке СССР гольцы рода Salvelinus, микижа Salmo mykiss наряду со щукой и окунем являются серьезными хищниками по отношению к трехиглой и девятииглой колюшкам рода Pungitius (Карпов и др., 1969; Кохменко, 1972; Гриценко, Чуриков, 1977).
Но, пожалуй, как это ни странно, одними из самых существнных хищников, ограничивающих численность колюшковых рыб, являются сами колюшки. «Если б колюшки не истребляли и своей икры, то, конечно, они в скором времени перевели бы всех рыб», — писал Сабанеев (1982, с. 102). Действительно, во время сезона размножения икру и личинок собственного вида поедают самки, самцы, еще не захватившие территорию для гнезда, и даже территориальные (гнездующие) самцы пытаются «воровать» икру друг у друга (Hynes, 1950; Black, Wootton, 1970). Так, в оз. Вопато (штат Вашингтон, США) около 50 % колюшек обоих полов в нерестовый сезон имели в своих желудках икру собственного вида (Semler, 1971). Несомненно, что поедание собственной икры и молоди является одним из факторов саморегуляции численности популяции.
Противохищнические адаптации. Такие факторы противохищнических адаптаций, как число, длина и крепость спинных и брюшных колючек, механизм фиксации в выпрямленном положении колючек, число боковых пластин, размер колюшек и окраска, рассмотрены ранее в соответствующих разделах (1.1, 1.4, 1.6, 1.7). Все эти «морфологические» адаптации лучше всего реализованы у трехиглой колюшки, и экспериментально доказано, что при наличии выбора в аквариуме хищники (окунь и щука) предпочитают охотиться на гольяна (Phoxinus phoxinus), красноперку (Scardinius erythrophtalmus), карася (Carassius carassius) и в последнюю очередь на девятииглую колюшку Pungitius pungitius, избегая Gasterosteus aculeatus (Hoogland et al., 1957). Однако если колюшкам отрезали колючки, то хищники выедали их так же, как и остальных рыб. Колючки для Pungitius pungitius менее надежная защита, чем для Gasterosteus, но все же девятииглая колюшка в эксперименте меньше выедалась, чем рыба с мягкими плавниками.
2.5. ПАРАЗИТЫ
Колюшковые являются промежуточными и окончательными хозяевами довольно большого числа видов экто- и эндопаразитов. Больше всего паразитов обнаружено у Gasterosteus aculeatus. Так, Вуттон (Wootton, 1976), обобщив данные ряда авторов-паразитологов, приводит в своей сводке перечень, включающий 94 вида паразитов, принадлежащих к 7 типам (Fungi, Protozoa, Platyhelmintes, Aschelmintes, Annelida, Arthropoda, Mollusca).
Только на территории СССР у трехиглой колюшки насчитывается 50 видов паразитов, относящихся к 6 типам. Ниже приведен список паразитов трехиглой колюшки Gasterosteus aculeatus для водоемов СССР (по: Определитель, 1962, 1975). Упомянутые определители не приводят для СССР седьмой тип паразитов — Fungi (Saprolegtiia spp.), фигурирующий в списке Вуттона (Wootton, 1976), однако, по моим наблюдениям, трехиглая колюшка и на территории СССР, когда находится в ослабленном состоянии (например, в аквариуме в скученном состоянии), поражается сапролегнией. Ниже приводится список паразитов трехиглой колюшки (по: Определитель, 1962).

Интересно, что в пределах СССР, судя по Определителю (1962), у Gasterosteus aculeatus и Pungitius pungitius 29 видов общих паразитов, что составляет примерно 60 % перекрывания между двумя видами колюшковых.
Баниной и Исаковым (1972) проанализированы закономерности становления паразитофауны трехиглой и девятииглой колюшек дельты р. Невы. Авторы отмечают сходство их паразитофауны как по видовому составу, так и по срокам заражения тем или иным видом паразита. Отличительная черта паразитофауны колюшек — необычайное обилие эктопаразитических инфузорий не только у молоди, но и у взрослых рыб. Это, по мнению авторов, объясняется малыми размерами рыб, отсутствием чешуи, что облегчает прикрепление эктопаразитических простейших. Гнездовое выращивание молоди колюшек самцом приводит к раннему заражению личинок колюшек триходинами и апиозомами от самца. В результате у колюшек молодь 3—4-дневного возраста (в котором у других видов рыб начинают проявляться только первые паразиты) оказывается сильно зараженной. Из других факторов, способствующих формированию богатой паразитофауны колюшек, авторы называют растянутость нереста (молодь от позднего нереста имеет возможность заражаться не только от взрослых рыб, но и от молоди более старшего возраста), стадный образ жизни, обитание в водоемах, богатых растительностью и содержащих повышенное количество органических веществ и бактерий. К факторам, перечисленным этими авторами, можно добавить еще и широкий спектр питания колюшковых. Несомненно, он способствует обогащению паразитофауны эндопаразитов колюшковых.
Баниной (1973) было сделано интересное описание своеобразного «биоценоза» из эктопаразитов на теле трехиглой колюшки р. Невы. Этот «биоценоз» включал в себя как истинных паразитов, питающихся за счет хозяина (триходин), так и бактериядных форм (апизомы, эпистилиса), а также хищников (эрастофрия). Колюшка в этом отношении является исключительным объектом среди всех других пресноводных рыб (Банина, 1973). Малые размеры колюшек облегчают их проникновение в самые небольшие водоемы. Колюшки, населяющие водоподающую систему рыбозаводов и пруды рыбхозов, могут быть прямым источником паразитарных заболеваний молоди рыб, выращиваемой в прудах (Банина, Исаков, 1972).
Девятииглая и трехиглая колюшки, как оказалось, могут играть роль в эпидемиологии дифиллоботриза, распространяя личинок широкого лентеца (Diphyllobotrium latum, Diphyllobotrium norvegicum) среди хищных рыб (щука, налим, окунь). В очагах массового скопления колюшки могут играть существенную роль. Из дифиллоботриид, паразитирующих у человека, колюшки легко заражаются лентецами: широким (Diphyllobotrium latum), чаечным (Diphyllobotrium dentdriticum) и норвежским (Diphyllobotrium norvegicum), причем экстенсивность инвазии в Карелии достигает 70 %. В то же время колюшки не представляют опасности для непосредственного заражения человека, так как не используются в пищу (Гофман-Кадошников и др., 1963).
Лучше других исследовано влияние на экологию трехиглой колюшки эндопаразита Schistocephalus solidus (сем. Ligulidae, класс Cestoda). Колюшка для этого паразита является промежуточным хозяином (Шульц, Гвоздев, 1972). В половозрелой фазе Schistocephalus solidus паразитирует в кишечнике многих рыбоядных птиц: крохалей, гагар, чаек и других. Сброшенные в воду с фекалиями птиц яйца паразита развиваются при температуре 10—18 °С за 17—20 дней. Вышедшие из яиц корацидии живут не более 2 сут. Первым промежуточным хозяином для паразита являются циклопы, в полости тела которых через 1—2 недели развиваются процеркоиды, способные заражать второго промежуточного хозяина — трехиглую колюшку. Близкий вид, Schistocephalus pungitii, поражает девятииглую колюшку, а экспериментальное заражение девятииглой колюшки Schistocephalus solidus приводило к гибели паразита из-за сильной иммунной реакции хозяина (Огг, 1968). Развитие плероцеркоида в полости тела рыбы до инвазионного состояния продолжается около 6 мес, в то время как его развитие в кишечнике окончательного хозяина до появления в матках паразита яиц завершается всего за 30 ч. Продолжительность жизни шистоцефалов в организме птицы не превышает 4 сут. Итак, жизненный цикл этого паразита протекает с участием 3 хозяев — триксенный тип развития (Шульц, Гвоздев, 1972).
Обычно величину инвазии паразита определяют двумя показателями. Экстенсивность инвазии — доля рыб в популяции, имеющих паразитов, и интенсивность инвазии — количество паразитов на одну рыбу. В ряде популяций трехиглой колюшки оба показателя достигают впечатляющих величин. Так, по моим данным, в небольшом пруду «Карьер-Нильмо» (побережье Кандалакшского залива Белого моря) 78 % рыб были поражены этим паразитом, интенсивность инвазии колебалась от 1 до 6 цестод на рыбу, отношение массы паразита к массе рыбы составляло в среднем 1 : 2, но иногда достигало значения 1.25 : 1, т. е. масса паразита превышала массу рыбы.
В ряде прудовых популяций Gasterosteus aculeatus на юго-западе Англии экстенсивность инвазии Schistocephalus solidus достигает 90%, а интенсивность — до 106 мелких плероцеркоидов на рыбу (Arme, Oven, 1967; Pennyquick, 1971).
Паразит сильно уменьшает упитанность рыбы, ее весовой и линейный рост, задерживает развитие гонад у самок, вызывает повышенное потребление кислорода у пораженных рыб (Arme, Oven, 1967; Lester, 1971). Сдавливание плавательного пузыря и искажение формы тела рыб из-за наличия паразита затрудняют плавание колюшек (паразитированные рыбы держатся в приповерхностном слое воды) и делают рыб легко доступными для птиц, способствуя этим завершению жизненного цикла (Arme, Oven, 1967). Паразитированные самцы не могут закончить постройку гнезд, а зараженные самки с трудом отвечают на ухаживание самцов и не могут проникнуть в гнездо, не разрушив его при этом (Arme, Oven, 1967).
Таким образом, Schistocephalus solidus является мощным фактором, регулирующим численность колюшек, вызывая прямую смертность рыб и разнообразные сублетальные эффекты на популяцию Gasterosteus aculeatus.
Интересно отметить высокую скорость нарастания экстенсивности инвазии Schistocephalus solidus во вновь образованной пресноводной популяции. Так, по моим данным, при интродукции морской формы Gasterosteus aculeatus (не имеющей этого паразита) в пресноводный изолированный водоем — затопленный карьер «Черный» на побережье губы Чупа (Кандалакшский залив Белого моря) — уже на следующий год после выпуска основателей в этот водоем 6 % колюшек — потомков первого поколения — было поражено паразитом. Через 5 лет уже 45 % рыб в популяции, было инвазировано шистоцефалом. В условиях ограниченного размера водоема (10 х 40 м, глубина 12 м) и, следовательно, лимитированной кормовой базы высокая экстенсивность инвазии паразитом явилась фактором, эффективно ограничивающим плотность популяции Gasterosteus aculeatus.
Летальные и сублетальные эффекты инвазии колюшек другими видами паразитов привлекли меньшее внимание паразитологов. Треллфалл (Threllfall, 1968) описал массовую гибель колюшек из пресноводного пруда на о. Ньюфаундленд (Канада), пораженных Schistocephalus solidus и эктопаразитом карповой вошью, Argulus canadiensis. Автор полагает, что гибель была вызвана стрессом вследствие двойного влияния обоих паразитов. По нашим личным наблюдениям, инвазия карповой вошью, Argulus foliaceus (широко распространенной в бассейне р. Невы), вызывает 50%-ную гибель колюшек в течение суток в 80-литровом аквариуме при помещении туда 20 экз. трехиглой колюшки (в среднем на каждой рыбе было 7—8 паразитов). Ichthyophthirius multifiliis (Ciliata, Protozoa) — эктопаразит кожи — вызвал массовую гибель Gasterosteus aculeatus в одном из пресных озер Шотландии (Великобритания). В 1958 г. там погибли все сеголетки и большая часть годовиков и двухгодовиков (Hopkins, 1959). Эктопаразит Gyrodactilus alexanderi (Monogenea, Plathyhelminthes), паразитирующий на коже рыбы, может вызвать гибель колюшки при интенсивности инвазии 300—400 паразитов на рыбу. Однако это происходит редко, так как колюшки имеют защитную реакцию в виде «сбрасывания» слизистого слоя с кожи и тем самым избавляются от эктопаразита. Более того, сброшенные паразиты поедаются колюшками (Lester, 1972). Вредные эффекты остальных паразитов на колюшек менее очевидны. Возможно, крупные цисты Glugea anomala (Sporozoa, Protozoa) — эндопаразиты в соединительной ткани трехиглой и девятииглой колюшки — мешают плаванию рыб, а метацеркарии ряда видов Diplostomum (Diplostomum spataceum, Diplostomum gasterostei, Diplostomum scudderi — Digenea, Plathyhelmintes) — эндопаразиты глаз Gasterosteus aculeatus и Pungitius pungitius — затрудняют зрение рыб, облегчая выедание их птицами — окончательными хозяевами (Arme, Oven, 1967; Lester, 1974).
Наиболее впечатляюще выглядят анадромные нерестовые миграции у трехиглой колюшки. Так, Ригэн (Regan, 1911) описывал миграцию Gasterosteus aculeatus в реки восточного побережья Англии как «движение огромных колонн». Количество рыб было так велико, что местные фермеры могли наловить в день до 3 т колюшки каждый. Мухомедияров (1966) так описывал нерестовую миграцию трехиглой колюшки в Белом море: «Весной колюшка в огромных количествах подходит к берегам и поедает все, что ей доступно, особенно икру на нерестилищах других рыб... Когда температура воды в верхних слоях достигнет 6—8 °С, у берегов появляются первые косяки... эти подходы несомненно нерестовые. Неполовозрелых особей не бывает. Колюшка заходит в ручьи и реки и поднимается по ним вверх. Иногда по рекам она проходит в проточные озера и здесь нерестует, частично оставаясь на зимовку. Отнерестовавшаяся колюшка, и главным образом выклюнувшаяся молодь, достигнув длины 20—25 мм, в большом количестве скатывается в море» (с. 459). На Камчатке мигрирующая тихоокеанская колюшка заходит в р. Камчатку вверх на расстояние до 200 км от устья (В. А. Максимов, личн. сообщ.).
Между тем ранее ни отечественными авторами (за исключением Гомелюка (1978), описавшего нерест колюшки в солоноватой воде — 18 ‰), ни американскими и европейскими зарубежными авторами не отмечалось, что трехиглая колюшка нерестится в морской воде в прибрежной зоне (Munzing, 1959; Мухомедияров, 1966; Narver, 1969; Hagen, Gilbertson, 1972, и мн. др.). Однако в Кандалакшском заливе Белого моря мне приходилось наблюдать нерест колюшки в полносоленой морской воде — 26—28 ‰ в литоральной зоне морских заливов и литоральных лужах, остающихся после отлива (Кислая губа близ Беломорской биостанции МГУ, бухта Лобаниха на о. Великом, Бабье море близ о. Великий). В этих местах в 1975—1979 гг. наблюдались плотные и многочисленные нерестовые колонии, исчислявшиеся десятками тысяч особей, что исключает случайность этого явления (нереста в полносоленой морской воде) (Зюганов, 1980). Таким образом, можно говорить о морской форме колюшки, живущей и размножающейся в море. В Черном море (Севастопольская бухта, Одесский залив), на побережье Японского моря (Приморский край), окрестности морской базы ДВНЦ «Витязь», на побережье Охотского моря (Сахалин, о. Итуруп Курильской гряды) я не обнаружил нереста трехиглой колюшки в морской воде. Во всех перечисленных районах колюшка нерестилась в пресных ручьях, реках и озерах. Можно предположить, что береговая линия моря в этих районах была неблагоприятна для нереста колюшки из-за отсутствия растительности (песчаный и мелкогалечный грунт) и сильного прибоя. Однако в солоноватой (соленость 18 ‰) лагуне Хангузе (близ г. Оха, Северный Сахалин) трехиглая колюшка вместе с Pungitius pungitius нерестилась на мелководье в зоне водной растительности. Чрезвычайно изрезанная береговая линия Кандалакшского залива Белого моря с обилием заросших водной растительностью мелководных заливов и многочисленных литоральных луж с илистым грунтом создает благоприятные условия для нереста трехиглой колюшки, поэтому в данном районе и наблюдается «необычная» на первый взгляд картина — нерест колюшки в морской воде. Однако можно предположить, что любая популяция проходной формы трехиглой колюшки в любой части ареала способна при необходимости нереститься в морских условиях. Подтверждением этому служит тот факт, что сперматозоиды самцов проходной формы, выловленных из пресной воды на Черном, Японском, Балтийском и Белом морях, активировались в морской воде соленостью 35 ‰ (Зюганов, 1983в). Проведенные эксперименты по солеустойчивости икры и спермиев беломорских колюшек показали, что дифференциация беломорской колюшки на «морскую» и «проходную» генетически не детерминирована. Различия в физиологических характеристиках спермиев между морскими и проходными самцами носят фенотипический характер. Очевидно, вся беломорская популяция способна размножаться как в пресной, так и в морской воде, и разделение на «морскую» и «проходную» группировки весьма условно, так как спермии всех морских самцов способны переключаться на активацию в пресной воде, а спермии проходных самцов потенциально сохраняют жизнеспособность в морской воде весь сезон размножения (Соин, Зюганов, 1979; Зюганов, 1980).
Тем не менее сперматозоиды жилой пресноводной формы трехиглой колюшки в бассейне Белого моря (морфы leiurus) потеряли жизнеспособность в морской воде, что свидетельствует о глубоких генетических различиях между морской и жилой группировками Gasterosteus aculeatus на Белом море (Зюганов, 1980).
2.7. ОСМОТИЧЕСКАЯ РЕГУЛЯЦИЯ
Из всех видов колюшковых самой совершенной осморегуляцией обладает Gasterosteus aculeatus, которая, по мнению Хлебовича (1968, с. 1591), достойна занимать одно из первых мест в списке эвригалинных рыб мировой фауны. Из других видов рыб мировой фауны по степени эвригалинности с колюшкой, пожалуй, могут сравниться лишь представители рода Fundulus (Fieldmeth, Waggoner, 1972), которые, как и трехиглая колюшка, могут не только жить, но и нереститься в пресной и морской воде высокой солености. Популяции трехиглой колюшки обитают как в слабоминерализованной воде крайне олиготрофных пресных озер (Hagen, Gilbertson, 1972), так и в супергалинных водах, где соленость достигает 80—100 ‰ (соленое оз. Течиргиоль, Румыния) (Bacesku, Mayer, 1956).
Поскольку среди всех видов колюшковых наиболее широким диапазоном солеустойчивости обладает Gasterosteus aculeatus, то именно на этом виде были выполнены исследования механизмов водно-солевого обмена и осмотической регуляции (Gueylard, 1924; Heuts, 1942, 1943, 1946, 1947, 1949; Koch, Heuts, 1943; Mullins, 1950; Baggerman, 1957; Fridberg, Olsson, 1959). He только морская, но и жилая пресноводная форма trachurus трехиглой колюшки толерантна к высокой солености, хотя и в меньшей степени, чем морская (Heuts, 1946, 1947а, 1947b).
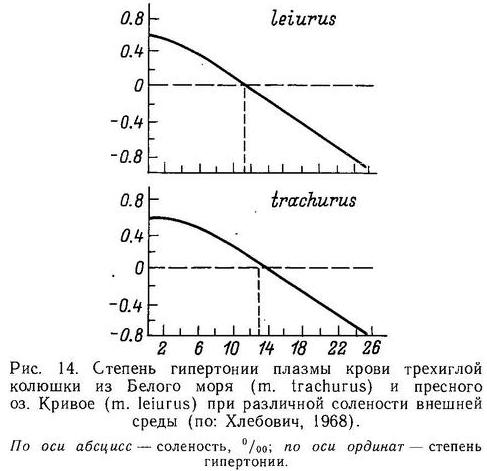
Эвригалинность трехиглой колюшки детерминируется осморегуляторным механизмом двустороннего действия, обеспечивающим гиперосмотическую регуляцию при жизни в пресной воде и гипоосмотическую регуляцию в море. Хлебовичем (1968) было показано, что у морской формы trachurus Белого моря относительное осмотическое равновесие между внешней средой и плазмой крови устанавливается при солености морской воды 13 ‰, а у жилой формы leiurus из оз. Кривое — при 11 ‰ (рис. 14). Таким образом, показатели осмотического давления внутренней среды пресноводной и морской колюшек различаются на 2 ‰. Интересно, что положение пиков максимальной продолжительности движения сперматозоидов (в воде разной солености) у обеих форм колюшки также различалось и почти совпадало с показателями осмотического давления внутренней среды организмов жилой формы leiurus и морской trachurus (Зюганов, Хлебович, 1979) (рис. 15). Максимальная продолжительность движения сперматозоидов свидетельствует о том, что при данной солености воды имеется осмотическое равновесие между осмотическим давлением цитоплазмы спермия и окружающей средой (Хлебович, 1974). Следовательно, при исследовании одного и того же материала двумя разными методами выявлены сходные различия в осмотических давлениях крови и цитоплазмы спермиев двух группировок колюшки.
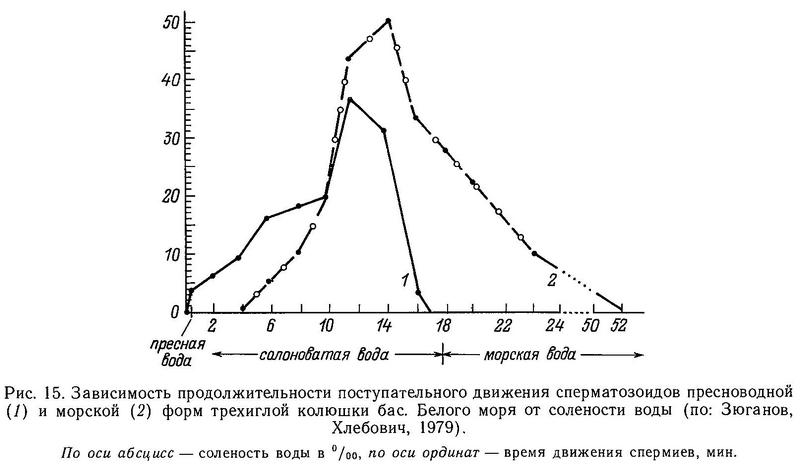
Представленные данные говорят о том, что при солености ниже 11—13‰ колюшки осуществляют гиперосмотическую регуляцию, а при солености выше 11—13 ‰ — гипоосмотическую.
При перемещении в эксперименте морской колюшки морф trachurus и semiarmatus из пресной воды в морскую они обнаруживали увеличение потребления кислорода, что свидетельствует об активных энерготратах для поддержания осмотических и ионных характеристик жидкостей тела. Напротив, жилая leiurus не обнаруживала увеличения потребления кислорода в аналогичной ситуации. В то же время у leiurus наблюдалось увеличение массы «пула свободных аминокислот», что помогло рыбам пассивно приспособиться к увеличению осмотического давления внешней среды без затрат энергии (Gutz, 1970). Этот механизм пассивного процесса осморегуляции работает только при относительно высоких температурах (20 °С) и неэффективен при низких, 2.5—3.5 °С, — leiurus не выживали в холодной морской воде. Trachurus и semiarmatus, использующие активный процесс осморегуляции в морской воде, выдерживали высокую соленость даже при низких температурах. Так, в опыте Гуте (Gutz, 1970) использовал по 10 особей trachurus, leiurus и semiarmatus. Температуру морской воды соленостью 35 ‰ понижали в течение 7 дней с 20 до 1 °С. Все особи semiarmatus и trachurus выжили без потери своей типичной серебристой окраски и нормального поведения. Среди leiurus 7 особей погибали при температуре 2.5—3.5 °С, а оставшиеся 3 особи окрасились в черный цвет, вяло плавали. При наличии выбора: холодная пресная — холодная морская вода leiurus предпочитали пресную. Эти данные Гутса (Gutz, 1970) имеют принципиальное значение для понимания генетической дифференциации и распространения по ареалу разных форм трехиглой колюшки. Вероятно, морфологические варианты по числу костных боковых пластин генетически связаны с разными механизмами осморегуляции. При таком допущении становится понятным, почему leiurus ограничены лишь пресными водами на всем огромном ареале Gasterosteus aculeatus. Более подробно этот вопрос будет рассмотрен в разделе 4.5.
Несмотря на толерантность к широкому диапазону солености, leiurus даже в умеренных температурах имеет более узкие пределы, чем trachurus. Интересно, что даже внутри одной популяции leiurus с большим числом пластин более солеустойчивы (Heuts, 1947b).
По данным Коха и Хойтса (Koch, Heuts, 1943), полученным на бельгийских колюшках в нерестовый весенний сезон, и trachurus, и leiurus сужают свой диапазон солеустойчивости. Например, leiurus, которые вне нереста легко переносили воду соленостью 45 ‰, при созревании гибли даже в воде 35 ‰. У trachurus было отмечено сходное падение верхнего предела солеустойчивости: они лучше выживали в воде низкой солености. Осенью же мигрирующие trachurus, наоборот, начинали предпочитать морскую воду (Baggerman, 1957; Lam, Hoar, 1967). Исследования гормонального контроля осморегуляции выявили важную роль гипофиза и щитовидной железы в регулировании миграционного цикла проходных trachurus (Koch, Heuts, 1943; Baggerman, 1957; Gutz, 1970).
Интересно отметить, что осморегуляторный аппарат проходной трехиглой колюшки настолько хорошо «справляется с обязанностями», что мигрирующие в пресную воду колюшки не прекращают питания, как это делают проходные рыбы из других систематических групп (например, лососевые) (Никольский, 1974, с. 240).
Не менее интересным является вопрос о диапазоне соленостной толерантности и осморегуляции ранних стадий онтогенеза колюшковых. И здесь данные в основном были получены на трехиглой колюшке. Так, Хойтс (Heuts, 1946, 1947b) исследовал выживаемость икры в воде разной солености у проходной trachurus, нерестившейся в низовьях одной из рек Бельгии, и жилой leiurus, обитающей в верховьях этой реки; пространственная зона контакта между ними была ограничена небольшим участком реки. Хойтс обнаружил, что в эксперименте выживаемость икры leiurus х leiurus была максимальной в пресной и слабосолоноватой (до 6 ‰) воде, в то время как выживаемость икры trachurus х trachurus была максимальной при солености 17 ‰. Гибридная икра от скрещивания trachurus х leiurus имела оптимум при солености в зависимости от того, самка какой формы использовалась при скрещивании. Если самка была trachurus, то гибридная икра обнаруживала оптимум выживаемости, равный оптимуму икры от скрещивания trachurus х trachurus. Если самка была leiurus, то оптимум соответствовал оптимуму икры leiurus х leiurus. Как видим, здесь налицо материнский эффект. Хойтс (Heuts, 1947b) предполагает, что такая физиологическая характеристика гибридной икры является одним из факторов, лимитирующих поток генов между двумя популяциями.
Мак-Фейл (McPhail, 1969) исследовал солеустойчивость икры пресноводной формы leiurus (меланистической формы) в Британской Колумбии (Канада); По его данным, икра гибнет в морской воде соленостью 28.5 ‰ на стадии гаструляции; кроме того, взрослые особи leiurus также гибли в морской воде через 1—4 ч после перемещения их туда.
Поданным Линдсея (Lindsey, 1962а), икра колюшки морфы leiurus показывала низкую выживаемость в солоноватой воде свыше 16 ‰.
В то же время икра и проходной формы trachurus, и жилой leiurus из бассейна Белого моря проходит нормальное эмбриональное развитие и в морской и в пресной воде. Процент вылупления в морской (26—28 ‰) и пресной воде при температуре 11—16 °С во всех вариантах опытов был высоким и колебался между 91 и 98 %. Более того, икра обеих форм также успешно развивалась при режиме ежесуточной смены воды в лотке с морской на пресную (Соин, Зюганов, 1979; Зюганов, 1980).
Существенные различия между всеми вышеупомянутыми данными по солеустойчивости икры двух форм колюшки свидетельствуют о географической изменчивости по соленостной толерантности икры, а также, на мой взгляд, говорят о разной степени «древности» жилой leiurus в процессе ее отчленения от морской формы trachurus независимо в разных участках ареала. В частности, хорошая выживаемость икры leiurufe из различных озер бассейна Белого моря говорит об относительной «молодости» этих пресноводных популяций и о том, что в «генетической памяти» leiurus еще записан гипоосмотический тип осморегуляции. О диапазоне солеустойчивости сперматозоидов колюшковых до недавнего времени данных не было. Такие данные для трехиглой колюшки были получены недавно (Соин, Зюганов, 1979; Зюганов, Хлебович, 1979; Зюганов, 1980, 1981а, 19816, 19836). Оказалось, что сперматозоиды морской формы trachurus из бассейна Белого моря активируются в широком диапазоне солености от пресной воды до морской соленостью 50 ‰, в то время как спермии жилой формы leiurus из бассейна Белого моря имеют диапазон 0—16 ‰ (рис. 15). Различия эти носят генетический характер, поскольку даже выдерживание самцов leiurus в течение месяца в морской воде соленостью 26 ‰ не вызывало последующей активации спермиев в морской воде (Соин, Зюганов, 1979). Исследование функциональной основы различий в реагировании на соленость сперматозоидов двух форм колюшек показало, что из доминирующих в морской воде катионов натрия, кальция, магния, калия и анионов хлора только ион натрия в области высоких концентраций ингибирует активность спермиев leiurus (табл. 6).
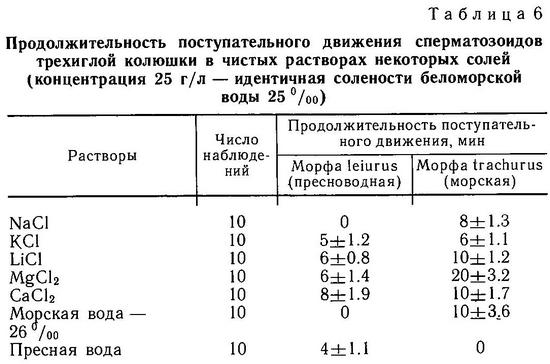
Широкий диапазон солеустойчивости обнаружили также сперматозоиды проходной формы trachurus из Балтийского, Черного и Японского морей (Зюганов, 1983в). К сожалению, в бассейнах этих морей не удалось найти жилой формы leiurus и исследовать диапазон солеустойчивости у этой формы.
Приведенные выше данные Гутса (Gutz, 1970) о наличии у взрослых особей жилой формы leiurus лишь пассивного механизма осморегуляции, не эффективного в морской воде при низких температурах, а также наши данные об ингибировании морской водой (даже при высоких, порядка 15—20 °С, температурах) активного движения спермиев leiurus приводят к заключению о невозможности существования самовоспроизводящейся группировки leiurus в море и о неминуемом вымирании этой формы при резком осолонении пресноводного водоема. Недавно это заключение было подтверждено экспериментально. Интродукция 120 особей leiurus, взятых из пресного озера в солоноватый водоем с соленостью 17 ‰, не привела к успеху: все основатели погибли зимой, не дав потомства (Зюганов, 1985а).
Тем не менее Белл (Bell, 1979b) сообщил, что в морской лагуне (Южная Калифорния, США) с соленостью 32 ‰ он наблюдал нерест leiurus. Это было летом, после пересыхания пресного ручья, впадающего в лагуну, где постоянно обитала популяция leiurus, которую засуха вынудила «переселиться» в морской водоем. Возможно, что в южный частях ареала при высоких температурах колюшки leiurus не утратили способность к обитанию в соленой воде. Рауниш и соавт. (Raunich et al., 1972) отмечали, что в Италии (южный фланг ареала Gasterosteus aculeatus), где обитает лишь морфа leiurus, часть популяций представлена жилыми пресноводыми формами, другая часть жизненного цикла проводит в морских лагунах, и рыбы из этих «миграционных» популяций обладают гемоглобином крови, электрофоретически отличным от такового пресноводных популяций.
Из всех родов колюшковых только Gasterosteus строит гнездо на грунте, остальные (Pungitius, Culaea, Apeltes, Spinachia) строят гнезда над грунтом среди водных растений. Исключением являются две североамериканские популяции Pungitius pungitius (McKenzie, Keenleyside, 1970; Griswold, Smith, 1972, 1973). Точное и сжатое описание постройки гнезда трехиглой колюшки дает Сабанеев (1982, с. 100—101): «За несколько дней до нереста самец трехиглой колюшки выбирает себе место на грунте и выкапывает ямку в нем. Вырыв ямку, самец набирает в рот мелких травинок или иного растительного материала и выстилает этим материалом дно ямки, закрепляя и склеивая слизью этот материал. Затем воздвигаются боковые стены гнезда, наконец свод. После этого он приводит свое гнездо в порядок, придает ему более правильную форму, вытаскивает лишнее, расширяет переднее отверстие, выглаживает края его и вместе с тем старательно отгоняет насекомых и других рыб. Готовое гнездо имеет форму шара или почти шара и очень красиво, но у трехиглой колюшки большая часть его зарыта в ил, поэтому оно незаметно; только иногда, и то в мелкой светлой воде, можно различить небольшие возвышения до 10 см в диаметре». Это, так сказать, описание типичного гнездостроения, которое несомненно подвержено географической и средовой изменчивости внутри каждой формы Gasterosteus aculeatus. Например, по данным Хагена (Hagen, 1967), в р. Литтл Кэмпбел (Британская Колумбия, Канада) жилая leiurus предпочитает для постройки гнезда стоячую воду, мелководье (глубина 20 см), илистый грунт и растительное окружение, a trachurus — течение, стрежень ручья, глубину 50 см и песчаный грунт. Это было выявлено Хагеном (Hagen, 1967) наблюдениями в природе и аквариумными экспериментами. В аквариуме самцы могут строить гнезда из растительного материала на голом стеклянном дне (личные наблюдениям автора) или даже без наличия растительного материала на песчаном дне из песка, при этом самцы успешно стимулировали самок к откладке икры в такие гнезда (А. В. Голубев, личн. сообщ.). Постройку гнезд из песка в природе наблюдал Врат (Vrat, 1949) в Калифорнии и Смирнов (1951) в бассейне Азовского моря. Обычно в природе гнезда строятся на мелководье менее 1 м глубиной. Вуттон (Wootton, 1972) описывает курьезный случай, когда в одной из рек Юго-Западной Англии он обнаружил одно гнездо leiurus внутри консервной банки, а другое внутри молочной бутылки!
Для нереста трехиглая колюшка выбирает наиболее мелководную зону водоемов. Гнезда расположены начиная с глубины 2—3 см и до 1.5 м, но основная масса гнезд располагается на глубине 25—50 см. Характерная особенность нерестовых биотопов — наличие укрытий (камни, коряги и г. д.). Например, на Белом и Черном морях нерестилища Gasterosteus aculeatus характеризовались именно такими условиями, а на Балтике и Охотоморском побережье о. Сахалин (в лагунах) нерест происходил на полностью открытых участках дна. Часто нерестилища были отделены от остальных частей водоема естественной преградой — грядой камней, мелководьем, густыми зарослями тростника (личные наблюдения автора).
Гомелюк (1978), исследовавший нерестилища в бассейне Белого, Балтийского и Черного морей, выделяет следующие их общие особенности: 1) мелководья с прогретой, относительно прозрачной водой; 2) наличие разного рода преград, отделяющих эти участки от остальных зон водоема; 3) относительно низкое содержание кислорода на нерестилищах; 4) пониженная плотность других рыб и хищных беспозвоночных (личинок стрекоз, жуков-плавунцов, гладышей, пиявок и других); 5) мягкие грунты; 6) наличие отмершей растительности (материал для постройки гнезд); 7) богатая кормовая база в виде планктона и бентоса.
При этом он выделяет три основных типа нерестилищ, различающихся между собой: а) эстуарий реки, впадающей в море, вода распреснена; б) литоральная зона моря с грядами камней и колебанием солености вследствие приливного цикла; в) прибрежная зона ручьев и озер. Отсюда ясно, что не все 7 особенностей характеризуют нерестилища колюшки, а наблюдается большое разнообразие сочетаний разных условий на нерестилищах. Соленость воды на нерестилищах, по данным Гомелюка (1978), может колебаться от пресной воды до 20 ‰, но не выше. Повышение солености до 22—24 ‰ в литоральной зоне зал. Левин Наволок (губа Чупа, Кандалакшский залив Белого моря) привело к прекращению существования нерестовой колонии. Этот автор, в частности, связывает уменьшение численности трехиглой колюшки Белого моря с сокращением площадей, пригодных для нереста, вследствие обмеления рек и пересыхания ручьев, впадающих в море, что приводит к возрастанию солености на нерестилищах. Его гипотеза о зарегулировании стока рек не подтверждена фактическими данными, и я сомневаюсь, чтобы именно пересыхание ручьев в течение 1972—1974 гг. (жаркие годы), как указывает В. Е. Гомелюк, явилось причиной устойчивого падения в течение 10 лет численности колюшки Белого моря.
Выбор мест для гнезд имеет важное значение, от него подчас зависит весь успех размножения. Если потребностям самок удовлетворяют лишь прогретость воды и наличие корма, то самцы более «разборчивы». Например, самцы предпочитают еще и наличие отмершей растительности — материал для гнездования; они склонны также располагать гнезда в укрытиях и т. д. Однако, как будет ясно из дальнейшего изложения, наблюдается большая изменчивость по этому признаку. Имеются экспериментальные данные о том, что на скорость постройки гнезда трехиглой колюшки положительно влияет наличие растительности (Schutz, Tschanz, 1971) и присутствие самок (Wunder, 1930; Reisman, 1968а), а наличие конспецифичных самцов имеет более сложное влияние: положительное в начале нереста и отрицательное в его разгаре (Van den Assem, 1967). Последний автор отмечает также, что высокую плотность посадки самцов колюшки в аквариуме можно использовать как методический прием для замедления скорости созревания рыб. Однако, по моим наблюдениям, в аквариумах это может привести к травмированию «психики» большинства самцов, вплоть до появления на теле у них сапролегнии и их гибели, поскольку среди самцов всегда находится один более агрессивный, доминантный самец, который «терроризирует» остальных укусами и толчками.
Есть доказательства гормональной регуляции гнездостроительного поведения. Кастрирование самца, уже почти построившего гнездо, вызывает прекращение гнездостроительной деятельности, но последующая инъекция ему тестостерона (гормона из группы андрогенов, продуцируемого семенниками) стимулирует его дальнейшую гнездостроительную активность. Даже кастрированные самки, инъецированные тестостероном, пытались строить гнезда, но не смогли их закончить (Wai, Hoar, 1963).
Весь процесс постройки гнезда состоит из 8 последовательных элементов, осуществление которых приводит к завершению постройки гнезда в среднем за период 5—6 ч (пределы колебания 4 ч—3 сут) (Van Iersel, 1953): 1) копание (digging) — самец в позе «голова вниз» берет кусок грунта со дна, отплывает в сторону и выплевывает его; 2) тестирование материала — повторные роющие всасывания и выплевывание материала изо рта; 3) ношение материала в гнездовую яму; 4) уплотнение материала толчками головы (pushing); 5) склеивание (glueing) — материал склеивается слизью, продуцируемой почками и выделяемой из мочеполового отверстия, самец поливает поверхность гнезда, придавливая его сверху телом; 6) сверление (boring) — самец высверливает вход в гнездо и тоннель внутри гнезда; 7) вентиляция гнезда (fanning) — при помощи грудных плавников самец гонит токи воды через гнездо (этот элемент, характерен больше всего для родительской фазы, но имеет место также и в гнездостроительной и сексуальной фазах); 8) проползание через гнездо (creeping through) — самец пробивает выход с задней стороны гнезда, проползая через ранее сделанный тоннель. Последний элемент означает конец гнездостроительной фазы и начало сексуальной фазы (Van Iersel, 1953). Диаметр шарообразного гнезда Gasterosteus aculeatus обычно не превышает 5—6 см (Leiner, 1929).
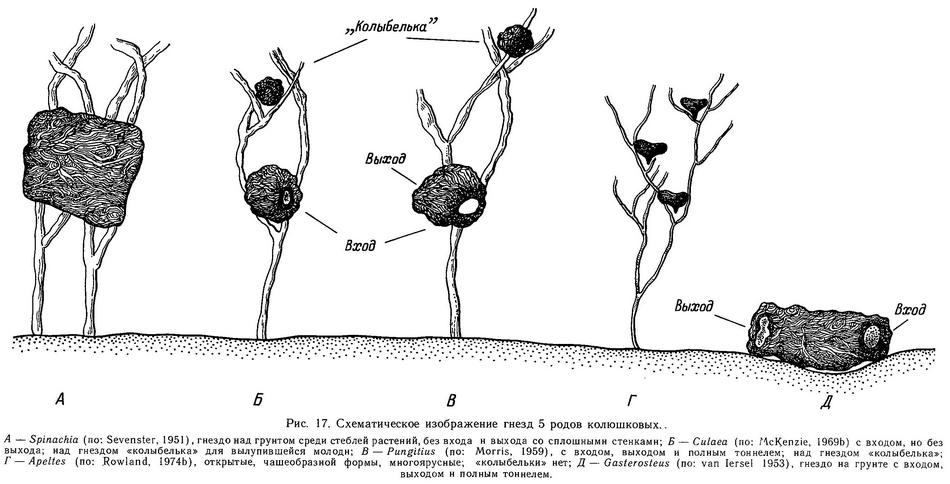
С начала гнездостроительной фазы наблюдается возрастание агрессивности самца. Он защищает свое гнездо от самок и самцов своего вида, других рыб и водных насекомых. Обычно самец атакует стремительным прямым броском, и если вторженец не обращается в бегство, самец кусает его или, схватив рыбу за хвостовой стебель, оттаскивает ее за пределы охраняемой территории (Van Iersel, 1953). Во время территориальных стычек с конспецифичными партнерами колючки не используются как оружие по своему прямому назначению (уколы), выпрямление колючек имеет сигнальное значение для конкурентов (Tinbergen, 1951). Колючки как защита используются только против хищников (Hoogland et al., 1957). Более подробно об агрессивном поведении самцов колюшковых будет сказано в разделе 2.8.3.
2.8.2. СЕКСУАЛЬНАЯ ФАЗА
Лучше всего эта фаза изучена у Gasterosteus aculeatus, поэтому вначале будет более подробно описана фаза ухаживания у трехиглой колюшки и затем будут приведены отличия других родов колюшковых от Gasterosteus.
Тинберген (Tinbergen, 1953) полагает, что ухаживание имеет три важнейшие функции в размножении колюшки: 1) синхронизация половой активности самца и самки — первый «ухаживательный» элемент поведения самца, своеобразный «зигзаг»-танец демонстрирует самке начало половой фазы; 2) ориентирующая функция — совершая акты ухаживания, самец ведет самку к гнезду и показывает вход в него, что обеспечивает откладывание икры в должном месте; 3) функция репродуктивной изоляции — поскольку «репертуар» ухаживания у колюшек видоспецифичен. Действительно, ареалы разных родов и видов колюшковых пространственно в значительной мере перекрываются, перекрываются часто и их нерестовые биотопы. Тем не менее в природе никогда не обнаруживались межродовые гибриды, хотя в эксперименте их можно легко получить искусственным оплодотворением (Leiner, 1934, 1940; Kobayashi, 1962). Более подробная информация о межродовой и межвидовой репродуктивной изоляции дана ниже в этом разделе и в разделе 4.5.6. Севенстер (Sevenster, 1961) и Вилц (Wilz, 1972) предполагают, что еще одной функцией ухаживания является гомеостатическая, поскольку у самца трехиглой колюшки и при половой фазе имеется агрессивная тенденция в поведении даже по отношению к зрелой самке. Выполнение элементов ухаживания приводит самца в должное мотивационное состояние.
В принципе брачная игра половых партнеров состоит из 10 элементов: 5 элементов, выполняемых самцом, и 5 — выполняемых самкой. Временная организация ухаживания трактуется Тинбергеном (Tinbergen, 1951) как цепная реакция: каждый акт поведения одного партнера служит стимулом, побуждающим ответ другого партнера (рис. 18, 19).

Только после заключительного элемента гнездостроительной фазы «проползание через гнездо» самец может положительно реагировать на самку, до этого самка вызывает у него лишь агрессивный ответ (Sevenster, 1961). При появлении поблизости самки самец двигается к ней, исполняя «зигзаг»-танец — серия прыжков как бы к самке и от нее. Каждый скачок от самки символизирует желание вести самку к гнезду, а каждый скачок к самке — атаковать ее. «Зигзаг»-танец — чередование агрессивных и сексуальных тенденций (Sevenster, 1961). При танце рот самца открыт и колючки выпрямлены (Tinbergen, 1953). Зрелая самка на этот танец отвечает позой «головой вверх». Самец прямым движением плывет к гнезду, увлекая за собой самку. Самка следует за ним. Самец показывает вход в гнездо: ложась набок, он всовывает рыло в отверстие гнезда и двигается телом вперед-назад. Самка входит в гнездо. Самец «трясет», «тормошит» ее, быстро толкаясь рылом в бока тела и хвостовой стебель самки. Только после этого самка выметывает икру. Затем самец проникает в гнездо и осеменяет икру. Вслед за выметом икры самка немедленно изгоняется самцом с гнездового участка (Tinbergen, 1951).
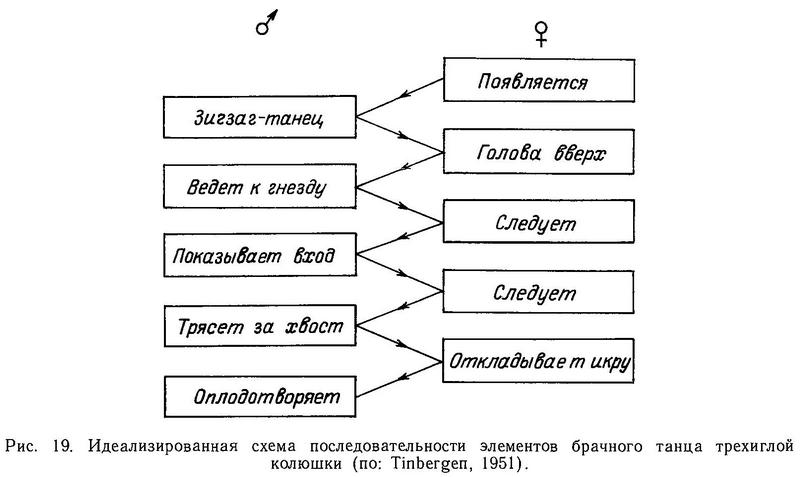
Это типичная, или идеализированная, схема брачного танца трехиглой колюшки, хотя в некоторых случаях ухаживание следует точно этой схеме (Tinbergeh, 1951). Иногда некоторые элементы ухаживания могут быть повторены дважды (Morris, 1958), но чаще имеет место «встраивание» дополнительного цикла бессмысленных, с функциональной точки зрения, элементов (Ter Pelkwijk, Tinbergen, 1936), характерное только для трехиглой колюшки.
После «зигзаг»-танца вместо выполнения элемента «ведение к гнезду» самец принимает позу «dorsal pricking» (буквально: спинное накалывание), подплывает снизу к самке, колючки его распрямлены, будто он хочет проколоть брюхо самки. В этой позе пара плавает по кругу (circling). Затем самец плывет к гнезду, но если самка следует за ним, он возобновляет «dorsal pricking» или прогоняет самку от гнезда, кусая ее. При возвращении в одиночестве к гнезду, самец начинает «сверлить» вход в гнездо, проползает через него, вентилирует его и откладывает на гнездо клей — т. е. выполняет типичные элементы «гнездостроительной» и «родительской» фаз, не совсем уместные в сексуальной фазе, поскольку эти элементы отпугивают самку. Только после завершения этого цикла самец возобновляет ухаживание за самкой, заново начиная «зигзаг»-танец (Ter Pelkwijk, Tinbergen, 1936).
Есть два объяснения функции этого дополнительного цикла. Так, Мак-Фарлэнд (McFarland, 1974) полагает, что «визиты» самца к гнезду и гнездостроительная активность во время фазы ухаживания служат лучшему сохранению гнезда в надлежащем виде для посещения его самкой. Однако отсутствие этого дополнительного цикла у других видов колюшковых (менее агрессивных, чем Gasterosteus aculeatus) делает предпочтительным другое объяснение. Вилц (Wilz, 1970а, 1970b, 1970с) считает, что гнездовая активность во время ухаживания помогает переключиться от относительно агрессивного состояния (необходимого для охраны территории) к относительно сексуальному состоянию (необходимому для успешного спаривания). Заметим, что обе гипотезы не взаимоисключающие. Понятно, что более агрессивный самец может охранять большую территорию и успешнее выведет кладку, чем менее агрессивный, но агрессивность и сексуальность взаимно ингибируемы у колюшек (Wilz, 1972), поэтому наличие дополнительного цикла (несколько затрудняющего и увеличивающего продолжительность спаривания) есть «плата» за высокий уровень агрессивности, эволюционно выработавшийся у Gasterosteus вследствие удачных морфологических противохищнических адаптаций. Физиологические эксперименты показали решающую роль гормональной регуляции брачного поведения. Так, кастрированные после гнездостроительной фазы самцы обнаружили постепенное падение уровня сексуальной активности, но если их обрабатывали тестостероном, сексуальное поведение полностью восстанавливалось, однако только при длинном световом дне, но не при коротком. Кастрированные, но инъецированные тестостероном самцы иногда строили гнезда (правда, без туннеля) и даже выполняли элементы «склеивание» и «вентиляция гнезда», но не обнаруживали элементов «зигзаг»-танец и «ведение к гнезду» при появлении нормальной зрелой самки (Wai, Hoar, 1963). Изменчивость структуры сексуального поведения как основы репродуктивной изоляции между разными формами Gasterosteus aculeatus будет рассмотрена в разделе 4.5.5.
Сексуальное поведение Gasterosteus wheatlandi в принципе сходно с Gasterosteus aculeatus (состоит из тех же элементов), но выполнение самих элементов иное, что неудивительно, поскольку оба вида симпатричны на Атлантическом побережье Сев. Америки и между ними неминуемо должна была выработаться прекопуляционная репродуктивная изоляция.
При выполнении «зигзаг»-танца самец Gasterosteus wheatlandi приближается к самке с головой, опущенной вниз, под углом к горизонтали примерно 30°, в то время как Gasterosteus aculeatus располагает тело горизонтально. Самка, правда, отвечает позой «голова вверх», аналогичной таковой у Gasterosteus aculeatus. Далее, при ведении к гнезду, самец сохраняет позицию «головой вниз», плывет не прямо и быстро, как Gasterosteus aculeatus, а медленно, близко к грунту и извилистым маршрутом, причем непрерывно «трепещет», брюшная поверхность у самца при этом вогнута. Самка, располагаясь ниже самца, следует за ним, сохраняя позу «головой вверх» и подталкивает его головой в брюхо, в то время как у Gasterosteus aculeatus самка плывет к гнезду позади самца, и тело ее находится в горизонтальном положении (Reisman, 1968b; Mclnerney, 1.969). У Gasterosteus wheatlandi отсутствуют элемент «dorsal pricking» и дополнительный цикл гнездостроительной активности во время ухаживания. Дальнейшие элементы спаривания у Gasterosteus aculeatus и Gasterosteus wheatlandi совпадают. Тем не менее и этих различий в элементах ухаживания достаточно для 100%-ной репродуктивной изоляции.
Несмотря на то что в тестах по предпочтению самцы и Gasterosteus aculeatus, и Gasterosteus wheatlandi равновероятно ухаживают за самками обоих видов, самки отвечают на ухаживания только конспецифичного самца. Так, самка Gasterosteus aculeatus не следует за самцом Gasterosteus wheatlandi, когда в начале акта «ведение к гнезду» он принимает позу «головой вниз», а самка Gasterosteus wheatlandi прекращает следовать за самцом Gasterosteus aculeatus, когда он быстро и прямо ведет ее к гнезду (Reisman, 1968b). Играют роль и различия в брачной окраске: вместо ярко-красного брюха самца Gasterosteus aculeatus у Gasterosteus wheatlandi зеленовато-желтый цвет тела с серией черных пятен позади оранжевых брюшных колючек (Mclnerney, 1969).
Выше уже отмечалось, что, несмотря на возможность получения гибридов Gasterosteus aculeatus х Pungitius pungitius искусственным путем (Leiner, 1940, 1934; Kobayashi, 1962), в природе они не найдены (Wilz, 1970с), хотя оба вида живут буквально бок о бок во многих водоемах Европы, Восточной Азии и Сев. Америки, но предпочитают разные биотопы для нереста. В тестах по предпочтению самцы Gasterosteus aculeatus и Pungitius pungitius ухаживали за самками обоих видов равновероятно, но самки прерывали свое следование за самцом «чужого» вида на стадиях «ведение к гнезду» и «показ входа в гнездо» (Wilz, 1970с). К тому же гибриды первого поколения, полученные в лаборатории, имели повышенную смертность на ранних стадиях развития (Kobayashi, 1962), а выращенные до взрослого состояния были стерильны, и самцы не могли строить гнезда (Leiner, 1940).
2.8.3. РОДИТЕЛЬСКАЯ ФАЗА
Применение Эвайсом (Avise, 1976) для лабораторного выведения трехиглой колюшки из Калифорнии (США) еще более совершенной техники также давало число выведенных икринок, в лучшем случае равное 62—66 %, но, по его свидетельству, многие кладки полностью гибли от грибковых заболеваний даже в проточной воде. В природе в большинстве случаев гнездо, лишившееся родителя, обречено — это показали эксперименты в бассейне Белого, Черного и Балтийского морей, проведенные Гомелюком (1978). Кинард (Kynard, 1978) также отмечал, что в оз. Вапато (штат Вашингтон, США) в 1970 г. отмечались массовое покидание самцами Gasterosteus aculeatus своих гнезд и прекращение родительского цикла. Проведенные им эксперименты и наблюдения в природных условиях показали, что подавляющее большинство икры гибло в этом случае либо из-за выедания ее беспозвоночными (пиявки и другие) и рыбами, либо из-за ненормального развития. Рассмотрим поэтому подробнее поведение самца при выведении потомства.
Лучше всего события во время родительской фазы экспериментально изучены на трехиглой колюшке: Прежде всего после оплодотворения самец изменяет форму кладки икры в гнезде, которая обычно располагается у входа в гнездо в виде округлой массы икринок. Самец головой проталкивает икру глубже в гнездо и затем вжимает кладку в дно гнезда серией толчков и разглаживает ее, делая плоской. Затем он удлиняет гнездо и зауживает вход в него, добиваясь тем самым, чтобы следующая кладка икры не откладывалась прямо на предыдущую, а была смещена (черепицеобразно) по отношению к первой. Такое устройство обеспечивает более эффективную вентиляцию всех яиц, чем если бы все яйца откладывались бы одной округлой массой (Van Iersel, 1953). Все это время самец часто вентилирует гнездо («phanning») грудными плавниками. Все эти события происходят примерно в течение часа; в это время самец агрессивен и не ухаживает за самками, но через час он снова готов ухаживать за ними и в течение суток может «набрать» в гнездо до 6—7 кладок (Tinbergen, 1951; Van Iersel, 1953; А. В. Голубев, личн. сообщ.). После этого самец прекращает сексуальную активность и переключает все свое внимание на гнездо. Лишь после выведения, икры через 1—2 недели самец вступает снова в сексуальную фазу. Емко и красочно описывает родительское поведение самца колюшки Сабанеев (1982; с. 102): «Он остается при гнезде, удаляется от него лишь на небольшие расстояния и ревниво оберегает его от всяких врагов, то отгоняя их от этого места, то стараясь отвлечь от него внимание других, более опасных неприятелей, особенно крупных рыб, которые все весьма не прочь полакомиться икрой колюшки. Даже сами колюшки-самки истребляют свои собственные яйца. Кесслер рассказывает, как он безуспешно старался отогнать одного черного самца девятииглой колюшки: сначала последний при каждом движении палки отбегал от гнезда и снова возвращался к нему, но затем уже стал бросаться на палку, как бы огрызаться на нее подобно собаке. Эта охрана гнезда продолжается 10—14 дней, до тех пор пока его окончательно не покинут выклюнувшиеся рыбешки ... Но и то первые дни самец старательнр смотрит за молодью и не дает далеко уплывать от гнезда. Мало того, во время развития зародышей заботливый отец, чтобы воспрепятствовать засорению яиц, нарочно производит волнение воды и усиленно двигает своими грудными плавниками перед отверстием гнезда».
При вентиляции гнезда рыло самца находится на расстоянии 1—2 см от входа в гнездо, и ось тела самца совпадает с продольной осью гнезда (рис. 20). Токи воды создаются грудными плавниками, синхронно движется и хвостовой плавник (Van Iersel, 1953). Использование подкрашенной воды показало, что струи идут через тоннель гнезда и затем устремляются вверх через крышу гнезда, что обеспечивает эффективное удаление СО2 (Tinbergen, 1951). Это очень важно, так как часто нерестилища колюшек располагаются в стоячих водах на мелководье, где кислородные условия неблагоприятны и икра без вентиляции быстро бы плесневела. Для облегчения вентиляции, когда икра находится уже на поздних стадиях развития, самец делает отверстие в крыше и боковых стенах гнезда, перед выклевом предличинок самец полностью разбирает верхний свод гнезда (Wunder, 1930). Еще позже он начинает разрушать гнездо, вынося из гнездовой ямы растительный материал и оставляя в ямке только часть спутанного в клубок материала, где находится недавно вылупившаяся молодь (Wunder, 1930). На всем протяжении развития икры самец выбирает и съедает мертвые икринки.
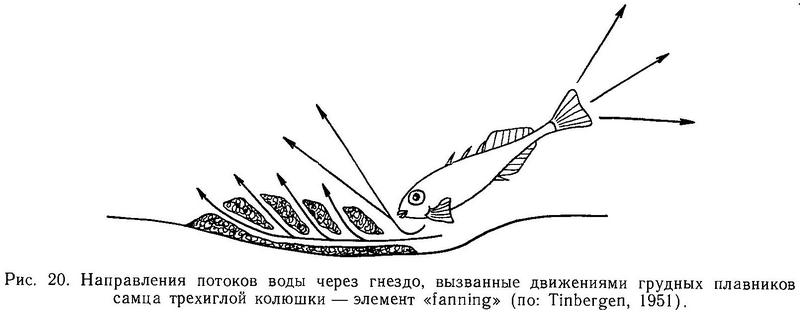
Самец еще около недели заботится о свободно плавающей молоди и пытается содержать молодь вместе у гнезда; уплывших в сторону предличинок он всасывает в рот и выплевывает в гнездовую яму (Van Iersel, 1953; личные наблюдения автора). Однако в «семейных» группах колюшек отсутствует система двусторонней сигнализации между родителями и потомством, и у молоди не происходит выработки оборонительных реакций путем опосредованного обучения самцом. Поэтому Мочек (1972, с. 47) приходит к выводу, что колюшковые относятся к рыбам, чьи семейные группы обладают невысокой степенью поведенческой объединенности в отличие от таких рыб, как например тиляпия (Tilapia mossambica), для которой характерно высокоразвитое семейное поведение.
Есть экспериментальные доказательства того, что самец может определять качество воды и увеличивать вентиляцию икры, если вода плохого качества. Так, Ван Ирзел (Van Iersel, 1953) искусственно обогатил воду в аквариуме СО2 и обеднил О2, на что самец резко увеличил продолжительность вентиляции. Изменения качества воды регистрируются рецепторами 9-го и 10-го черепно-мозговых нервов, окончания которых находятся в глотке (Segaar, 1966). Увеличение длины периода вентиляции гнезда самцом положительно влияет на скорость развития икры (Van Iersel, 1953).
Гормоны, продуцируемые семенниками, видимо, влияют на начало родительского цикла, поскольку кастрация самцов через 2 дня после начала «вентиляционной активности» приводила к прекращению родительской деятельности и удалению икры из гнезда самцом (Smith, Hoar, 1967). Когда же родительское поведение прочно устанавливается, оно становится независимым от гонадных гормонов: кастрирование самцов в середине родительского цикла не вызывает прекращения цикла — самцы и вентилируют гнезда, и агрессивны (Baggerman, 1968). Выше (в разделе 2.8.1) уже отмечалось, что с началом гнездостроительной фазы и далее наблюдается возрастание агрессивности самца, достигающей пика во время родительской фазы. Как ни странно, обычно больше всего «хлопот» территориальному самцу доставляют конспецифичные самки и самцы, очевидно вследствие высокой плотности нерестовых колоний. Обычно самец атакует вторженца стремительным броском и, если последний убегает, кусает его; укусам в основном подвергается область вокруг глаз и хвостовой стебель. В стычках самцы не пользуются колючками как оружием, выпрямление колючек имеет сигнальное значение (Tinbergen, 1951). Конфликт на Границе гнездовых участков между 2 самцами имеет свои «правила игры». Они начинают крутиться вокруг друг друга, спинные колючки и брюшная колючка, обращенная к сопернику, выпрямлены — это типичная поза угрозы. Другая поза угрозы — самец принимает позу «головой вниз» боком к противнику, при этом выпрямлены спинные колючки и брюшная, обращенная к противнику. В итоге один из соперников убегает. Из такой позы на самом деле невозможно совершить прямую атаку. Поза эта означает, что рыба находится в амбивалентном мотивационном состоянии с тенденцией к атаке и бегству (Tinbergen, 1951). Ван Ирзел (Van Iersel, 1953) полагает, что эрекция колючек сигнализирует о мотивационном состоянии самца: выпрямленные спинные колючки — сигнал высокой агрессивности, а выпрямленная брюшная — готовность к бегству. Вуттон (Wootton, 1976; с. 171) считает, что поскольку колючки в сущности являются модифицированными плавниками, то эрекция колючек может быть коррелирована с изменениями наружности плавников, когда рыба плывет, а не напрямую с изменениями факторов, контролирующих кусание или бегство. В работе, признанной этологами классической, Тинберген (Tinbergen, 1951) серией изящных опытов на самце трехиглой колюшки показал, что красная окраска является стимулом, вызывающим агрессию (рилизинг-фактором). Сначала территориальному самцу с помощью куска проволоки «подводили» мертвых колюшек, и он более энергично атаковал «красных» самцов, нежели незрелых, тускло окрашенных или самок. Мертвых, но искусственно окрашенных в красный цвет самок он также энергичнее атаковывал, чем живых бесцветных. Для предотвращения искажающего влияния запаха мертвые рыбы подводились к самцу помещенными в стеклянные пробирки — результаты были аналогичными. Затем самцу предлагались пластмассовые модели разной окраски, и больше всего атаковывались модели с «красным брюхом». Размер и форма модели не имели такого решающего значения на стимуляцию агрессии, как «красное брюхо». Тинберген (Tinbergen, 1953) приводит курьезный случай, когда территориальный самец в аквариуме регулярно «атаковал» проходящий почтовый поезд красного цвета, когда видел его из окна лаборатории: самец перемещался стремительным броском по аквариуму в сторону окна.
Размер самца, охраняющего гнездо, не влияет на его агрессивность, но если во время гнездостроительной фазы он одинаково атакует и самок и самцов, то после постройки гнезда самец энергичнее атакует окрашенных самцов, нежели самок и незрелых самцов (Wootton, 1976), причем самец «не боится» и более крупных рыб, чем он сам: так гнездующие самцы атаковывали гольянов, которые были крупнее на 4 см. Наиболее агрессивен самец в радиусе 30—40 см от гнезда, но во время родительской фазы территория наивысшей агрессии несколько сужается (до 25—30 см) (Back, 1971; Huntingford, 1974). Топография охраняемой территории также влияет на ее площадь — если камни, растения и т. п. затрудняют соседним территориальным самцам визуальное наблюдение друг за другом, это уменьшает территорию их участков (Wunder, 1930). Эксперименты и природные наблюдения показывают, что минимальная дистанция между гнездами 30—50 см и наименьшая площадь территории гнездующего самца 45х45 см (Black, Wootton, 1970), причем более агрессивный самец «содержит» большую территорию (Van Den Assem, 1967). В эксперименте на одной и той же площади можно добиться большей плотности нерестовой колонии самцов, если их разместить одновременно, нежели когда самцы выпускаются на эту площадь по очереди с 24-часовым интервалом (Van den Assem, 1967), так как самцы, первыми захватившие «место под солнцем», неохотно отдают ее новеньким. При одновременном выпуске самцов на субстрат вначале идут ожесточенные стычки за территорию, но когда «места» уже распределены, ожесточенность и количество стычек уменьшается в течение 2 дней, и самцы занимаются больше уже другими делами — строят гнезда, ухаживают за самкой и т. п. (Van den Assem, 1967). Иногда самец отвлекает самок от гнезда, принимаясь «копать» грунт в стороне от гнезда, как будто он ищет корм, что часто приводит к успеху (Гомелюк, 1978).
Понятно, что сама агрессивность самцов должна поддерживаться отбором, поскольку неагрессивный самец не может захватить участок, построить гнездо и в конечном счете не может участвовать в размножении и не оставит потомства. Есть положительные корреляции между агрессивностью самцов и «смелостью» по отношению к хищникам (Huntingford, 1977). Имеются экспериментальные доказательства того, что продукт гипофиза — гормон гонадотропин стимулирует высокий уровень агрессивности. Даже самцы, выдержанные в условиях короткого светового дня, когда гипофиз имеет низкую активность, но инъецированные гонадотропным гормоном млекопитающих (лютеинизирующим гормоном), увеличивали агрессивность (Hoar, 1962а). Другие гормоны гипофиза — тироидстимулирующий и фолликулстимулирующий — не меняли уровня агрессивности самцов при инъекции. Вместе с тем блокатор секреции гонадотропина — металлибур — при инъекции уменьшал агрессивность самцов (Carew, 1968, — цит. по: Wootton, 1976).
Территориальные самцы не напрасно наиболее ожесточенно преследуют именно конспецифичных самцов, так как у колюшек можно наблюдать удивительное явление «похищения» икры из гнезда другими самцами. Эта икра или съедается, или «усыновляется» похитителем. Впервые «налеты на гнезда» были описаны для Pungitius (Morris, 1952) и для Gasterosteus aculeatus Драпкиным (1954). Действия «налетчика» на чужой территории отличаются своего рода «продуманностью». Нарушив границу чужой территории, «налетчик» опускается на дно, выпрямляет спинные колючки и принимает камуфлирующую окраску. Крадучись, он приближается к чужому гнезду по дну скользящими движениями и делая паузы между скольжениями. Последние несколько сантиметров, оставшихся до гнезда, он преодолевает стремительным броском. Если его обнаруживает владелец гнезда, то он обращается в бегство после выпада хозяина, но если он успевает достичь гнезда, то хозяину уже трудно выгнать вторженца, и тут разворачиваются самые интересные события. Если в это время владелец занят ухаживанием за самкой, то дальнейшее поведение «налетчика» зависит от того, на какой стадии находится брачная игра. Если владелец показывает самке вход в гнездо, «налетчик» прерывает его ухаживание и начинает «сверлить» гнездо, но в случае, если самка уже откладывает икру, «налетчик» пытается оплодотворить икру до владельца, что ему иногда удается. В том случае, если «налетчик» пробрался к чужому гнезду до брачного танца хозяина, он крадет гнездовой материал для своего гнезда (если он его еще не построил). Если в гнезде хозяина уже есть икра, он крадет ее и съедает (в том случае, когда сам еще не построил гнездо) или помещает в свое гнездо и далее ухаживает за икрой. Интересно, что если во время предыдущего рейда «налетчику» удалось оплодотворить икру в чужом гнезде, то следующим рейдом он пытается украсть эту икру (Morris, 1952; Драпкин, 1954; Van Den Assem, 1967; Wootton, 1971).
Ван ден Ассем (Van Den Assem, 1967) полагает, что функцией «налетов» является перераспределение икры в нерестовой колонии: похищает икру тот, кто не добился успеха в ухаживании за самкой; похищение икры приводит в итоге к синхронизации репродуктивного цикла самцов. Вуттон (Wootton, 1971) считает, что каждый самец на нерестилище будет иметь больший успех в выведении потомства, если все самцы на территории нерестилища будут включены в родительскую активность, чему способствует похищение икры. Драпкин (1954) полагает, что в конечном счете похищение и усыновление икры способствует сохранению численности вида, но Драпкин не объясняет, по каким причинам. Гомелюк (1978) полагает, что, поскольку во время нереста всегда имеется убыль самцов, охраняющих свои гнезда, усыновление гарантирует выведение икры чужим самцом, даже если «отец» погиб по каким-то причинам. Мак-Инерней (Mclnerney, 1969) отмечает, что «усыновление» свойственно всем колюшковым.
3. ГЕОГРАФИЧЕСКОЕ РАСПРОСТРАНЕНИЕ И ИСТОРИЯ ФАУНЫ
Все представители семейства колюшковых обитают в прибрежных морских и пресных водах северного полушария: в бассейнах Атлантического, Северного Ледовитого и Тихого океанов. В бассейнах Атлантического и Тихого океанов распространение колюшковых амфибореальное — они обитают в северных частях этих океанов и не спускаются южнее 32° с. ш. Самыми обширными ареалами обладают 2 -вида: Gasterosteus aculeatus и Pungitius pungitius, которые распространены и в восточном, и в западном полушарии в бассейнах всех трех океанов. Трудно сказать, ареал какого их этих видов больше по площади: если Pungitius pungitius явно держит первенство по распространенности в пресных водах, то Gasterosteus aculeatus доминирует в морских водах (рис. 21, 22).
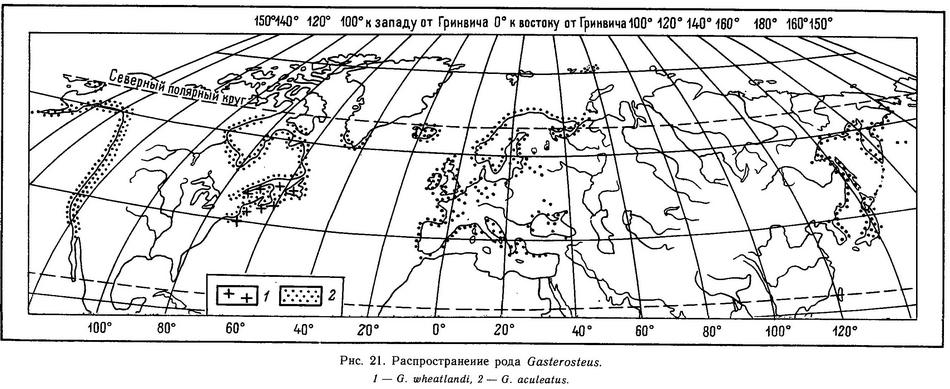
Gasterosteus aculeatus имеет разорванный ареал в северной части Атлантического и Тихого океанов: в Европе от Белого моря, Новой Земли (70° с. ш.) и Кольского полуострова до Черного моря, у берегов Гренландии, Исландии; в Сев. Америке от Гудзонова залива до Нью-Йорка и, возможно, Чезапикского залива и мыса Гаттерас (Берг, 1949); южная граница по Атлантическому побережью Америки недостаточно хорошо определена (Bell, 1984). По Тихоокеанскому побережью Сев. Америки — от Аляски до Южной Калифорнии (южная граница морской формы 37° с. ш., а пресноводной 32° с. ш.) (Miller, Hubbs, 1969). По побережью Северного Ледовитого океана Gasterosteus aculeatus отсутствует как в Сев. Америке, так и в Азии. В Восточной Азии трехиглая колюшка распространена от Берингова пролива на юг до Фузана (Корея) 36° 6' с. ш. (Берг, 1949) и по побережью Японии на юг до о. Киушу (близ г. Нагасаки 32°44' с. ш.) (Amaoka, Haruta, 1972). Между североазиатскими и североамериканскими популяциями нет разрыва, они связаны цепью популяций Алеутских и Командорских островов, простирающихся от Аляски до Камчатки. Таким образом, ареал Gasterosteus aculeatus состоит их трех крупных блоков, не связанных между собой: европейского, атлантического американского и тихоокеанского азиатско-американского. В целом ареал Gasterosteus aculeatus ограничен широтами 32—70° с. ш. Нахождение Gasterosteus aculeatus в Африке (близ г. Алжир) (Bertin, 1925) оспорено Хойтсом (Heuts, 1956), который не нашел следов этой популяции спустя 30 лет. Трудность описания ареала Gasterosteus aculeatus вызвана сложной популяционной структурой этого таксона — наличием морской и пресноводной форм и множества изолированных пресноводных популяций. Морская форма держится, как правило, в прибрежной части морей и океанов, хотя, по наблюдениям Расса (цит. по: Берг, 1949, с. 976), в Баренцевом море она встречалась в открытой части на севере до 72°41' с. ш. В пресных водах трехиглая колюшка встречается в слаботекущих реках и ручьях, в озерах, прудах, но отсутствует в быстротекущих водоемах и горных озерах. Жилая форма и в Европе, и в Америке встречается южнее, чем морская (Betrin, 1925; Miller, Hubbs, 1969). Например, в Европе к югу от пролива Ла-Манш морская форма trachurus отсутствует, а жилая leiurus встречается в пресных и солоноватых водах. В Европе в глубь континента самое дальнее проникновение leiurus отмечено, по Рейну, на расстояние до 700 км. На юг leiurus продвигается до Южной Испании, юга о. Сардиния и в Италии до Неаполя. В Сицилии отсутствует, но обитает по восточному побережью Адриатического моря (Bertin, 1925). В южной части ареала пресноводной формы часто встречаются популяции, вообще лишенные костных пластинок и киля на хвостовом стебле (голые). Бертэн (Bertin, 1925) называет эту форму hologymna. Параллельно такая же форма возникает в Америке, в Южной Калифорнии (Miller, Hubbs, 1969). Жилая форма в бассейне Средиземного моря обладает повышенной солеустойчивостью вне сезона размножения (Raunich et al., 1972), поэтому она могла распространяться по бассейну моря путем морских миграций вдоль побережья. Морской формы в бассейнах Средиземного и Мраморного морей нет, она появляется лишь в бассейнах Черного и Азовского морей, причем популяции трехиглой колюшки этих морей пространственно изолированы от балтийских популяций. В Каспийском море, Волге и Аральском море трехиглой колюшки нет.
По поводу расселения трехиглой колюшки в Европе и современного распределения морф колюшки выдвигались разные гипотезы. Так, Бертэн (Bertin, 1925) полагал, что все европейские популяции, обитающие от Норвегии до Италии, генетически однородны, а все изменения числа боковых пластин рассматривал как результат прямого воздействия солености и температуры: leiurus развивается в пресной воде и при высоких температурах, trachurus — в соленой воде и при низких температурах и semiarmatus — в промежуточных условиях. Таким образом, распространение разных форм он представлял как постепенный переход от чистой популяции trachurus в Северной Европе (Скандинавия) к популяциям, semiarmatus в Средней Европе и leiurus в Южной (Bertin, 1925). Ошибочность, этой гипотезы доказана: все три морфы детерминированы разными генотипами (Heuts, 1947а; Münzing, 1959; Hagen, 1967; Hagen, Gilbertson, 1973; Paepke, 1982; Зюганов, 1983г).
Мюнцинг (Münzing, 1959, 1963, 1972) считает, что современное распространение колюшки с ее тремя формами является результатом послеледникового (в плейстоцене) расселения, гибридизации и селекции этих форм в пределах морских и пресноводных условий.
Важнейшими факторами среды, влияющими на расселение форм колюшки, по его мнению, является температура и соленость.
Нужно сказать, что изложенные гипотезы Мюнцинга базируются лишь на данных современного распространения форм колюшки и истории ледниковых и послеледниковых геологических событий в четвертичный период. Ископаемыми отпечатками Gasterosteus aculeatus Мюнцинг не располагал, поэтому очевиден предположительный характер истории фауны, изложенный Мюнцингом.
Однако позже ископаемые отпечатки Gasterosteus aculeatus были обнаружены в позднемиоценовых отложениях (10-миллионолетней давности) в районе Лос-Анжелеса (Тихоокеанское побережье США, штат Калифорния) (Bell, 1973, 1974, 1977). Интересно, что отпечатки leiurus сохранились в пресноводных отложениях, а отпечатки trachurus — в морских, причем миоценовая trachurus морфологически ничем не отличается от современной (Bell, 1977). Поскольку ископаемая trachurus найдена значительно южнее, чем южная граница ареала современной trachurus, которой соответствует современная средняя февральская температура поверхности воды в море 12.4 °С, Белл (Bell, 1977) указывает, что в позднем миоцене температура воды в районе Лос-Анжелеса была 10 °С и ниже, что не противоречит более южному распространению trachurus в то время. Опираясь на палеотемпературные данные Канайя и Койзуми (Kanaja, Koizumi, 1966, — цит. по: Bell, 1976), установивших, что в плейстоцене произошло по крайней мере 20 крупных колебаний температурного минимума в западной Пацифике, Белл (Bell, 1976) выдвигает гипотезу о пульсации ареала морской trachurus, во время которой пресноводные ручьевые популяции leiurus независимо отщеплялись от «единой примитивной монофилетической линии trachurus» (Bell, 1977, с. 279). Каждый раз отступление trachurus на север влекло за собой изоляцию ручьевых популяций колюшки, которые превращались в leiurus, а последующий контакт с морской trachurus, с похолоданием вновь устремляющейся на юг, закреплял репродуктивную изоляцию.
Таким образом, Белл (Bell, 1976) постулирует полифилетическое происхождение leiurus, имеющее место в разное время в разных местах ареала. Консервативность и генетическое единство trachurus Белл объясняет стабильными условиями в море, а морфологическое разнообразие leiurus — разнообразием условий пресноводных водоемов, влиянием изоляции, дрейфа генов и разными режимами отбора в разных водоемах. С точки зрения Белла (Bell, 1984), представления Мюнцинга (Münzing, 1963) о trachurus и leiurus как о двух филетических линиях, которые независимо существовали, а затем в результате «ледниковых событий» образовали гибридную зону в одном месте, неубедительны. По мнению Белла (Bell, 1984), не может быть и речи о leiurus как об одной филетической линии, представители которой потом мигрировали по ареалу, образовывали зоны контакта с trachurus и т. д.; leiurus имеют полифилетическое происхождение. Не гибридизация между trachurus и leiurus, а отбор, вернее различия в направлениях и давлениях отбора в разных частях ареала привели к современному разнообразию колюшковых (Bell, 1984).
Gasterosteus wheatlandi — чернопятнистая колюшка — распространена по Атлантическому побережью Канады и США от о. Ньюфаундленда, зал. Св. Лаврентия на юг до г. Нью-Йорк (Sargent et al., 1984). Это морской вид, обитающий в прибрежных соленых водах. Размножается в солоноватых прибрежных водах, в эстуариях рек и на литорали. Подавляющее число популяций представлено морфой leiurus, хотя встречаются фенотипы, соответствующие semiarmatus и trachurus, и эта комбинация (редуцированный костный панцирь и морское распространение) необычна для рода Gasterosteus. Gasterosteus wheatlandi на всем своем ареале симпатричен с Gasterosteus aculeatus, у них даже одни и те же нерестилища. Неясно, произошел ли Gasterosteus wheatlandi от морской формы trachurus Gasterosteus aculeatus и затем имела место редукция костных пластин или же Gasterosteus wheatlandi — дериват формы leiurus трехиглой колюшки, которая адаптировалась к жизни в морской воде. Время и обстоятельства ответвления Gasterosteus wheatlandi от Gasterosteus aculeatus неизвестны (Wootton, 1976; Sargent et al., 1984).
История описания и классификации видов внутри каждого рода колюшковых была не менее сложной. Например, для рода Gasterosteus сложилась такая ситуация, что к началу XX в. было описано 42 вида (табл. 7). Это произошло вследствие обнаружения высокой изменчивости трехиглой колюшки, необъятности ее ареала и господствующего в то время типологического подхода в систематике. Многие виды были описаны всего по нескольким экземплярам. Бертэну (Bertin, 1925) в результате тщательного анализа географической и экотипической изменчивости морфологии колюшки, а также всестороннего исследования биологии удалось показать, что все эти «виды» связаны многочисленными переходными формами. Часть изменчивости находится под прямым контролем внешней среды или является возрастной и половой. «Даже если рассматривать колюшек из одной популяции, одного поколения и из одной кладки икры — среди них невозможно найти 2 идентичные особи с разных точек зрения», — писал Бертэн (Bertin, 1925, с. 152).

Он свел все 42 вида в 1 (Gasterosteus aculeatus), выделил 6 признаков, имеющих альтернативные варианты (всего 17 вариантов), и определил, что различные комбинации этих вариантов в итоге дают 300 возможных фенотипов (правда, некоторые сочетания «запрещены», например trachura—apoda, — В. 3.).
Признаки, выделенные Бертэном, следующие.
Список видов рода Gasterosteus, синонимизированных Бертэном (Bertin, 1925) в Gasterosteus aculeatus
1. Степень вооружения боков пластинами: пластины идут от головы до хвостового плавника (trachura), пластины только спереди и на хвостовом стебле (semiarmata), то же, но хвост голый (gymnura = leiura), пластин и киля совсем нет (hologymna), тело голое, но киль есть (carinata).
2. Число колючек в D: 3 — teraculeata, 4 — tetracantha, 2 — biarmata.
3. Форма тела рыбы: высокая (brevis), удлиненная (gracilis).
4. Длина колючек в D: короткие — brachycentra, длинные — dolichocentra.
5. Длина колючек в V: короткие — brachypoda, длинные — dolichopoda, нет колючек — apoda.
6. Зазубренность колючек: гладкие — leiocentra, зазубренные — trachicentra.
Например, фенотип какой-либо колюшки можно охарактеризовать: gymnura — teraculeata — brevis — dolichocentra — dolychopoda — leiocentra.
Все эти фенотипы не имеют приуроченности к определенным географическим районам. В дальнейшем систематики согласились, что все разнообразие форм можно рассматривать как выражение изменчивости одного политипического и полиморфного таксономического вида Gasterosteus aculeatus-complex, и после работы Бертэна (Bertin, 1925) описание таксономических видов в роде Gasterosteus в целом прекратилось. Была, правда, недавно сделана одна такая попытка Хагеном (Hagen, 1967), который обнаружил в ручьях Британской Колумбии (Канада) репродуктивную изоляцию двух морфологически отличимых парапатрических форм: морской (trachurus) и жилой (leiurus). Морскую он назвал Gasterosteus trachurus, а жилую Gasterosteus aculeatus. Его классификацию не приняли, и Хаген в дальнейшем сам отказался от этой таксономической классификации (Hagen, McPhail, 1970). Тем не менее эта работа Хагена, а также последующие работы его и соавторов выявили интереснейшую эволюционную ситуацию, когда в одних местах формы ведут себя «как виды», а в других те же формы могут широко гибридизировать, вдлоть до слияния (Bell, 1984). Более подробно проблема вида в роде Gasterosteus будет рассмотрена в разделе 4.5.6.
В списке 42 видов трехиглых колюшек, которые Бертэн (Bertin, 1925) свел в 1 вид, под номером 27 (табл. 7) фигурировал Gasterosteus wheatlandi Putnam, 1866. Недавними исследованиями американских ихтиологов была доказана полная самостоятельность этого вида (Reisman, 1968b; Mclnerney, 1969).
Таким образом, сейчас в роде Gasterosteus признается 2 таксономических вида: Gasterosteus aculeatus species-complex и Gasterosteus wheatlandi (Wootton, 1976; Bell, 1984).
Жаберные тычинки. Число жаберных тычинок на 1-й жаберной дужке коррелировано с расстоянием между тычинками и является индикатором размера и вида корма в пищевом рационе трехиглой колюшки (Larson, 1976). Число жаберных тычинок является у колюшковых таксономическим признаком. Хаген (Hagen, 1973) установил, что коэффициент наследуемости жаберных тычинок трехиглой колюшки оз. Вапато (штат Вашингтон) равен 0.58. Хаген и Гельбертсон (Hagen, Gilbertson, 1972) установили, что на Тихоокеанском побережье Сев. Америки у озерных популяций трехиглой колюшки число жаберных тычинок (19—22) больше, чем у ручьевых (14—17).
Позвонки. Линдсей (Lindsey, 1962а) обнаружил, что увеличение температуры выращивания икры трехиглой колюшки сначала уменьшает, а затем увеличивает число позвонков, так что зависимость числа «vt» от температуры принимает V-образную форму.
Полиморфизм по брачной окраске. Полиморфизм по брачной окраске (красносамцовые и черносамцовые популяции) описан у трехиглой колюшки на западном побережье США (см. раздел 1.4).
Мак-Фейл (McPhail, 1969) показал, что особи на парапатричных и аллопатричных «красносамцовых» и «черносамцовых» популяций скрещиваются в эксперименте и гибриды первого поколения промежуточны по окраске. Хаген и Муди (Hagen, Moodie, 1979) кроме первого получили второе поколение гибридов и беккроссов. F1-гибриды сходны по фенотипу окраски с таковыми, полученными Мак-Фейлом (на горле рассеяны красные и черные пятна, спина от зеленого до темно-коричневого оттенка), причем реципрокные скрещивания давали эквивалентные результаты. Во втором поколении при скрещивании гибридов F1 самих на себя и при возвратных скрещиваниях (гибрид F1 х родитель) были получены соотношения фенотипов по окраске, хорошо описываемые однолокусной диаллельной моделью без доминирования какой-либо аллели (АА — красные, АА1 — промежуточные, А1А1 — черные). Авторы полагают, что на экспрессивность гена, детерминирующего брачную окраску, влияют полигенные локусы-модификаторы, так как наблюдается значительная изменчивость в соотношении красных и черных пигментов у гибридов и есть большое сходство между беккроссами (потомками от возвратных скрещиваний) и особями из той родительской популяции, с которой скрещивались гибриды F1.
Спинные колючки. Пенчак (Penczak, 1963) скрещивал трехколючковых самцов Gasterosteus aculeatus с четырехколючковыми самками и получил в F1 только 3-колючковых особей. Скрещивания самцов и самок с 4 колючками дали также потомство F1 только с 3 колючками. На этом основании автор делает вывод, что 4 спинные колючки — рецессивный признак. Линдсей (Lindsey, 1962а) при скрещивании особей «3 колючки» х «3 колючки» получал выщепление 2 % 4-колючковых особей при повышении температуры выращивания потомства. Кэмпбелл (Campbell, 1979) провел 3 межпопуляционных скрещивания особей с 3 колючками и с редуцированным числом колючек (2 и 1). Результаты оказались неодинаковыми: потомки от одного скрещивания оказались все с 3 колючками, от другого — с редуцированным числом, а от третьего — оба фенотипа.
Результаты скрещиваний свидетельствуют о межпопуляционных различиях в соотношении генетической и паратипической компонент изменчивости числа спинных колючек. Факторы внешней среды также несомненно влияют на изменчивость числа спинных колючек Gasterosteus aculeatus.
Тазовый пояс. Кэмпбелл (Campbell, 1979) провел три межпопуляционных скрещивания между колюшками «дикого» типа (с нормальным тазовым поясом) и колюшками с редуцированным тазовым поясом (он обозначает их как аномальные). Одно скрещивание продуцировало все потомство — норму, второе — всех аномальных, а третье — норму, аномальных и промежуточных. Результаты работы Кэмпбелла (Campbell, 1979) говорят о генетической основе межпопуляционных различий по степени редукции тазового пояса и об отсутствии полного доминирования «дикого типа» над «редукцией». В частности, результаты третьего скрещивания свидетельствуют о гетерозиготности и «дикого типа», и «редукции».
Жиль (Giles, 1983) скрещивал между собой 8 родителей Gasterosteus aculeatus (морфа hologymna), лишенных тазового пояса, а также боковых пластин и 2 спинных колючек, собранных из мономорфных популяций, обитающих на Гебридских островах (Великобритания) в озерах с низкой концентрацией кальция (0.94—2.5 мг/л). Потомство от скрещиваний было выращено в воде оз. Ломонд (3.8 мг/л), где обитают колюшки с нормально развитыми брюшными, спинными колючками, тазовым поясом и боковыми пластинками (морфа leiurus). Тем не менее все потомки F1 оказались фенотипически идентичны родителям, хотя и развивались в более богатой кальцием воде, что привело автора к выводу — «скелетная редукция не является простым онтогенетическим ответом на низкую концентрацию кальция... и ... подчеркивает наличие генетической основы скелетной редукции» (с. 540).
Солеустойчивость икры. Хойтс (Heuts, 1946, 1947b) исследовал генетику солеустойчивости икры 2 форм Gasterosteus aculeatus в Бельгии. Проходная trachurus нерестится в низовьях рек, а жилая leiurus — в верховьях, хотя между двумя формами есть узкая гибридная зона, где обе формы контактируют. Оказалось, что у форм разные оптимумы развития икры: выживаемость икры leiurus х leiurus была максимальной в пресной и слабосоленой (до 6 ‰) воде, a trachurus х trachurus — при солености 17 ‰. Гибридная икра (самка trachurus х самец leiurus) имела оптимум солености, характерный для trachurus. Напротив, гибридная икра (самка leiurus х самец trachurus) имела оптимум солености, характерной для leiurus. Таким образом, здесь сильную выраженность имеет материнский эффект.
Интересно, что в бассейне Белого моря икра trachurus и leiurus имеет одинаковый оптимум в широком диапазоне солености: от пресной воды до морской соленостью 26 ‰ (Соин, Зюганов, 1979).
Солеустойчивость сперматозоидов. Характеристика полиморфизма по солеустойчивости спермиев Gasterosteus aculeatus дана ранее в разделе 2.7. Все спермии у выщепляющихся в первом поколении самцов формы leiurus от группового скрещивания trachurus х trachurus, проведенного в пресной воде, не активируются в морской воде, но все спермии trachurus, выщепившихся в этом же скрещивании, активны в морской воде соленостью 26 ‰. При индивидуальном скрещивании самец trachurus х самка leiurus (карьер «Микрооленчик», в пресной воде) у выщепившихся в F1 особей semiarmatus часть спермиев (примерно 50 %) активировалась в морской воде, т. е. вела себя как trachurus, а остальные спермии не активировались в морской воде, т. е. вели себя как leiurus (Зюганов, 1981а, 1981б). Самцы trachurus, выщепившиеся в F1 в этом же скрещивании, обнаружили активацию большинства (80—90 %) спермиев в морской воде. Leiurus в этом скрещивании не выщепилось (Зюганов, 1983в, 1983г). Результаты реципрокного скрещивания (самец leiurus х самка trachurus) в карьере «Малыш» оказались аналогичными, за исключением того, что у semiarmatus активировалась в морской воде меньшая часть спермиев (15—20 %), так же как и у trachurus (50—60 %), по сравнению с предыдущим скрещиванием. Эти результаты позволили выдвинуть гипотезу, что гены, определяющие морфы, тесно сцеплены с генами, определяющими солеустойчивость спермиев (Зюганов, 1981а, 1981б, 1983в). Однако спермии самцов leiurus, выщепившихся от скрещивания самец semiarmatus х самка leiurus, обнаружили активацию в морской воде (активировалась 30—50 % спермиев). Это означает, что нет 100%-ного сцепления признаков «leiurus» и «отсутствие солеустойчивости спермиев», как это предполагалось ранее. Следовательно, генетический контроль солеустойчивости спермиев оказался гораздо сложнее (Зюганов и др., 1987).
Представляется, что различия по солеустойчивости спермиев между морской trachurus и пресноводной leiurus не абсолютны, а относительны. При попадании в пресноводный изолированный водоем группа основателей trachurus в течение нескольких первых поколений расщепляется на 3 морфы: trachurus, leiurus и semiarmatus. С течением длительного времени частота leiurus накапливается и затем фиксируется на уровне 1.0 (мономорфизм), а остальные 2 морфы элиминируются. Эксперименты в природе показали, что выщепившаяся leiurus сразу же в первом поколении теряет способность к активации спермиев в морской воде, a trachurus теряет эту способность постепенно и более плавно. Начиная со второго поколения, только 9 % самцов trachurus в популяции полностью утеряли солеустойчивость спермиев (судя по наблюдениям в карьере «Рудник»), а примерно через 14—15 поколений (судя по наблюдениям в карьере «Нильмо») уже 78 % самцов trachurus утеряли солеустойчивость спермиев, к этому времени уже все самцы semiarmatus утеряли солеустойчивость (Зюганов, 1980).
Особенности репродуктивного поведения. В норме самец Gasterosteus aculeatus во время сексуальной фазы (см. раздел 2.8.2) проползает через гнездо с 7—10-минутным интервалом перед повторным проползанием (Wootton, 1976). Однако в некоторых европейских популяциях есть самцы (их называют «маньяки»), выполняющие этот элемент 2—4 раза подряд без всяких интервалов, затем следует интервал в 7 мин, характерный для нормальных самцов, и многократное проползание повторяется вновь, так что 1 проползание нормального самца соответствует нескольким проползаниям «маньяка». Генетический анализ показал простое моногенное наследование этого признака: «норма» доминирует над «маньяком». Признак «маньяк» не сцеплен с полом и числом боковых пластин (с морфой). Однако внешние условия могут модифицировать этот признак. Так, самцы, достигшие половозрелости при длинном световом дне и высокой температуре (о которых было известно, что генетически они являются «маньяками»), обнаруживали высокую экспрессивность гена. Вместе с тем самцы из той же линии, но выдержанные перед нерестом 2—3 мес в «зимних» условиях, обнаружили слабую экспрессивность этого гена и не выполняли элементов поведения, характерного для «маньяка» (Sevenster, Hurt, 1974).
Между trachurus и leiurus у трехиглой колюшки Японии не найдено различий покариотипам (Muramotoet al., 1969). Росс (Ross, 1973) показал, что калифорнийские формы Gasterosteus aculeatus: trachurus, leiurus, hologymna кариотипически полностью идентичны и не отличаются от Gasterosteus aculeatus из штата Мэн (США), исследованных Ченом и Рейсманом (Chen, Reisman, 1970). Росс (Ross, 1973) предпринял скрещивания между leiurus и hologymna и не нашел существенных различий между гибридами и контролем по таким показателям, как оплодотворяемость икры, смертность эмбрионов и личинок.
4.5.4. ФАКТОРЫ ЭВОЛЮЦИИ
Из 4 известных элементарных эволюционных факторов — мутационный процесс, популяционные волны, изоляция, естественный отбор (Тимофеев-Ресовский и др., 1977) лучше других экспериментально изучено на колюшковых (в основном на Gasterosteus acicleatus) действие изоляции и отбора. Сейчас все исследователи колюшковых согласны (см. сводки: Wootton, 1976, 1984; Bell, 1984), что у Gasterosteus aculeatus пресноводная морфа leiurus происходит независимо от морской trachurus в разных участках ареала. Следовательно, рецессивные мутации типа А→а аллелей, детерминирующих «пластинковые фенотипы», происходят независимо в разных пресноводных популяциях. Меланизм по брачной окраске Gasterosteus aculeatus наследственно детерминирован (см. раздел 4.5.1 ) и возникает в разных местах по Тихоокеанскому побережью Сев. Америки (McPhail, 1969; Hagem, Moodie, 1979; Bell, 1984); следовательно, мутации «меланизма» независимо происходят в разных участках ареала Gasterosteus aculeatus, хотя экспериментально действие мутационного процесса не изучено. Белл (Bell, 1976а) показал, что популяционные волны (пульсации ареала trachurus), происходящие в плейстоцене вследствие температурных колебаний, могли привести к современному фенотипическому разнообразию пресноводной формы Gasterosteus aculeatus на Тихоокеанском побережье Сев. Америки.
Действие изоляции как эволюционного фактора изучено на колюшках значительно лучше, чем действие популяционных волн. Существуют 2 типа доказательств действия изоляции: 1) исследование фенотипического разнообразия пресноводных колюшковых в местообитаниях, освободившихся от ледника в известное время; 2) экспериментальное вселение основателей в изолированные водоемы в недавнее время. Понятно, что первый тип доказательств является косвенным, второй тип — высокодостоверным, но естественно, что за короткое время изоляции трудно ожидать существенных генотипических сдвигов в популяции. Рассмотрим первый тип доказательств.
Муди и Реймчен (Moodie, Reimchen, 1976b) привели геологические доказательства, что озера островов Королевы Шарлотты (Тихоокеанское побережье Канады), ныне населенные Gasterosteus aculeatus, были покрыты льдом во время последнего оледенения 8—10 тыс. лет назад. Возраст оледенения определен радиоуглеродным методом. Современные популяции Gasterosteus aculeatus этих озер представлены морфами leiurus и hologymna (лишенные пластин вообще), а также колюшками, в ряде популяций лишенными тазового пояса, брюшных колючек и двух передних спинных колючек. Авторы заключают, что эти популяции эволюционировали in situ после отступления; ледника и вторичной колонизации морской формой trachurus. Дивергенции популяций способствовало наличие хищных рыб (лососевых) в одних озерах и их отсутствие в других, так что в ряде популяций колюшки имеют крупные размеры тела — до 12 см, длинные брюшные и спинные колючки (антихищнические адаптации), а в других — наружный скелет почти полностью утерян. Белл (Bell, 1974) сообщил, что у ряда популяций Gasterosteus aculeatus с о. Тексадо (650 км от островов Королевы Шарлотты) имеются сходные фенотипы leiurus и hologymna и наблюдается утеря колючек, но этот остров освободился от ледника 5 тыс. лет назад. Эти данные позволяют предполагать, что изоляция в пресноводном водоеме части морской популяции trachurus приводит к становлению мономорфизма малопластинковых и даже беспластинковых фенотипов за период в несколько тысячелетий. Однако механизм этого становления остается пока неизвестным.
Пенчак (Penczak, 1965, с. 23) обнаружил, что в Польше в прудовом хозяйстве «Вильчак» около г. Быдгощ обитала морфа trachurus (как и в соседних реках) и в 1937 г. в популяции Gasterosteus aculeatus не было найдено других морф. Однако около 30 лет спустя Пенчак обнаружил в ней 10 % semiarmatus и leiurus. Поскольку в Польше в целом морфа trachurus составляет 97.26 %, semiarmatus 1.83, a leiurus только 0.42 % (всего исследовано 2122 особи), то все leiurus Польши локализованы в этом пруду. Пенчак, делает, на мой взгляд, неверный вывод, что leiurus и semiarmatus мигрировали в Польшу из Германии, где доля leiurus и semiarmatus значительно выше, чем в Польше. Я полагаю, что в пруду «Вильчак» эти 2 формы образовались in situ в результате изоляции.
Мюнцинг (Münzing, 1963) предложил два возможных механизма образования мономорфных популяций leiurus в пресноводных водоемах: 1) миграция смешанных (триморфных) популяций из моря в пресный водоем и последующая селекция морфы leiurus; 2) мутация морфы trachurus — уменьшение числа боковых пластин — с последующим отбором leiurus.
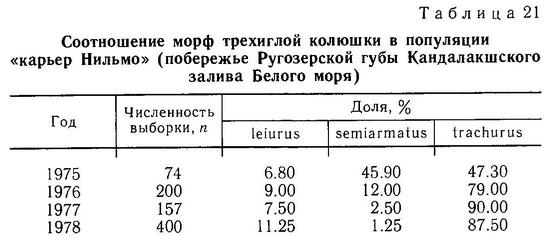
Нами предложен иной механизм возникновения и становления мономорфизма leiurus в пресноводных водоемах, который выдержал экспериментальную проверку (Зюганов, 1978, 1980, 1982, 1983а, 19836). Отправной точкой для гипотезы послужила находка в 1977 г. в бассейне Белого моря (побережье Кандалакшского залива) изолированного пресноводного водоема — карьера «Нильмо», где ранее добывали слюду, и затопленного грунтовыми водами в 1940 г. (Зюганов, 1978). По сообщениям местных рыбаков, в него было запущено в 1965 г. несколько десятков морских колюшек. Поскольку морская популяция Gasterosteus aculeatus состоит на 98—99 % из trachurus (Мухомедияров, 1966; Потапова, 1972; Зюганов, 1978), то и основатели, надо полагать, были представлены этим фенотипом. В 1975—1978 гг. популяция «карьер Нильмо» была уже триморфной, соотношение морф дано в табл. 21. Очевидно, полиморфизм в этой популяции является результатом выщепления морф leiurus и semiarmatus при вселении trachurus в изолированный водоем. Позже (Зюганов, 1983г) была исследована генетика «пластинкового» полиморфизма Gasterosteus aculeatus в бассейне Белого моря и сделаны экспериментальные вселения морских основателей trachurus в пресноводные изолированные водоемы, где и происходило сходное расщепление в течение 1—2 поколений и постепенное увеличение частоты leiurus и semiarmatus (табл. 22—25). Все эти факты позволяют предложить механизм возникновения и становления мономорфизма leiurus в пресноводных изолятах.
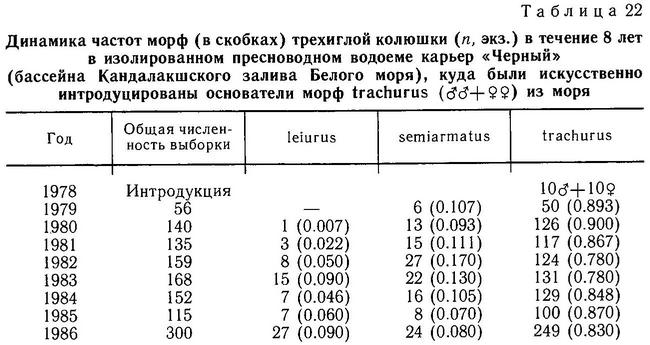
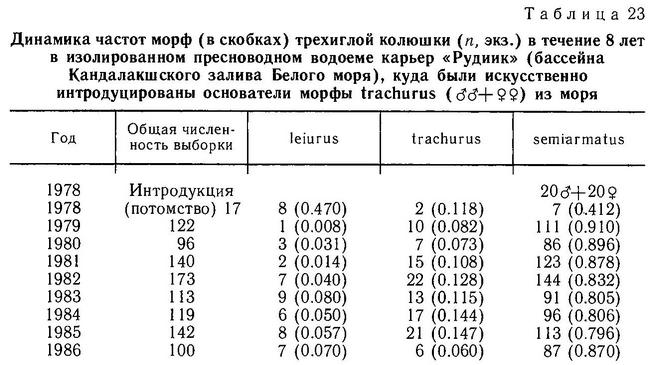
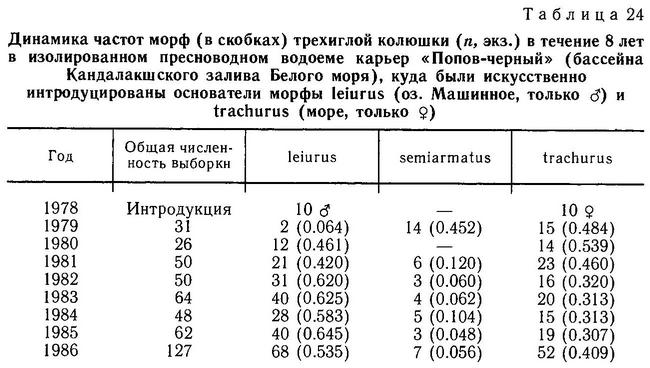
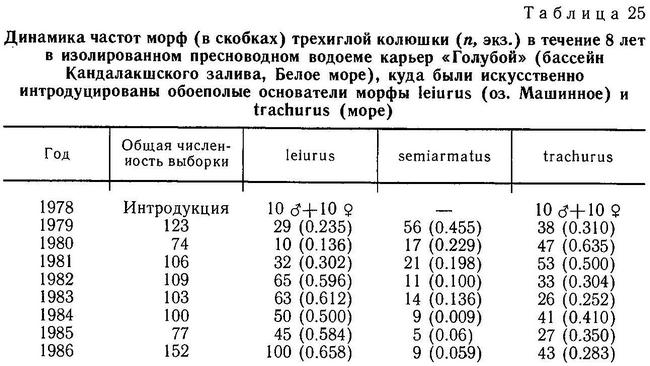
При колонизации небольших изолированных пресных водоемов основателями морской trachurus резко повышается вероятность перехода рецессивных аллелей в гомозиготное состояние и выщепляется морфа leiurus, отбор которой в пресной воде, очевидно, благоприятствует. Происходит смена направления давления отбора. Дело в том, что рыбам в морской и пресной воде приходится решать диаметрально противоположные осморегуляторные проблемы: в морской воде выводить соли из тела против градиента и поглощать воду, а в пресной — поглощать соли и выводить воду из тела. Видимо, костные пластины плейотропно связаны с особенностями осморегуляции. Было показано, в частности, что верхним пределом активации спермиев морской trachurus является соленость 52 ‰, a leiurus соответственно 16‰ (в Белом море соленость 26 ‰) (Зюганов, Хлебович, 1979; Зюганов, 1981а, 1981б, 1983в, 1985б). Однако мы до сих пор не знаем точного механизма действия отбора, регулирующего частоты аллелей «А» и «а» в пресной воде. Возможно, фенотип leiurus селективно выгоден в слабоминерализованной и бедной кальцием воде олиготрофных водоемов, так как генотип «аа» — детерминирует редуцированный костный панцирь. Рыбы, представленные этим фенотипом, имеют меньшие энергетические траты на постройку костного панциря, куда входит кальций. Подробнее этот вопрос будет обсужден в разделе 4.5.5.
С течением времени отбор в пресноводных изолированных водоемах оставляет только морфу leiurus. Как видно из предыдущего для этого достаточно времени 5—8 тыс. лет (Bell, 1974). Однако, возможно, скорость становления мономорфизма leiurus еще выше. Так, оз. Машинное (где сейчас обитает мономорфная популяция leiurus), расположенное на побережье губы Чупа Кандалакшского залива Белого моря (Лоухский р-н Карельской АССР), по сообщениям местных жителей, всего 100 лет назад отделилось от моря. Ранее оно было морским заливом. Близость озера к морскому побережью (всего 150 м), его топография, размеры, а также известный факт постепенного поднятия беломорского щита (Авилов, 1966) — все это подтверждает недавнюю изоляцию озера от моря. Поэтому вполне возможно, что всего за 100 лет завершается становление мономорфизма leiurus.
До того как популяция достигнет мономорфизма leiurus и она пройдет более или менее длительную стадию транзитивного (переходного) полиморфизма, на этой стадии есть все три морфы. Превращение полиморфной пресноводной популяции в leiurus носит необратимый характер, как это следует из нашей схемы наследования (Зюганов, 1983 г.), и как это было подтверждено экспериментально обратным вселением «новообразованных» leiurus и leiurus из старой популяции (оз. «Машинного») обратно в морские условия (Зюганов, 1985а).
Примечательно, что на начальных этапах становления leiurus она является не более чем внутривидовой группировкой по отношению к trachurus (они могут быть членами одного помета). Однако эта внутривидовая группировка уже необратима, так как при осолонении водоема не может снова стать морской и вымрет. В то же время trachurus, родившиеся и живущие несколько поколений в пресной воде, могут беспрепятственно вернуться к морскому образу жизни. Ничто так ярко не опровергает широко распространенное в ихтиологии ошибочное мнение по поводу принципиальной разницы между внутривидовыми группировками и видами: «внутривидовые группировки обратимы, а виды нет... видовые различия необратимы, т. е. вид не может в отличие от большинства внутривидовых группировок превратиться в исходный, от которого он произошел (Никольский, 1980, с. 17, 57)», как факт невозможности возврата новообразованной leiurus в море.
Сравнительно длительный период становления мономорфизма leiurus свидетельствует о том, что различия в приспособленности к пресноводным условиям между leiurus и двумя другими морфами относительно невелики. Даже небольшой поток генов trachurus из моря (вторичный контакт) стабильно поддерживает триморфизм в пресноводных популяциях, как это происходит, например, в озерах Клюквенное и Марцы на беломорском побережье (Зюганов, 1978). Искусственно спровоцированный одноразовый контакт между морской trachurus и пресноводной leiurus в изолированных карьерах (Голубой, Попов-черный) (Зюганов, 1982, 1983г) привел к возникновению триморфных популяций в следующем поколении и поддержанию полиморфизма в течение 8 лет слежения за ними (табл. 24, 25). Кроме того, существование нескольких десятков полиморфных континентальных изолированных популяций Gasterosteus aculeatus на Тихоокеанском побережье Сев. Америки (Hagen, Gilbertson, 1972; Bell, 1984) свидетельствует о небольшой величине различий в приспособленности каждой из трех морф к пресноводным условиям и, возможно, говорит о разнонаправленности действия отбора в разных пресноводных местообитаниях, хотя в большинстве этих популяций частота leiurus все же велика: 0.8—0.9.
В некоторых случаях эволюция пресноводных популяций идет еще дальше и leiurus превращаются в морфу hologymna (голая). Жиль (Giles, 1983) сопоставил концентрацию кальция в изолированных пресных водоемах на Гебридских островах (Великобритания) с фенотипической структурой популяций Gasterosteus aculeatus, населяющих эти озера. Оказалось, что мономорфизм hologymna наблюдается в водоемах, где концентрация кальция составляет 0.94—2.5 мг/л, а мономорфизм leiurus — при 1.8—28.3 мг/л (в среднем 13 мг/л). Хотя связй концентрации кальция в водоеме и морфы Gasterosteus aculeatus, там обитающей, не абсолютна, все же видно, что морфа hologymna обитает в водоемах с пониженной концентрацией Са++ примерно в 10 раз по сравнению с местообитаниями leiurus. Ихтиофауна Гебридских островов сформировалась 8—10 тыс. лет назад после отступления ледника в плейстоцене, и Жиль (Giles, 1983) считает, что пресноводные формы Gasterosteus aculeatus сформировались из морской trachurus (сейчас trachurus нет в этих островных водоемах).
По моему мнению, сходным путем leiurus формировалась не только в бассейне Белого моря, но и в других частях ареала Gasterosteus aculeatus. Так, поданным С. В. Марфина (личн. сообщ.), в Ленинградской обл. (в черте г. Ленинграда в р. Неве и на побережье Финского залива) обитает только морфа trachurus с незначительной 0.5—1 %) примесью semiarmatus. Однако в одном изолированном пруду в районе проспекта Славы в черте города в 1984 г. им была найдена морфа leiurus; пруд был изолирован от Невы постройкой дамбы несколько лет назад. Очевидно, что прерывание потока генов trachurus из многочисленной популяции Невы в популяцию малого водоема привело к выщеплению и накоплению частоты leiurus.
Белл и Баумгартнер (Bell, Baumgartner, 1984) описали Gasterosteus aculeatus из небольшого пруда (10х26 м) близ г. Бостон (штат Массачусетс, США) на Атлантическом побережье США. В этой прудовой изолированной популяции доля leiurus составила 13.5 %, semiarmatus 1.7 и trachurus 80.9 %. Этот пруд расположен в бассейне р. Мадди, в которой Gasterosteus aculeatus не найдена вообще. Однако на восточном побережье Сев. Америки подавляющее большинство популяций пресноводных Gasterosteus aculeatus представлено морфой trachurus (за тремя исключениями — Bell, 1984). Очевидно, именно изоляция в малом водоеме части популяции trachurus привела к выщеплению leiurus, хотя Белл (Bell, 1984), на мой взгляд, ошибочно полагает, что дрейф генов привел к полиморфизму в этой прудовой популяции. Выше уже приводились данные Пенчака (Penczak, 1965), обнаружившего возникновение морфы leiurus через 30 лет после изоляции прудовой популяции, хотя вокруг существовали многочисленные популяции trachurus. Поэтому наша концепция «прохождения узкого горлышка» численности морской trachurus в пресной воде, приводящая к выщеплению leiurus, применима и к другим районам ареала Gasterosteus aculeatus. Хаген и Моди (Hagen, Moodie, 1982) предприняли попытку объяснить распределение морфы leiurus в пределах всего ареала. Они нашли, что leiurus имеет тенденцию к отсутствию в тех местах, где есть холодные зимы и выражена большая разница между среднеянварскими и среднеиюльскими температурами. Они полагают, что leiurus получает преимущество в тех местах, где климат теплый или умеренный и где внутригодовые колебания температур невелики, в то время как trachurus получает преимущество там, где колебания годовых температур сильны. В подтверждение своей гипотезы они приводят карту распространения форм с зимними и летними изотермами. Их модель хорошо объясняет в целом североамериканское и западноевропейское распространение форм Gasterosteus aculeatus, но авторы, к сожалению, игнорировали данные по восточноевропейскому и восточноазиатскому распространению leiurus в водоемах СССР. Известно, что многочисленные мономорфные популяции leiurus обитают в Карелии, на Кольском полуострове, Камчатке (Берг, 1949; Потапова, 1972; Зюганов, 1978, 1980). Хаген и Муди (Hagen, Moodie, 1980) игнорируют эти многочисленные исключения под тем предлогом, что «локальный климат» в этих местах может быть иным, т. е. более теплым, нежели в окружающих районах с суровым климатом и большим перепадом зимне-летних температур. Однако, судя по нашим собственным наблюдениям (Зюганов, 1980), поверхностная температура воды в озерах Мурманской обл. и Карелии, где обитают мономорфные популяции leiurus, достигает в июле 15—18 °С, а сами водоемы замерзают с ноября по конец мая (температура воды около 0°С). Таким образом, налицо и резкий перепад зимне-летних температур, и суровый «локальный» климат. То же самое можно сказать относительно мономорфных популяций leiurus в водоемах Камчатки. Хагену и Муди (Hagen, Moodie, 1982) из данных Потаповой (1972) было известно одно исключение — мономорфная популяция leiurus из оз. Дальнего. Эти авторы, а вслед за ними и Белл (Bell, 1983) полагают, что это озеро теплое, когда на самом деле оно замерзает более чем на полгода и летом температура воды в нем 15—18 °С (Крохин, 1970). Недавно было найдено несколько мономорфных озерных популяций leiurus в бассейне р. Камчатки, в частности в оз. Азабачьем (Зюганов и др., 1987). И для этого озера имеются температурные данные (Крохин, 1970), указывающие на холодный климат и наличие ледового покрова с середины ноября по середину июня (7 мес).
Поэтому из климатической закономерности, подмеченной Хагеном и Муди (Hagen, Moodie, 1980), имеется слишком много исключений, чтобы считать ее всеобщей, и популяции leiurus существуют, таким образом, не только в теплом и умеренном климате, но и в условиях сурового климата Севера.
Судя по всему, границы ареала Gasterosteus aculeatus, а также формообразование внутри этого таксона контролируются комбинацией таких важнейших абиотических факторов, как температура, соленость, минеральный состав воды, причем в разных частях ареала относительный вклад каждого из них варьирует. Баумгартнер и Белл (Baumgartner, Bell, 1984) выявили еще один абиотический фактор, влияющий на распределение морф Gasterosteus aculeatus. Для рек и ручьев Калифорнии они обнаружили, что жилая trachurus встречается на участках с большим перепадом высот (быстрое течение), a leiurus на участках с медленным течением. В этой части побережья штата Калифорния нет морской trachurus, и поэтому распределение двух морф в текущих водоемах выглядит необычным: trachurus обитают в верховьях рек и ручьев, a leiurus — в низовьях, устьях ручьев и лагунах.
Окраска. Меланизм брачной окраски самцов Gasterosteus aculeatus отмечен для небольшого числа популяций (см. раздел 1.4) островов королевы Шарлотты (Moodie, 1972а, 1972b) и материковой Британской Колумбии (McPhail, 1969; Hagen, Moodie, 1979; Hagen et al., 1980). Семлер (Semler, 1971) отмечал аналогичный меланизм для популяции оз. Вапато (штат Вашингтон, США), где популяция была полиморфна: «красные» и «не красные» самцы, а Белл (Bell, 1982) отмечал меланизм для одной высокогорной калифорнийской популяции и нашел такой же полиморфизм, что и Семлер (Semler, 1971). Однако все отмеченные случаи меланизма по брачной окраске локализованы на Тихоокеанском побережье Сев. Америки.
Хаген и соавт. (Hagen et al., 1980) в эксперименте показали, что «черные» самцы Gasterosteus aculeatus имеют больший успех в охране гнезд, чем «красные», поскольку территориальные самцы Novumbra существенно чаще вторгались на участки хорошо заметных «красных» самцов. Однако в отсутствие Novumbra «red»-самцы захватывают большую гнездовую территорию, чем «black»-самцы и, следовательно, имеют больший репродуктивный успех. Авторы объясняют возникновение и эволюцию «черносамцовых» популяций Gasterosteus aculeatus как конвергенцию брачной окраски колюшки с таковой Novumbra, что облегчает оборону гнездовой территории. Муди (Moodie, 1972b) показал на черносамцовой популяции оз. Майер (острова Королевы Шарлотты), что хищные лососевые рода Salmo чаще атакуют искусственно окрашенных помадой «красных» самцов, чем «черных». Однако Семлер (Semler, 1971) на популяции оз. Вапато (штат Вашингтон) показал, что самки при нересте оказывают предпочтение искусственно окрашенным помадой «красным» самцам, чем «черным». Очевидно, полиморфизм в полиморфных по окраске самцов популяциях может поддерживаться разнонаправленными силами: преимуществом «красных» самцов во время половой фазы нереста и преимуществом «черных» самцов во время родительской фазы нереста при симпатрии с хищниками или конкурентами, такими как Novumbra.
У Gasterosteus aculeatus и Pungitius sinensis фенотип trachurus составляет непрерывный ряд пластин на теле и киле в количестве в среднем 34 (суммарно). У обоих видов закладка пластин начинается при длине рыбы 15—20 мм и заканчивается при 35—40 мм (Igarashi, 1962, 1964, 1965). Однако если у Pungitius sinensis закладка пластин начинается с хвостового киля и продолжается по направлению к голове, то у Gasterosteus aculeatus формирование подобного полного ряда пластин идет иначе. Начинается одновременная закладка 4 пластин в передней части тела. От этих образований закладка продолжается и к передней, и к задней части тела. В итоге тело полностью покрывается пластинами. На хвостовом стебле независимо появляется другой центр закладки (при длине рыбы 20 мм). Затем ряд пластин нарастает по направлению к переднему отделу тела, и при длине рыб 40 мм пластины на теле и киль соединяются. Существование 2 центров формирования пластин, по мнению Игараши (Igarashi, 1964), «совершенно уникальный пример в сравнении со многими другими костистыми рыбами». Таким образом, к одному и тому же фенотипу у Gasterosteus и Pungitius ведут разные пути онтогенеза. Поэтому проверка по этому критерию приводит к выводу о ложной гомологии, к выводу о конвергентном сходстве.
Неорганическая часть наружного костного скелета в значительной степени состоит из кальция, и у морских колюшек нет проблем для постройки полного ряда боковых пластин в сильноминерализованной и богатой кальцием морской воде (400 мг/л Са++ при солености 35 ‰, — Попов и др., 1979). По-другому обстоит дело в слабоминерализованных пресных олиготрофных водоемах (1—30 мг/л Са++) (Giles, 1983). Там значительное селективное преимущество получит фенотип leiurus с редуцированным рядом костных щитков, поскольку в слабоминерализованной воде, бедной кальцием, резко возрастают энергетические траты на постройку массивного костного панциря. Большинство авторов, пытавшихся объяснить адаптивный смысл полиморфизма по числу пластин у Gasterosteus aculeatus, считало, что гены, детерминирующие этот признак, плейотропно детерминируют какие-то иные, важные в адаптивном отношении черты (осморегуляционные и температурные адаптации, черты поведения, помогающие эффективно избегать хищников, и другие) (Wootton, 1976). Жиль (Giles, 1983), один из немногих, связывает полную редукцию боковых пластин у трехиглой колюшки Гибридских островов с низким уровнем кальция в озерах.
Мы полагаем, что морским популяциям колюшек «выгодно» иметь гетерозиготность по гену «А», контролирующему закладку боковых пластин, так как при освоении пресных вод и при образовании жилых пресноводных изолированных популяций отбор будет благоприятствовать морфе leiurus (генотип «аа»). Колюшкам этой морфы легче набрать из пищи и окружающей воды, бедной кальцием, необходимое количество ионов кальция для постройки редуцированного ряда боковых пластин, чем колюшкам морфы trachurus.
В своей работе «Проблема вида у Gasterosteus aculeatus на Тихоокеанском побережье Северной Америки» Хаген и Мак-Фейл (1970, с. 154) ставили вопрос: «Одно и то же Gasterosteus aculeatus в Европе и Америке?». Мне кажется, на этот вопрос можно дать следующий ответ: «Да, морская trachurus и в Европе, и в Америке, и в Восточной Азии одно и то же». На удивительное однообразие и стандартность фенотипа trachurus у морских колюшек из разных морей обращал внимание еще Берг (1949). Действительно, по данным всех авторов, изучавших фенотипическую изменчивость trachurus, число пластин у этой формы колеблется от 30 до 35 (Ikeda, 1934; Heuts, 1947b; Münzing, 1963; Igarashi, 1970; Hagen, 1967; Miller, Hubbs, 1969; Igarashi, 1970; Hagen, Gilbertson, 1972; Coad, Power, 1973a; Bell, 1982; Paepke, 1982), всегда есть киль, всегда есть 3 колючки, pelvis, тело стандартной веретенообразной формы, относительно много жаберных тычинок. Судя по палеонтологическим данным (Bell, 1977), морская trachurus морфологически почти не изменилась с позднего миоцена. В любом море экологическая ниша у trachurus всегда одна и та же — планктофаг (отсюда большое число жаберных тычинок), пелагический образ жизни детерминирует веретенообразную форму тела.
Таким образом, морские условия поддерживают жесткий стабилизирующий отбор, действующий на морскую форму.
Иначе обстоит дело с пресноводной формой. Ясно, что генофонды популяций leiurus в разных географических точках далеко не идентичны, однако в каждой такой популяции зафиксированы аллели, определяющие число боковых пластин, характерное для leiurus. По существу leiurus из разных местообитаний и из разных районов объединяет только один признак — «уменьшенное число боковых пластин». Но этот признак — «признак-редукция», «признак-утрата». Майр (1971, с. 255) совершенно справедливо подчеркивал, что признаки-утраты имеют малый таксономический вес, поскольку утраты могут произойти независимо в филетических линиях, связанных более или менее отдаленным родством. Таксоны, основанные на утрате глаз, жилок крыла, пальцев, сегментов и т. д., нередко оказываются неестественными. По существу у leiurus из разных районов происходят независимо утраты не только боковых пластин, но и колючек спинных, брюшных, тазового пояса, красной брачной окраски, солеустойчивости и т. п. В то же время у leiurus варьируют форма тела, число жаберных тычинок, окраска, размеры тела и многие другие, признаки. Таким образом, leiurus из Америки и leiurus из Европы — не одно и то же.
В настоящее время трехиглую колюшку обозначают как таксон Gasterosteus aculeatus species-complex (Wootton, 1976; Nelson, 1977; Bell, 1984), с чем я согласен, поскольку ни объединение в один вид (Gasterosteus aculeatus), ни раздробление на ряд самостоятельных видов не соответствовало бы действительности.
Иллюстрированная энциклопедия рыб. Ст.Франк 1983 г.
Трехиглая колюшка (Gasterosteus aculeatus) живет у побережья Европы oт Черною моря до Новой Земли, в Тихом океане от Берингова пролива до Кореи и по американскому побережью до Калифорнии. Максимальный размер до 10 см. У этой рыбы весьма различное число шипов в спинном плавнике и костных пластинок, покрывающих тело. В Финляндии ловится как корм для домашней птицы. В период размножения самцы приобретают пеструю окраску. Из обломков растений строят себе гнездо, куда самка откладывает 90 - 250 икринок. Заботу об икре и молоди берет на себя самец. Трехиглая колюшка часто содержится аквариумистами, и была также запущена во внутренние водоемы ряда стран, где живет и размножается в пресной воде.
Словарь названий пресноводных рыб СССР. Г.У.Линдберг и А.С.Герд 1972 г.
20.1.1. Gasterosteus aculeatus Linne, 1758 — Трехиглая колюшка (Б. : 972).
[1] русск. Белая колюшка одесск., Волчок нск. — Кессл., 1864 : 39. Игла-рыба Анадырь: Марково — Мельн. : 74. Колкуха Пек. и Чудск. оз.: Казапель, Шиловщина, Сыренец, Колкуша Пек. и Чудск. оз.: Казапель, Шиловщина, Сыренец, Колкушка Пек. и Чудск. оз. — Кузн., 1915. Колуха Волхов — Домр, и Правд. : 261. Колушка Пек. и Чудск. оз. — Кузн., 1915. Колючка Амур — Б., 1909 : 194. Корос Белое м. — Б., 1916 : 463. Костюшка зап. — Зол. Костянка Пек. и Чудск. оз. — Кузн., 1915. Околуха н. т. Волхова — Домр, и Правд. : 261. Рогатка — Гр. : 230. Синюга р. Пинега, Синюха р. Пинега — ПК. Трехиглая колюшка — Кессл., 1864 : 39. Хохалча зап.: вилен. — Зол. Хохол вилен. — Гр. : 230. Хохолча — Варп., 1898 : 24. ~ Колюшка — Озерецк., 1791 : 61; Блуменбах : 393; Двиг. : 134; Теряев : 49; Чернай : 37. [2] укр. Бiла колючка одесск., Звичайна колючка, Iглиця, Колючка, Косика, Острик, Остряк, Рогатка, Рогачка, Сяник, Терниста колючка — Тат. : 86. Триголкова колючка — Марк. : 152. Чортик Днестр — Тат. : 86. [3] белор. Волчок, Колюшка — Жуков : 90. [4] польск. Cierniczek — Majew. Ciernik — Majew.; Staff : 250. Jazwica, Jazwiec, Kacik — Majew. Kat — Majew.; Staff : 250. Kolczyk — Majew. Kolka — Majew.; Staff : 250. Koluszczka, Siek — Majew. Stacklack мазур., Stekbydd кашуб. — Benecke : 73. [5] чеш. Triostna koljuska — Hrabe : 43. [7] болг. Бодливка, Къдринка — Дренски : 156. [8] сербскохорв. Bodica, Bodonja, Koljuska, Kulja, Kulja riba, Zet, Zubaljic — Hirtz. [13] лит. Badozuris, Dyge, Dygle, Dyglys, Dygutis, Gelzinis, Kartienelis, Stakelinskes, Stege, Stegis, Stregis, Vilkutis — Majew. [14] дат. Hundestejle — Hoek : 28; Names of fishes : 40. Stingsild — O-n : 120. Treppigget — Names of fishes : 40; O-n : 120. [15] шведск. Spigg — Hoek : 28. Storspigg — Hoek : 28; Names of fishes: 41; O-n: 120. [16] норв. Stikling — Hoek : 28. Stingsild — Names of fishes: 41; O-n : 120. Strospiggen — Smitt: 647. Treppigget — O-n : 120. [17] исл. Hornsili — Names of fishes : 41. [18] англ. Stickleback — Poll: 354; Names of fishes : 40; O-n : 120; Канада — Ricker : 51. Threespined Stickleback — Hoek : 28; Smitt: 647; Канада — Ricker : 51. Tittlebat — Poll : 354. [19] нем. Dreistacheliger Stickling — Hoek : 28. Gemeine stichling — Benecke : 73. Grosser — Names of fishes: 41. Stachelbauch, Stachlinski, Stechbuttel, Stecherling, Stechert, Steckbedel, Steckbudel, Steigbudel, Stichbeutel — Benecke : 73. Stichling — Hoek : 28. Stichlinski — Benecke : 73. Zwegstichling — O-n : 120. [20] голланд. Driedoornige, Stekelbaars, Kraaivisch, Paddesteker, Stekebak, Stekel, Stekelbaars, Stekelspoor — Poll: 354. [21] флам. Stekelbat — Hoek : 28. [22] франц. Epinoche — Poll: 354; O-n : 120. Epinoche aiguillonne — Hoek : 28. Epinochette — O-n : 120. Epinoke валл., Espinoke валл., Pepinoke валл., Quoue d'aweye валл., Spernoke валл., Spina валл., Spinette валл., Spinoke валл., — Poll: 354. Troies-espines — Hoek : 28. [23] итал. Gasterosteo, Scannavattolo Неаполь, Scardafisso, Scardapesce Неаполь, Scoppeti, Spinarella, Spinarola, Stratzariglia — Costa, II: 5. [25] португ. Esganagata, Espinhela, Espinho — Nobre : 294. [36] финск. Kolmepikkinen — O-n : 120. Kolmipiikki — Brofeldt: 158. Piikkikala — Hoek : 28. Rantakala — Кессл., 1864 : 39; Б., 19406: : 24. Rautakala — O-n : 120. [37] карел. Rabdakala — Паллон : 5. [381 эст. Ogalik — Б., 19406:24. [39] саам. Ruovdde-cilla, Ruovdde gulmek, Ruovdde laiggo — Qvidstad : 376. [66] чукот. Тытэ-нальгын — Мельн. : 74. [68] нивх. Машксо Сахалин — Тар., 19376 : 42.
Жизнь животных. Том 4. Рыбы Под редакцией профессора Т.С.Расса 1971 г.
В пределах СССР обитает один
вид — трехиглая колюшка (Gasterosteus
aculeatus).
Тело у трехиглых колюшек
сравнительно высокое, сжатое с боков, с коротким
хвостовым стеблем. Вместо чешуи бока
тела покрыты костными пластинками,
как панцирем. Голова заостренная. Рот
конечный, умеренной величины.
Жаберные перепонки приращены к
межжаберному промежутку, не образуя складки
поперек него. Перед спинным плавником
три больших шипа. Брюшные плавники
превращены в шипы. Спинные и брюшные
шипы в поднятом положении замыкаются
особой защелкой и представляют собой
грозное оружие. Трехиглые колюшки
живут в море и в пресных водах; живущие
в море обычно крупнее пресноводных,
сильнее вооружены, боковые кили на
хвостовом стебле хорошо развиты,
костные пластинки на боках тела образуют
полный ряд; у пресноводных форм эти
пластинки имеются только возле головы
и на хвостовом стебле.
Длина трехиглой колюшки в Белом
море до 9 см (обычно средний размер
самцов 6,5 см, самок — 7,5 см), а в Тихом
океане у Камчатки — до 10—11 см. В
пресных водах и в более южных районах
длина обычно не более 4—6 см.
Окраска изменчива: зеленовато-бурая
у пресноводных форм и от
серебристо-зеленой до синевато-черной у морских; у
молодых — серебристая. Весной, в период
нереста, у самцов грудь и брюхо
становятся ярко-красными, спина изумрудно-зеленой, глаза ярко-синими. У самки на
боках тела появляются темные полосы
и серебристо-белая нижняя сторона
становится бледно-желтой.
Трехиглая колюшка одинаково хорошо
живет в морской и пресной воде. Широко
распространена у берегов северных частей
Атлантического и Тихого океанов.
Встречается у берегов Мурмана и в Белом море,
но вдоль всего побережья Сибири ее нет.
Обычна у берегов Европы от Черного и
Средиземного морей до Балтийского, у
Фарерских островов, Исландии,
Гренландии; у берегов Америки от Гудзонова
залива до Нью-Джерси. В Тихом океане от
Берингова пролива на юг до Кореи и
Калифорнии.
В Белом море трехиглая колюшка —
настоящая морская пелагическая рыба.
В Кандалакшском заливе вскоре после
вскрытия моря, в конце мая, она в
огромных количествах подходит к берегам.
Местами в период массового подхода
колюшки вода буквально чернеет от
сплошной массы рыбок, толпящихся у берега.
В это время небольшим тягловым неводком можно вылавливать по тонне рыбы
за полчаса.
В течение всего июня колюшка
буквально заполняет всю береговую линию и
держится узкой лентой у самого берега.
Сначала к берегам подходят только самки.
В середине июня появляются самцы,
начинается строительство гнезд и нерест.
Хотя плодовитость колюшки по
сравнению с другими рыбами ничтожно мала
(от 65 до 550 икринок), но благодаря
тщательной заботе о потомстве
процент выживания мальков очень велик.
В конце июля появляются мальки; в
августе они держатся стайками в зарослях
морской травы, у берегов, и быстро
растут. В августе начинается отход колюшек
в море, причем сначала отходят самки,
потом самцы, а в начале сентября исчезает и молодь. В августе многочисленные
стайки колюшек встречаются по всему
Белому морю, даже в наиболее удаленных
от берега местах. Зимуют они, вероятно,
на глубине 15—30 м, где долго
сохраняются прогретые за лето слои воды.
Нерест колюшки происходит у берегов,
в опресненной зоне и в пресных водах
ручьев и речек.
В период размножения самцы очень
драчливы и драки между ними часто
кончаются смертью: один из противников
оказывается буквально распоротым
острыми шипами.
Весной самец строит на дне гнездо на
тихой отмели, между стеблями водных
растений, где имеется постоянное, но не
слишком сильное течение. Он собирает
туда обрывки водных растений и разные
растительные остатки, скрепляет их
клейкими нитями и прикрепляет к стеблям
растений. Время от времени он
осматривает свое сооружение, как бы пробует его
прочность, трется боками о стенки,
соскребая слизь, которая служит
«штукатуркой» для отделки «помещения». Он
приносит также камешки, чтобы загрузить
постройку и придать ей устойчивость.
На постройку гнезда иногда
затрачивается всего 2—3 часа, но часто
сооружение его занимает неделю и больше.
Размеры гнезд очень различны: иногда гнездо
размером с грецкий орех, но может быть
и с небольшую чайную чашку. Потом
самец загоняет в гнездо самку. За несколько
секунд пребывания в гнезде самка
откладывает до 100 икринок. Как только она
вымечет икру, самец ее выгоняет,
оплодотворяет икру и через некоторое время
отправляется на поиски другой самки,
чтобы добавить еще икры к уже
отложенной в гнезде. Этот процесс повторяется
2—3 раза, пока не наберется достаточное
количество икры, обычно 150—180
икринок. После этого самец бдительно
охраняет гнездо, яростно набрасывается на
всех приближающихся к нему,
ремонтирует его, очищает и аэрирует икру,
обмахивая ее своими грудными плавниками,
создавая приток свежей воды. Развитие
икры продолжается от 8 дней до двух
недель, в зависимости от температуры воды.
Когда появятся мальки, самец разбирает
крышу гнезда, превращая его в подобие
колыбели. Иногда он продолжает
заботиться о мальках еще с месяц после того,
как они выведутся, охраняет их и не дает
им расходиться от гнезда, пока они не
подрастут. Но в конце концов он
перестает ими интересоваться и может по
рассеянности съесть часть своего потомства.
Мальки до осени держатся стайками у
берегов в зарослях морской травы, а потом
уходят в более глубокие места.
Продолжительность жизни трехиглой
колюшки 3—4 года, половозрелости она
достигает на юге к концу первого года
жизни, а в Белом море обычно в
трехлетнем возрасте.
Колюшка способна издавать
скрежещущие или стрекочущие звуки.
Несмотря на малую величину,
вездесущая колюшка очень дерзка и
прожорлива. Питается она мелкими
ракообразными, личинками насекомых, червями,
икрой и мальками других рыб. Отмечен
случай, когда за 5 часов одна колюшка
сожрала 74 малька язя, каждый длиной
около 6 мм, а через два дня проглотила
еще 62. Поедая планктон, она является
конкурентом сельди. С другой стороны,
колюшка сама служит пищей для
водоплавающих птиц, многих рыб и морских
котиков. В Белом море в период
икрометания ею питается треска. Беломорская
треска в это время даже ведет
пелагический образ жизни, поднимаясь за своей
добычей к поверхности воды. Желудки
трески бывают сплошь набиты колюшкой.
Позже в них начинает попадаться
значительное количество икры колюшки, а
еще позже, в июле,— мальки. Врагами
мальков являются также крупные медузы
(Cyanea arctica); находили их и в
желудках сельди.
Во многих местах колюшки сильно
заражены глистами. Они являются
промежуточным хозяином для ленточных глистов
(Schistocephalus spp. из Cestoda), которые
на личиночной стадии вырастают до очень
больших размеров в полости тела рыб и
превращаются во взрослых в кишечнике
питающихся рыбой птиц.
В рыбном хозяйстве колюшка —
типичная «сорная рыба». Хозяйственное
значение невелико, хотя жир ее может
применяться в медицине, кулинарии, а также
для производства линолеума, некоторых
лаков и других продуктов. В Англии,
Голландии, Германии, Прибалтике, Швеции и Финляндии вылавливают
значительное количество трехиглой колюшки. Из
нее приготовляют рыбную муку,
вытапливают жир, который идет для
технических целей, а также используют колюшку
для откорма рыбы в прудах, кур, уток,
свиней и на удобрение. Во время блокады
во многих столовых Ленинграда и
Кронштадта из колюшки готовили супы,
рыбные котлеты и другие блюда.
Ярко-оранжевый жир колюшки содержит около
5 мг% каротиноидов; применение его для
лечения ран дало отличные результаты.
Рыбы Японского моря и сопредельных частей Охотского и Желтого морей. Часть 2. (Acipenseriformes — Polynemiformes). Г.У.Линдберг, М.И.Легеза 1965 г.
1. Gasterosteus aculeatus Linne, 1758 — Трехиглая колюшка (рис. 241).
Gasterosteus aculeatus Linne, Syst. Nat., ed. X, 1758 : 295. — Берг, Рыбы пресных вод, 3, 1949 : 972 (описание, синонимия). — Matsubara, Fish Morphol. a. Hierar., 1955 : 408. — Ильин, Промысловые рыбы СССР, 1949 : 533—535; атлас, табл. 162.
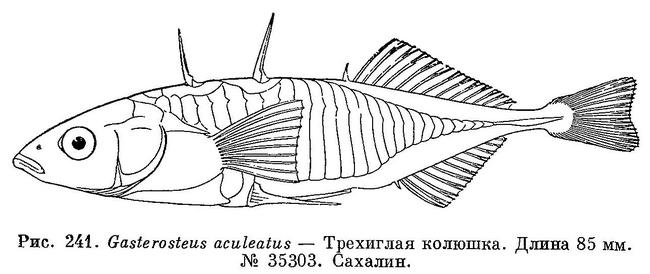
D III (Как исключение II, IV, V.) (9) 10—14, А I (7) 8—10 (11), V I 1, Р 10—11.
На спине впереди спинного плавника обычно 3 колючки. Первая колючка сидит над основанием грудного плавника и впереди брюшной колючки. Тело покрыто то большим, то меньшим количеством костяных пластинок (до 35), образующих на хвосте более или менее ясный киль. Брюшная колючка без бугорка при основании. Рыло короче заглазничного отдела головы.
Вид этот подвержен многочисленным вариациям в отношении развития боковых пластинок, количества спинных колючек, высоты их, длины брюшных колючек, степени развития хвостового киля и т. п. (Берг, 1949 : 973). Мацубара (Matsubara, 1955 : 408) принимает существование 2 подвидов Gasterosteus aculeatus aculeatus и Gasterosteus aculeatus microcephalus в водах Японии.
Длина до 75—80, иногда до 110 мм.
Распространение. В Японском море почти повсеместно: Татарский пролив, Приморье, зал. Петра Великого (наши данные), Унги, Воньсань, Каннын, Пусань (Mori, 1952 : 73), северная Япония, район Ниигаты (Honma, 1952 : 142), зал. Тояма (Katayama, 1940 : 7), р-н Санин (Katoh et all., 1956 : 315; Mori, 1956 : 10), Хамада (Matsubara, 1955 : 408); южнее не указан. В Желтом море тоже не указан. В Тихом океане у берегов Японии от р. Тонегава (севернее Токио) на север. Охотское и Берингово моря; у берегов Северной Америки на юг до Калифорнии; северная часть Атлантического океана. (Берг, 1949 : 975).
Рыбы северных морей СССР. А.П.Андрияшев 1954 г.
1. Gasterosteus aculeatus Linne — Трехиглая колюшка, на Белом море — корос, карас (рис. 99).
Gasterosteus aculeatus Linne, 1758 : 295 (Европа). — Smitt, Scand. Fisb., II, 1895 : 647, fig. 158—162, pl. XXVIII, fig. 1—2. — Knipowitsch, Ежег. Зоолог. муз. Акад. Наук, II, 1897 : 152 (Кольск. зал., Белое м., Нов. Земля). — Bertin, Ann. Inst. Oceanogr., Paris, II, 1, 1925 : 153 (библиография, полиморфизм, распространение, биология). — Hubbs, Осс. Pap. Mus. Zool. Michig., 200, 1929 : 1—9, 5 fgs. (сравнение с Gasterosteus wheatlandi Putn.). — Гуpвич, Природа, 7—8, 1938 : 140 (Белое м.; биология). — Гербильский и Европейцева, Рыбн. промышл. СССР, 1, 1945 : 52 (лечебная ценность жира). — Ильин в изд.: Промысл. рыбы СССР, 1949 : 533, атлас табл. 162, цветн. рис.). — Берг, 1949 : 972, фиг. 702—708.
Gasterosteus aculeatus. А. В. Подлесный и А. А. Лобовиков (Вопр. геогр. Сибири, 2, 1951 : 270) ошибочно указывают для Таймырского озера трехиглую колюшку (Gasterosteus aculeatus) вместо распространенной там девятииглой колюшки (Pungitius pungitius). Исследовавший это озеро В. С. Михин подтверждает отсутствие в нем трехиглой колюшки, ареал которой строго амфибореален. Н. А. Дмитриев (Природа, 1, 1953 : 106) указывает, что в последнее время наша промышленность предъявляет требования, на жир колюшки, который имеет лечебное значение, а также с большим успехом применяется при производстве линолеума и линкруста.
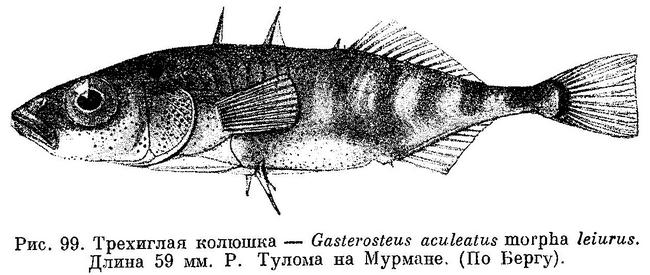
D III (IV), (9) 10—14, A (7) 8—10 (11), P 10—11, V I 1, позвонков у западноевропейских колюшек, по Бертэну, (28) 29—32 (33).
Число боковых пластинок, а также форма и размеры брюшной колючки весьма неодинаковы у колюшек из разных районов (подробно об этом см. у Бертэна). У баренцовоморской и беломорской ходовой (морской) колюшки боковые пластинки многочисленные (29—34), покрывают бока тела от головы до конца хвостового киля; брюшная колючка сильная, зазубренная и при основании сверху имеет короткий зазубренный шип; меньшего размера шипик или бугорок иногда имеется у этой формы и с нижней стороны основания брюшной колючки. Эти добавочные шипики напоминают строение брюшной колючки у американской морской колюшки (Gasterosteus wheatlandi Puth.). Этот вид имеет, однако, за брюшной колючкой обычно 2 мягких луча; боковые пластинки развиты только в передней части тела, хвостового киля нет (см.: Hubbs, 1929 : 2, pl. II, fig. 3). В то же время на севере (р. Тулома, о. Кильдин) встречаются и очень слабо вооруженные колюшки, с 3—5 боковыми пластинками, тонкими короткими и мало зазубренными колючками (иногда совсем гладкие), без шипов или бугорков при основании; хвостовой киль у этой формы слабый или отсутствует. Ходовые колюшки обычно крупнее пресноводных форм. В Белом море абсолютная длина первых до 9 см. Еще крупнее тихоокеанская колюшка, достигающая на Камчатке до 10—11 см. В пресных водах, а также на юге, длина обычно не превышает 4—6 см.
Распространение амфибореальное, так как встречается у берегов северных частей Тихого и Атлантического океанов, у берегов Мурмана и в юго-западной части Баренцова моря (В коллекциях Зоологического института АН СССР (№ 29176) имеется 4 экз. длиной 37—57 мм, пойманные 28 марта 1938 г. в открытом море (71°00' с. ш., 34°20' в. д.) над глубиной 190 м. Л. С. Берг, по данным Т. С. Расса, указывает колюшку и севернее — до 72°41' с. ш.), но отсутствует в Печоре и далее на восток вдоль всего побережья Сибири. Повидимому, она широко распространена в южной части Баренцова моря, доходя на восток до юго-западной части Новой Земли. Очень много в Белом море. Обычна у берегов Европы от Черного и Средиземного морей до Балтийского моря, Норвегии, Фарерских островов и Исландии. У американских берегов известна от Гудсонова залива и Гренландии на юг до Нью-Йорка или южнее. В Тихом океане от Берингова пролива по обоим берегам на юг до Кореи (Пусан) и Калифорнии.
Биология. Имеются как пресноводные (жилые), так и морские мигрирующие формы. Биология последних представляет большой интерес.
В Белом море колюшка — настоящая морская пелагическая рыба. Зимует она в открытом море, по предположению Гурвича, в слоях пелагиали, сохраняющих остатки летнего прогрева. После вскрытия ледового покрова многочисленные стаи колюшки, сопровождаемые чайками, массами подваливают к берегам, забивая все губы вплоть до их кутовых опресненных частей. В Кандалакшском заливе подход происходит в конце мая — начале июня, причем сначала подходят самки, а позднее — в середине июня — самцы, которые начинают строить гнезда в прибрежной полосе среди зарослей зостеры. Длина ходовых самок, по сообщению В. В. Кузнецова, 5—9 см (ср. 7.5 см), длина ходовых самцов 5—8 см (ср. 6.7 см). Плодовитость 65—550 икринок, чаще 150—250. К середине июля нерест заканчивается, количество взрослой колюшки у берегов уменьшается, а к концу июля — началу августа она исчезает совсем, скатываясь в море, где некоторое время наблюдается вдали от берегов. После нереста производители, повидимому, гибнут, частью еще в бухтах, частью в открытом море. В августе в Кандалакшском заливе в трал Сигсби нередко попадаются мертвые особи при тралении на глубине до 80 м. Мальки первое время держатся стайками у берегов в зарослях зостеры, осенью же отходят в море. Пищу колюшки у берегов составляют Cladocera, Сореpoda, икра и молодь рыб (в том числе собственная молодь), а также полихеты, личинки тендипедид и др. Жизненный цикл, во всяком случае, у беломорской колюшки, очень короткий — к берегам для нереста подходят вероятно годовики (В. В. Кузнецов).
Хозяйственное значение небольшое, на севере не промышляется. Летом колюшка служит пищей для чаек, крачек, беломорской трески; молодь ее поедают также керчаки, бельдюга, маслюк и другие рыбы.
Рыбы пресных вод СССР и сопредельных стран. Л.С.Берг 1948 г.
1. Gasterosteus aculeatus Linne. — Трехиглая колюшка
(На Белом море — корос, в устье Днестра — чортик, на Камчатке — хахалча, поляки — ciernik, финны — rautakala, эсты — ogalik, немцы — Stichling.)
Gasterosteus aculeatus Linne, Syst. nat., ed. X, 1758, p. 295 (Европа).
Gasteracanthus aculeatus Pallas, Zoogr. rosso-asiat., III, 1811, p. 229 (вся Россия, Черное море, Сев. Ледовитый океан, Камчатка).
Gasteracanthus cataphractus Pallas, 1. с. (Камчатка).
Gasterosteus trachurus, Gasterosteus gymnurus (leiurus), etc. Сuvier, Regne anim., ed. 2, t. II, 1829, p. 170; Сuvier et Valenciennes, Hist. nat. poissons, IV, 1829, p. 481 (Франция).
Gasterosteus trachurus Чepнай, Фауна Харьк. губ., I, 1852, стр. 30 (p. Сейм, p. Псёл).
Gasterosteus ponticus (Gasterosteus trachurus var. pontica) Nordmann, Faune pontique, 1840, p. 380 (Черное море).
Gasterosteus biarmatus Krуniсki in: Nordmann, 1. c., p. 381, Крым: Tapханкут).
Gasterosteus aculeatus Heckel und Кner, Süsswasserf. Oestr., 1858, p. 38, fig. 16 (бассейн Вислы, южн. Россия — var. trachurus).
Gasterosteus brachycentrus (Cuv.) Heckel und Кner, 1. c., p. 41, fig. 17 (сев. Италия).
Gasterosteus aculeatus Кесслер, Рыбы СПб. губ., 1864, стр. 39 (СПб. губ.).
Gasterosteus (aculeatus) gymnurus Fatio, Poissons de la Suisse, I, 1882, p. 71 (Рейн у Базеля).
Gasterosteus aculeatus Smitt, Scand. fish., II, 1895, p. 647, fig. 158—162; pl. XXVIII, fig. 1—2. — Jordan and Evermann, Fish. N. America, I, 1896, p. 747 (Европа, Гренландия).
Gasterosteus cataphractus Jordan and Evermann, 1. c., p. 749 (от Сан-Франциско до Аляски и Камчатки). — Т. and В. Bean, Proc. U. S. Nat. Mus., XIX, 1896, p. 250 (о. Беринга).
Gasterosteus microcephalus (Girard 1854, California) T. and. B. Bean, 1. c. (о. Беринга, оз. Саранное; microcephalus принадлежит к морфам semiarmata и gymnura).
Gasterosteus aculeatus Книпович, Ежегодн. Зоол. муз. Акад. Наук, II, 1897, стр. 152 (Кольский залив, Белое море, Новая Земля). — Берг, Рыбы Амура, 1909, стр. 194. — Antipa, Ichtiol. Romaniei, 1909, p. 52, pl. II, fig. 16 (Черное море у берегов Румынии, перед устьями Дуная, прибрежные озера).
Gasterosteus aculeatus var. ponticus Antipa, 1. c., p. 54, pl. II, fig. 17 (там же).
Gasterosteus aculeatus Bertin, 1. c., 1925, p. 153 (полная синонимика).
Gasterosteus aculeatus morpha gymnurus Rendahl, Arkiv for Zoologi, XXII A, № 10, 1931, p. 19 (о. Беринга); № 18, 1931, p. 25 (Камчатка: теплые ключи у с. Паратунки).
Gasterosteus aculeatus Б. Ильин, Природа, 1933, № 7, стр. 64 (в средней части Черного моря, пелагическая форма, спина темноголубая, брюхо серебристое). — Г. Гурвич, Природа, 1938, № 7—8, стр. 140 (Белое море, пелагическая форма).
Gasterosteus aculeatus microcephalus Мiуadi, Arch. f. Hydrobiol., XXXI, 1937, p. 444, fig. 6 (Курильские острова: Шумшу, Итуруп — в пресных озерах).
Gasterosteus aculeatus Берг, Изв. Инст. озерн. и речн. рыбн. хоз., XXVI, вып. 2, 1948, стр. 20 (Кольский п-ов: р. Тана, Кольский залив, Тулома, Иоканга, оз. Имандра; m. leiurus и m. trachurus — обе в пресной воде). — С. Троицкий, Рыбы Краснодарск. края, 1948, стр. 54 (Азовское море и кубанские лиманы).
D III (Как исключение, II, IV, V.) (9) 10—14, А I (7) 8—10 (11), V I 1, Р 10—11. На спине впереди спинного плавника обычно 3 колючки. Первая колючка сидит над основанием грудного плавника и впереди брюшной колючки. Тело покрыто то большим, то меньшим количеством костяных пластинок (до 35), образующих на хвосте более или менее ясный киль. Брюшная колючка без бугорка при основании. Рыло короче заглазничного отдела головы.

Вид этот подвержен многочисленным вариациям в отношении развития боковых пластинок, количества спинных колючек, высоты их, длины брюшных колючек, степени развития хвостового киля и т. п. (см. Gasterosteus). По количеству боковых пластинок Gasterosteus aculeatus из пределов СССР принадлежит к morpha trachurus Cuvier, у которой боковые пластинки идут до самого основания хвостового плавника и хвостовой киль хорошо развит (рис. 704). Однако с о. Беринга и с Камчатки (теплые ключи у с. Паратунки) указана morpha gymnurus (или leiurus) Cuvier с голым хвостом, а нередко и с частично голыми боками тела, и с слабо выраженным хвостовым килем. Такие же, наполовину голые, колюшки указываются для южн. Японии (Gasterosteus williamsoni japonicus Franz 1910, Misaki; Gasterosteus aculeatus microcephalus Jordan et Hubbs 1925, Lake Biwa). Но они имеются и на севере Европы: много их собрано В. К. Солдатовым в р. Туломе (Мурман, рис. 706, № 15714); у одних из них на боках тела, впереди всего 3—5 пластинок и совсем нет киля, у других 4—5 крупных пластинок, а затем идут мелкие пластиночки, и на хвосте есть слабый киль; V I 1, брюшная колючка слабо зазубрена (рис. 707).
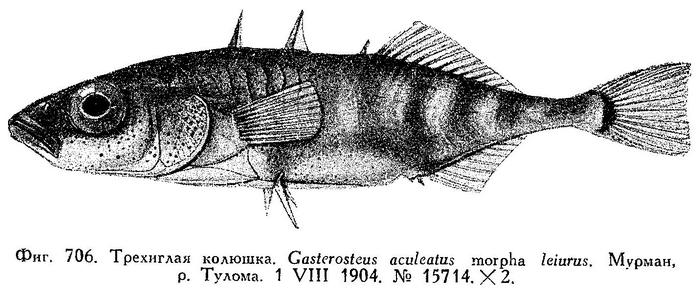

Вообще говоря, трехиглые колюшки из северных местонахождений, а также из морской воды отличаются более сильным развитием костяных пластинок; наоборот, южные колюшки, а также солоноватоводные и пресноводные имеют бока более или менее голые. Но это правило справедливо не всегда: с Мурмана и из Гренландии известны колюшки с малым количеством пластинок, тогда как черноморские хорошо покрыты пластинками.
Зимою тело серебристо-белое, верх головы и спины синий. Летом задняя часть головы и верх тела вплоть до боковой линии черновато-серые. Во время нереста у самцов низ головы и брюхо делаются красными; иногда красный цвет распространяется и на бока тела от брюха до боковой линии, иногда же все тело, кроме верхней части, становится красным; у самок на спине образуются темные поперечные пятна, а на боках появляется примесь медно-желтой окраски.
Длина до 40—60 мм, изредка до 80—90; в Тихом океане обычно 75—80, иногда до 100—110 мм.
Самец строит гнездо из растительных остатков, куда самки откладывают яйца. Икрометание в апреле—мае—июне, на севере позднее.
Крупная салака (Clupea harengus membras), подходящая осенью к берегам восточной части Финского залива, питается здесь колюшкой (R. Kanеrva, Finlands Fiskerier, XI (1930), 1931, p. 114.).
Сев. часть Атлантического и Тихого океанов: в Европе от Новой Земли (Г. Ф. Друккер (Рыбный промысел Большеземельской тундры. Тр. Инст. по изуч. Севера, вып. 38, М. 1927, стр. 12, 14) упоминает о нахождении Gasterosteus aculeatus в оз. Обседа-то, в бассейне р. Пустынной, впадающей в море против Вайгача. Половозрелые самцы колюшки были добыты в желудках гольцов (Salvelinus alpinus) во второй половине октября. Экземпляров этих колюшек я не видел.), Белого моря и Кольского п-ова до Черного моря, Исландия; Балтийское море (В Рижском заливе вылавливается в громадных количествах и идет на вытопку жира (П. Г. Борисов, Матер. к познанию русск. рыболовства, II, вып. 12, 1913, стр. 58); в 1911 г. здесь было добыто 15—20 тыс. ц колюшки. Также финны ловили колюшку осенью в больших количествах в восточной части Финского залива (у Бьёркё и Фридрихсгамна; G. Gottberg, Fiskeritidskrift för Finland, 1928, № 11, p. 189). Много колюшки в устье реки Луги.); Алжир; в Америке — от Гренландии до Нью-Йорка (и мыса Гаттерас?); в Тихом океане от Берингова пролива и на юг до Фузана (Корея) и Японии (Хондо), Курильские острова, а по американскому, побережью до Нижней Калифорнии (Эль-Розарио). Есть в Сев. Двине у Архангельска (Попов, 1926). В сибирской части Сев. Ледовитого моря и в реках, туда впадающих, а равно и в Печоре не встречается. Входит в реки, иногда поднимаясь очень высоко: в Роне до Sierre, в Рейне до Базеля, в Висле до Кракова и до р. Наревки (приток Нарева), в Немане до Белоруссии, но в Дунае известна лишь в области дельты. Устье Днестра (Браунер, 1887). В Днепре до Сейма и Пела (Чернай, 1852, в последние годы в Днепре не была находима). Азовское море, низовья Дона, устье Кубани. Есть в Ладожском и Онежском озерах и в оз. Имандра (бассейн Белого моря). Есть в Псковско-Чудском водоеме, особенно в дельте р. Великой, впадающей в Псковское озеро (В. В. Петров). В Амуре только в устье. В бассейнах Каспийского и Аральского морей отсутствует.

У меня в руках были колюшки, добытые из артезианского колодца у станции Джанкой (Крым), с глубины 128 м (№ 18582).
В Баренцовом, Белом и Черном морях трехиглые колюшки — это пелагические рыбы. По данным Т. С. Расса, в конце марта—апреле 1938 г. они встречены в открытом Баренцовом море на север до 72°41' с. ш.; колюшки эти темной окраски и хорошо вооружены, длина (абс.) 37—57 мм (№ 29176). В Белом море трехиглая колюшка — это настоящая морская пелагическая рыба; в конце мая или в начале июня она подходит к берегам для нереста; нерест с середины июня; в это время ею питается беломорская треска; с середины июля и до первых чисел августа колюшка отходит от берега (Гурвич).
Трехиглую колюшку иногда находят в торфяных выемках, куда икра, очевидно, заносится пассивным, путем.





































