(Gasterosteidae Bonaparte, 1831) Семейство Гастеростеиды, Колюшковые, Family Gasterosteidae Bonaparte, 1831 (Sticklebacks, Tubesnouts) 5 родов 16 видов
Атлас-определитель рыб: Книга для учащихся. Н.А.Мягков 1994 г.
Семейство Колюшковые (Gasterosteidae)
Тело умеренно удлиненное и сжатое с боков. На боках есть крупные костные пластинки, или тело голое. Есть колючки перед основанием спинного плавника. Мелкие рыбы, многие из которых строят «гнезда» и охраняют потомство. Модельные объекты различных экологических и ихтиологических исследований. В наших водах обитают представители трех родов.
Иллюстрированная энциклопедия рыб. Ст.Франк 1983 г.
К отряду относится семейство колюшковые (Gasterosteidae), включающее 5 родов. Три рода чисто морские, роды Gasterosteus и Pungitius - пресноводные, хотя первые два года их представители и живут в морской или солоноватой воде.
Декоративное рыбоводство. А.М.Кочетов 1991 г.
Семейство Колюшковые (Gasterosteidae)
Многим любителям природы нашей страны колюшки давно и хорошо знакомы. Самец у них вьет из кусочков растений оригинальное гнездышко для будущих малюток и бесстрашно охраняет их от всевозможных врагов. В целом семейство насчитывает 5 родов с 8 видами, распространенными в пресных и морских водах северного полушария. Они характеризуются заостренной головой с цепким конечным ртом, стройным, сжатым с боков туловищем, одиночными колючими шипами на спине и брюхе, трехлучевой жаберной перепонкой, свободными без сращений ребрами, тонким хвостовым стеблем с боковыми килями и костными пластинками, замещающими на теле чешую. Окраска оливковая с желтым, зеленым или голубым отливом, темными черточками и крапинками; размер 4—20 см. Половой зрелости достигают в 8—12 месяцев. Нерест порционный. В брачную пору самцы преображаются: наряд их становится очень контрастным с черными, синими и красными вставками. Плодовитость составляет 200—1000 икринок (после нереста они слипаются в комок). Инкубационный период длится 1—3 недели. За потомством родитель может ухаживать в течение месяца. Животноядные рыбы, причем необычайно прожорливы и нахальны. Нередко бывают заражены ленточными глистами, поэтому особей со вздутым брюшком выбраковывают незамедлительно. В неволе живут не более 4 лет. Условия содержания: dH до 30°, рН 6,5 — 8.2, t 10—28 °С, аэрация, фильтрация, подмена воды, при необходимости соленость 3—35‰, аквариум объемом от 30 л и больше. Ручьевая и девятииглавая колюшки скрещиваются между собой.
В семейство (фауна СССР) входит 2 рода и 4 вида веретенообразных рыб с двумя и более иглами перед спинным плавником. Самцы колюшек обычно «вьют» гнезда из растительности и охраняют потомство. Все виды хорошо живут и размножаются в неволе.
Фауна СССР. Рыбы. Том V, вып. 1. Семейство Колюшковых (Gasterosteidae) мировой фауны. В.В.Зюганов 1991 г.
1. МОРФОЛОГИЯ И АНАТОМИЯ
1.1. РАЗМЕРЫ ТЕЛА
Все виды колюшковых рыб отличаются сравнительно малыми размерами. Трехиглая колюшка Gasterosteus aculeatus в исключительных случаях достигает 13 см, например в оз. Майер (острова Королевы Шарлотты, Канада) (Moodie, 1972b), но в большинстве популяций длина тела (общая) у половозрелых рыб достигает только 6—7 см. Обычно абсолютная длина тела у проходных рыб трехиглой колюшки больше (7—8 см), чем у пресноводных рыб (5—6 см). Отмечено, что на западном побережье Северной Америки размеры тела пресноводной формы трехиглой колюшки уменьшаются в южном направлении (Bell, 1984). Исследовав 11 популяций из того же района, Мак-Фейл (McPhail, 1977) предположил, что популяции, подвергающиеся наиболее интенсивному хищничеству, имеют либо относительно малые, либо относительно большие размеры тела рыб, поскольку в случае относительно мелких рыб-хищников большой размер тела колюшек селективно выгоден, а если хищники крупные, то выгоден малый размер тела, так как колюшки все равно не могут вырасти до размеров, позволяющих уйти им из-под пресса хищников. Однако этим же автором (McPhail, 1977) были найдены и исключения: озера, в которых плотность хищников-рыб была низкая, также населены колюшками относительно больших размеров. По нашим наблюдениям в оз. Машинном (Лоухский р-н, Карельская АССР), где также нет хищников, длина тела трехиглой колюшки достигает 8—9 см, так что есть еще какие-то факторы, влияющие на эволюцию размеров тела колюшек. Учитывая положительную корреляцию между размерами тела и плодовитостью трехиглой колюшки (Wootton, 1976), а также репродуктивным успехом самцов (Rowland, 1982), можно ожидать, что естественный отбор благоприятствует увеличению размеров тела до такого предела, пока другие селективные факторы не ограничат их. Относительно факторов эволюции размеров тела других видов колюшек ничего не известно.
Девятииглая колюшка (Pungitius pungitius) также может достигать максимальных размеров в 10 см, но обычно эта величина составляет 5—6 см (Wootton, 1976). Длина тела Pungitius sinensis достигает 8.5—9, но чаще 6.5—7 см, малой южной колюшки, Pungitius platygaster, — обычно 3.5—5.5 см, иногда до 7 см, сахалинской колюшки, Pungitius tymensis, до 7 см (Берг, 1949). Ручьевая колюшка, Culaea inconstans, эндемик Северной Америки, достигает в длину 6.5 см (Winn, 1960). Четырехиглая колюшка, Apeltes quadracus, также эндемичная для Северной Америки, достигает в длину максимум 6 см, но обычно меньше (Nelson, 1971а). Максимальная длина еще одного вида — эндемика Северной Америки, черно-пятнистой колюшки, Gasterosteus wheatlandi, 7, но обычно 4—5 см (Coad, Power, 1973с). Самая крупная по размерам колюшка из всего сем. колюшковых — 15-иглая колюшка, Spinachia spinachia, достигающая в длину при половозрелости 10—15 см, хотя есть рыбы длиной до 20 см (Wootton, 1976).
Таким образом, максимальная длина половозрелых стадий колюшковых рыб колеблется от 4 до 10 см (за исключением Spinachia spinachia, чья длина тела превышает 10 см).
1.2. ФОРМА ТЕЛА
Форма тела всех видов сем. Gasterosteidae веретенообразная, сжатая с боков, тело сужается к хвостовому стеблю, несущему хвост в форме усеченного конуса или закругленный. Рыло имеет коническую или трубковидную форму. У всех родов, за исключением Spinachia, соотношение длина — высота тела варьирует от 4 : 1 до 5 : 1, а у последней 11 : 1 (Hall, 1956, — цит. по: Wootton, 1976). Именно у Spinachia форма рыла не коническая, а трубковидная. Относительная высота тела увеличивается в ряду Spinachia spinachia — Pungitius sinensis — Pungitius pungitius — Pungitius tymensis — Pungitius platygaster — Gasterosteus aculeatus — Gasterosteus wheatlandi — Culaea inconstans — Apeltes quadracus (рис. 1).
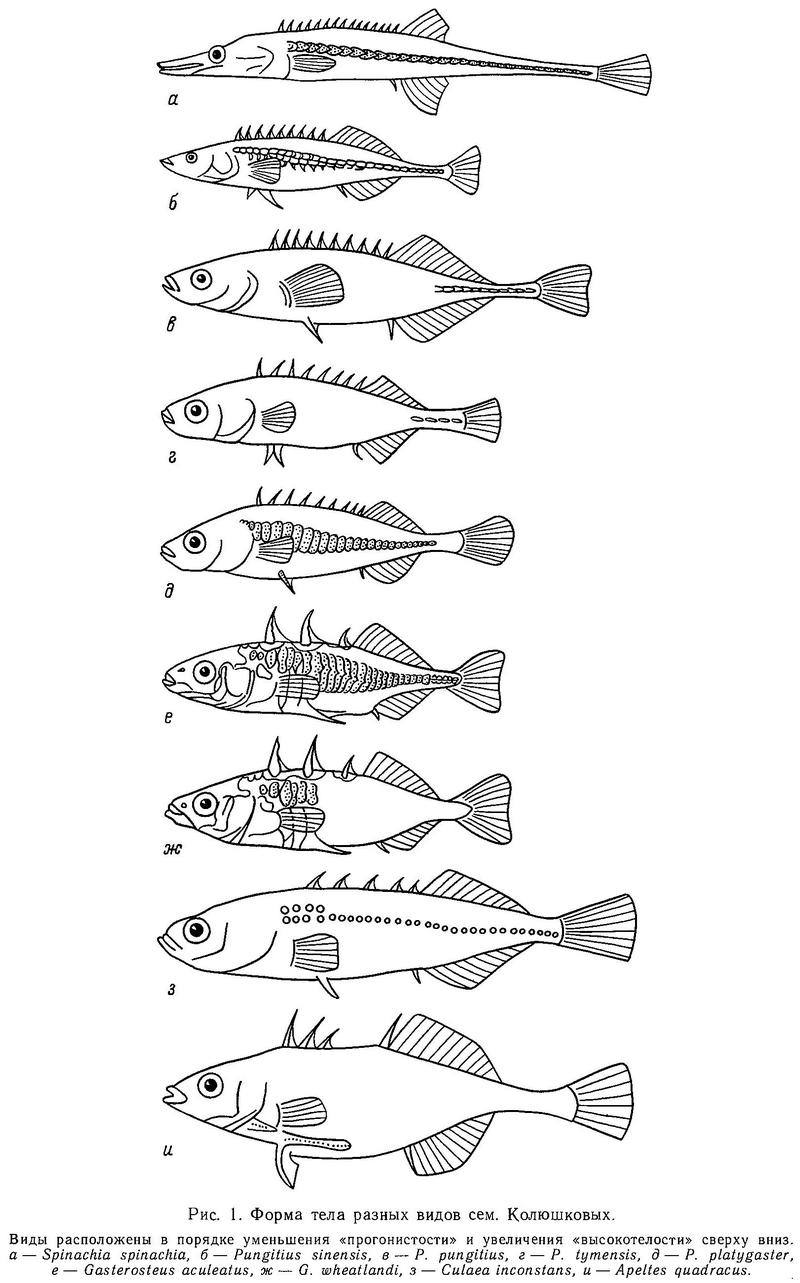
В этом ряду видов уменьшается также относительная длина хвостового стебля и увеличивается его высота. Рыло у Spinachia длинное и трубковидное, но рот относительно маленький, так что передний край орбиты глаза лежит далеко позади челюстного сочленения. У всех других видов колюшек челюстное сочленение лежит под или почти под передним краем орбиты глаза. У всех видов колюшек конечный рот, у Spinachia spinachia полуверхний. Вышеуказанные особенности формы рыла, очевидно, связаны с питанием: Spinachia spinachia питается мелкими ракообразными (Copepoda, Amphipoda и Isopoda) (Blegvad, 1917). При взятии пищи Spinachia spinachia всасывает планктон в рот. Все остальные виды колюшек обладают широким спектром питания и являются эврифагами, вероятно, поэтому они относительно короткорылы и имеют конечный рот. Форма тела разных видов колюшек также тесно связана с особенностями их экологии. Так, Spinachia spinachia, проходная форма Gasterosteus aculeatus, полупроходная форма Pungitius pungitius совершают значительные по расстоянию миграции к местам нереста и являются хорошими пловцами — отсюда веретенообразная форма тела с относительно длинным хвостовым стеблем. Pungitius sinensis обнаруживает пелагический образ жизни в озерах и реках и по форме тела приближается к вышеуказанным видам. Остальные же виды колюшек (Pungitius tymensis, Pungitius platygaster, Culaea inconstans, Apeltes quadracus) обитают в литоральной зоне водоемов с густой водной растительностью, ведут более скрытный образ жизни, не совершают миграций и поэтому относительная высота тела у них больше, а хвостовой стебель более короткий и высокий. Интересно сопоставить форму гомоцеркального хвостового плавника с образом жизни разных видов колюшек. Всего у колюшек встречается три типа формы: округлый (Pungitius tymensis, Pungitius platygaster, Culaea inconstans, Apeltes quadracus), усеченный (Spinachia spinachia) и полулунный (или слегка выемчатый) (Gasterosteus aculeatus, Pungitius pungitius, Pungitius sinensis) (рис. 1). Если учесть, что усеченная и выемчатая форма характерна для более быстрых пловцов (Барсуков, 1959), а полулунная форма гомоцеркального плавника дает большую свободу для вертикальных движений, то представленная картина по форме хвостового плавника у колюшек хорошо согласуется с образом жизни этих видов.
1.3. ПОКРОВЫ
В отличие от большинства костистых рыб у всех видов сем. Gasterosteidae нет чешуи, а вместо нее у большинства видов тело защищено рядом боковых пластин или щитков. Эти костные пластины имеют ту же структуру и происхождение, что и дермальные кости (Penczak, 1961а). Было показано, что при экспериментальном удалении нескольких костных пластин вместе с кожей возбуждаются регенерационные процессы: путем дифференциации мезенхимной ткани регенерируется поврежденный слой мышц, соединительная ткань и сами костные пластины. Удаленные пластины полностью восстанавливаются через 150 дней. Факт полной регенерации костных пластин трехиглой колюшки интересен тем, что удаленные гомологичные кожные кости у других костистых рыб регенерировали лишь в том случае, если они повреждались частично (Penczak, 1961а). Более подробно костные пластины будут рассмотрены в разделе 1.7.
Кожа колюшек покрыта тонким слоем, выделяемым клетками кожи и называемым кутикулой. Это слой мукополисахаридной природы. В коже имеются бокаловидные клетки, продуцирующие слизь; их ультраструктура сходна с хлоридными клетками жабр и некоторыми хемосенсорными клетками (Whitear, 1970, 1971b). В коже также содержатся разнообразные пигментные клетки (мелано-, ксанто-, эритро- и гуанофоры) (Burton, 1979), продуцирующие черный, желтый, красный и серебристый пигменты и обеспечивающие разнообразные оттенки окраски колюшковых рыб. Подробнее окраска разных видов колюшек будет рассмотрена в следующем разделе.
1.4. ОКРАСКА
У колюшковых рыб наблюдается значительная изменчивость по окраске тела как между разными видами, так и между разными популяциями и даже внутри популяций одного вида. Кроме того, у ряда видов имеются еще и сезонные изменения окраски, связанные с периодом размножения (брачная окраска). Лучше всего изменчивость окраски исследована у трехиглой колюшки Gasterosteus aculeatus. На этом объекте выявлено селективное значение разных типов окраски и даже исследована генетика полиморфизма брачной окраски самцов (Hagen, Moodie, 1979). Поэтому мы более подробно остановимся на окраске трехиглой колюшки.
Поскольку трехиглая колюшка занимает разнообразные места обитания, где варьируют световые условия, характер грунта, растительности, плотность хищников, то закономерно варьирует и окраска среди локальных популяций (Hardy, 1978). Колюшка не является исключением среди костистых рыб, для многих видов которых, живущих в открытых водах, характерен серебристо-светлый низ тела и темный верх. Например, зимой морская форма колюшки имеет синий верх головы и спины, низ и бока серебристо-белые, летом задняя часть головы и верх тела вплоть до боковой линии черновато-серые (Берг, 1949, с. 974). Пресноводные колюшки из водоемов с темной водой (или с густой растительностью) темные сверху и светлые снизу, с серией темных пятен на теле. Темная окраска варьирует от коричневой до зеленой, а светлый брюшной участок тела имеет серебристый оттенок. В сильно окрашенной, богатой гуминовыми кислотами воде встречаются популяции-меланисты (Moodie, 1972а).
Итак, налицо защитная функция окраски. Все эти особенности окраски характерны как для самцов, так и для самок, и существенных межполовых различий не наблюдается вне периода размножения. Во время нереста же появляются разительные отличия между самцами и самками. Зрелые самки окрашены обычно, но при созревании икры брюшко самки раздувается и раздутый участок становится еще более белым. Драпкин (1956, с. 120) наблюдал появление брачного наряда самки за несколько секунд до того момента, как самка зашла в гнездо самца. «Брачный наряд появился в виде нескольких, следующих друг за другом от головы до хвоста крупных поперечных темных пятен ромбической формы. Основной фон, особенно жаберных крышек, отливает ярким металлическим блеском, какого у рыбы нет в обычное время». После икрометания самки теряли этот наряд. По мнению Драпкина, брачный наряд самки помогает самцу отличить самку, совершенно готовую к нересту, и является биологическим приспособлением вида, способствующим успеху нереста (Драпкин, 1956, с. 122).
Однако наибольший интерес представляет брачная окраска самца; ее всестороннее исследование привлекло внимание этологов и эволюционистов. Вот как описывал брачный наряд самца Золотницкий: «Ко времени нереста цвета его становятся очень красивы. Спина принимает синеватые оттенки, тело отливает серебром, брюшко, губы, щеки и основания плавников переходят всё в более и более красный цвет, пока наконец не сделаются совершенно шерлаховыми, киноварными, а глаза принимают такой чудный лазоревый или лилово-голубой цвет, какой не поддается никакому описанию. Словом, в это время самчик так красив, что по яркости красок походит скорее на прелестно расцвеченное насекомое, чем на рыбу» (Золотницкий, 1916, с. 373). Окраска самца появляется задолго до нереста и сохраняется на время постройки гнезда, икрометания, ухода за развивающейся икрой и молодью, т. е. на весь нерестовый сезон.
Как и другие вторичнополовые признаки, брачная окраска зависит от гормонального контроля. Если самец кастрирован и затем выдерживается в эксперименте в условиях освещенности дневным светом в течение 16 ч в сутки (условия, стимулирующие созревание), то у него не развиваются красная окраска брюшка и голубая окраска глаз. Но эта окраска у кастрированного самца может быть стимулирована гормональной терапией, например гормоном тестостероном (из группы андрогенов), продуцируемым семенниками (Hoar, 1962а, 1962b; Baggerman, 1966). В норме первый признак появления брачной окраски — развитие голубых участков на верхней части радужной оболочки глаза (ириса), и в итоге ирис становится целиком голубым. Голубоватый оттенок также развивается на спине. Когда глаз стал голубым, красная окраска появляется на горловом участке поверхности рыбы, поскольку в это время увеличивается число пигментов-эритрофоров. При максимальной выраженности брачной окраски красными становятся нижняя часть рта, горло, район жаберной крышки и даже внутренняя сторона брюшной полости, вентролатеральная поверхность головы и брюха, тазового пояса, основания брюшной колючки; вдоль боковой поверхности тела красная окраска распространяется от грудного плавника до начала анального. Остальные участки тела окрашены от неярко-голубого до радужно-зеленого. Из-за сжатия пигментных клеток меланофоров, содержащих черный пигмент, общий тон тела значительно светлеет. Голубая окраска глаза возникает благодаря уменьшению количества кристаллов гуанина (серебристый цвет) в гуанофорах (Titschack, 1922). Красную окраску детерминирует присутствие трех пигментов: наибольшая роль принадлежит пигменту моногидроксиксантофиллу, наименьшая — каротиноидам эстерксантину и астаксантину. Даже у незрелого самца первые два из этих пигментов присутствуют, хотя и в меньшей концентрации, что позволяет рассматривать причину возникновения красной окраски вследствие увеличения концентрации этих пигментов, а не их качественных изменений (Brilsh, Reisman, 1965).
Типичная брачная красная окраска наблюдается в большинстве изученных популяций трехиглой колюшки (Bell, 1984), однако в разных популяциях отмечены разные оттенки красного цвета (Hardy, 1978). Например, в некоторых пресноводных популяциях из Калифорнии (США) красная окраска ограничена вентральной поверхностью головы и плечевого пояса, в то время как колюшки морской формы у Лонг-Айленда (Нью-Йорк, США) имеют максимальное распространение красного цвета по телу, как было описано выше (Bell, 1984). Географическая изменчивость распределения красной окраски по телу практически не изучена.
Большой интерес представляют данные по внутрипопуляционному полиморфизму брачной окраски. Так, Гильбертсон (Gilbertson, 1980, — цит. по: Bell, 1984) описал озерную популяцию колюшки на Аляске (США), где выделил 4 фенотипа по брачной окраске. Все нерестовые самцы обнаруживали красную окраску внутри рта и в области рыла, но различались по окраске головы и тела. «Красный» фенотип имел красную окраску на вентролатеральном участке головы, «золотистый» фенотип — канареечно-желтую окраску по всему телу, «серый» — тускло-коричневую критическую окраску тела, «зеленый» — различные оттенки зеленой окраски тела. Гетерогенно и пространственное распределение этих фенотипов. Так, «красные» самцы более обычны в заливах, чем на побережье открытой части озера, но в пределах каждого залива «красные» и «серые» распространены чаще на илистом, чем на песчаном субстрате, а «золотистые» с равной частотой встречаются на илисто-песчаном и галечно- гравийном грунте. Были также выявлены корреляции между фенотипами по окраске и некоторыми морфологическими признаками. Гильбертсон (Gilbertson, 1980, — цит. по: Bell, 1984) полагает, что «красные» самцы могут обладать сексуальным преимуществом (поскольку известна положительная корреляция между интенсивностью красной окраски и уровнем «броскости» демонстраций элементов брачного танца, — Wootton, 1976), но подвергаться большому давлению хищников из-за демаскирующего эффекта.
Весьма интересны случаи меланизма брачной окраски, когда в популяциях все половозрелые самцы становятся целиком черными во время нереста, а красная окраска полностью отсутствует. В основном такие популяции встречаются на Тихоокеанском побережье (северо-запад США и Канады), но отмечены также и для Калифорнии (Bell, 1982). Наиболее полно изучены 2 случая меланизма: в оз. Майер (острова Королевы Шарлотты, Канада) (Moodie, 1972а, 1972b) и в бассейне р. Чехэлис и сопредельных районах (McPhail, 1969; Hagen, Moodie, 1979; Hagen et al., 1980). Мак-Фейл (McPhail, 1969) показал, что особи из аллопатричных «красносамцовых» и «черносамцовых» популяций скрещиваются в эксперименте и гибриды первого поколения промежуточны по окраске. Генетика полиморфизма по брачной окраске будет описана в разделе 4.5.1.
В бассейне р. Чехэлис «черносамцовые» популяции колюшек симпатричны с эндемичным видом Novumbra hubbsi (Umbridae), хищником по отношению к икре и молоди колюшки (Novumbra достигает сходных с колюшкой дефинитивных размеров и не является хищником взрослых колюшек). В этом же бассейне парапатрично по отношению к «черносамцовым» обитают типичные популяции «красных» колюшек. В эксперименте черные самцы имеют больший репродуктивный успех в охране потомства на гнездах, чем красные, поскольку территориальные самцы Novumbra (также темноокрашенные) чаще вторгались в территориальные участки красных самцов (Hagen et al., 1980). Очевидно, эволюция «черных» популяций в бассейне р. Чехэлис возникла как ответ на присутствие специфического хищника Novumbra. Подробнее изолирующие механизмы между «красными» и «черными» популяциями будут рассмотрены в разделе 4.5.6.
Окраска чернопятнистой колюшки, Gasterosteus wheatlandi, в морской период жизни не отличается от таковой Gasterosteus aculeatus, но в сезон размножения наступают заметные различия в брачной окраске между этими двумя близкими видами. У самца Gasterosteus wheatlandi не развиваются красная окраска брюха и голубая окраска глаз, вместо этого при нересте цвет тела становится зеленовато-желтым и появляется серия темных пятен позади брюшной колючки (откуда и название blackspotted stickleback), брюшная колючка становится оранжевой (Leim, Scott, 1966; McInereney, 1969; Scott, Crossman, 1973). Поскольку оба вида симпатричны на восточном побережье Сев. Америки, то, возможно, резкие различия в брачной окраске самцов играют роль изолирующих механизмов.
Изменчивость окраски девятииглых колюшек рода Pungitius также значительна. Зимой верх головы и спина Pungitius pungitius темно-голубого цвета, бока серебристо-белые с очень мелкими черными пятнышками, сходную окраску имеет и амурская колюшка, Pungitius sinensis, обитающая, как и Pungitius pungitius, вне сезона размножения в открытых частях водоемов. А два других вида — Pungitius platygaster и Pungitius tymensis (малая южная и сахалинская колюшки), предпочитающие держаться в литоральной зоне с густой растительностью, имеют камуфлирующую окраску — ряд зеленовато-бурых полос и пятен на оливковом фоне. У всех видов и форм девятииглых колюшек рода Pungitius самцы в нерестовый сезон претерпевают одинаковые изменения — тело их становится черным (спина, бока тела и брюхо), а брюшные колючки белыми (они являются ориентиром для самки при ведении ее к гнезду). Тем не менее различия между видами наблюдаются и по брачной окраске самцов. Так, брюшные колючки Pungitius pungitius приобретают интенсивную голубовато-белую окраску и хорошо различимы в воде, у самцов же Pungitius platygaster вся передняя часть брюшных колючек темного цвета, светлеет лишь задняя, обращенная к самке во время ведения ее к гнезду. Самки Pungitius platygaster и в брачный период сохраняют камуфлирующий наряд — пятна на оливковом фоне; у них полностью отсутствует «зеркальце» — блестящее пятно, не покрытое темным пигментом кожи на боках тела, характерное для самок Pungitius pungitius в нерестовый сезон (Гомелюк, 1978). Внутри вида Pungitius pungitius имеется межпопуляционная изменчивость по брачной окраске самцов: в отличие от самцов «типичных» популяций, самцы из озера Гурон (Великие озера), где отсутствует зона растительности, не становятся черными по всей поверхности тела; вместо этого на брюшной стороне тела развивается «серый лоскут», на фоне которого хорошо заметны голубовато-белые колючки. Этот «лоскут» становится блестяще-черным во время фазы ухаживания и охраны икры.
Окраска Culaea inconstans вне нерестового сезона имеет криптический характер: оливково-зеленое или коричневатое тело с темным пестрым рисунком на спине и боках. С приближением нереста самец темнеет. На радужной оболочке глаза — ирисе, имеющей желтую окраску, возникает черная полоса меланофоров, расположенная вертикально и простирающаяся через всю поверхность глаза. В отличие от Gasterosteus и Pungitius спинной и анальный плавники у Culaea, а также мембраны спинных колючек становятся интенсивно пигментированными меланофорами, что делает их более броскими (Reisman, Cade, 1967; Hall, 1956, — цит. по: Wootton, 1976). Самки тоже меняют окраску, и при созревании пестрота их окраски становится более выражена (Scott, Crossman, 1973).
Окраска Apeltes quadracus вне нерестового сезона также имеет криптический характер: коричневато-оливковая спина с черными пятнами и серебристое брюхо (Wootton, 1976). Большую часть времени года Apeltes проводит в морских и солоноватых водах (восточное побережье США), весной с началом нереста у самца становятся красными брюшные колючки и на голове появляются две темные пигментированные полоски, которые горизонтально простираются от глаза до заднего края черепа (Hall, 1956, — цит. по: Wootton, 1976).
Spinachia spinachia в отличие от всех остальных видов колюшек не обнаруживает возникновения брачной окраски как у самцов, так и у самок. Эта морская рыба имеет коричневатого оттенка спину и бока тела, с темными полосами и серебристый цвет брюха, когда держится над песчаным или илистым субстратом, но если рыбы находятся среди водорослей, преобладает оливковая окраска с темными зеленоватыми пятнами (Wheeler, 1969). Различия в окраске одних и тех же рыб получены в эксперименте при выдерживании их или над темным или над светлым субстратом (Baker, 1963).
Подводя итоги обзора окраски разных видов колюшковых рыб, можно сделать следующие обобщения. Виды, которые вне сезона размножения занимают нишу открытых водных пространств, имеют типичную для костистых рыб защитную окраску — темных тонов спина и серебристо-светлое брюхо (морская форма Gasterosteus aculeatus, Pungitius sinensis, Pungitius pungitius, Spinachia spinachia). Другие же виды, которые весь жизненный цикл проводят в зоне растительности, обладают криптической, камуфлирующей окраской с коричневатым и оливково-зеленоватым фоном тела и пестрым рисунком пятен и полос (жилые формы Gasterosteus aculeatus, Pungitius platygaster, Pungitius tymensis, Culaea inconstans, Apeltes quadracus). Во время сезона, размножения окраска всех видов, за исключением Spinachia spinachia, закономерно меняется, развивается брачная окраска самцов и иногда самок. Брачная окраска играет важную роль во время половой (ухаживательной) и территориальной фаз размножения. Самец своей окраской сигнализирует самке о готовности к нересту, о своем пространственном местоположении и демонстрирует конкурентным самцам своего вида во время территориальной фазы, что он охраняет свой гнездовой участок. В то же время эта окраска не должна демаскировать самцов в присутствии хищников. Видно, что требования эти жесткие и взаимоисключающие, поэтому необходим некий компромисс. У всех 3 родов колюшек (Pungitius, Culaea и Apeltes), не имеющих существенных морфологических адаптаций против хищников, нерест проходит в зоне растительности, гнезда строятся над грунтом среди листьев и ветвей. Брачные изменения окраски тела не демаскируют колюшек (у Pungitius pungitius темнеет все тело, у Pungitius tymensis, Pungitius platygaster, Culaea inconstans и Apeltes quadracus камуфлирующая пестрота окраски сохраняется), более яркой и броской делается лишь окраска колючек или отдельных небольших участков тела (глаза, боковая поверхность головы). Таким образом решаются следующие задачи: нет демаскирования от хищников, и достигается соответствующая сигнализация половым партнерам и соперникам.
Иначе обстоит дело с трехиглой колюшкой: путем выработки морфологических адаптаций против хищников (длинные крепкие зазубренные брюшные и спинные колючки с замковым механизмом, фиксирующим их в растопыренном состоянии, прочный наружный костный скелет) ей удалось «эмансипироваться» — уйти в процессе эволюции от растительной зоны во время размножения и использовать для нереста открытые площади грунта (из всех родов колюшек только самцы Gasterosteus строят гнезда на грунте). Перед Gasterosteus не стоит задача маскировки от хищников, и у самцов колюшки вырабатывается ярко-красная брачная окраска, сигнализирующая самкам о готовности к нересту и отпугивающая конкурентов от гнездового участка во время территориальной фазы заботы о потомстве. Поэтому брачная окраска трехиглой колюшки так заметно отличается от таковой других видов колюшек.
Нужно сказать, что окраска рыб — признак с довольно широкой нормой реакции, поэтому ее следует осторожно использовать как маркер генотипического состава популяций, отбора, микроэволюционных процессов, географической изменчивости и т. д. Колюшковые рыбы в общем не исключение в этом отношении, и наверняка большинство описанных случаев в вариации окраски носят модификационный, фенотипический характер. Выше уже приводились сведения для Spinachia spinachia, подтверждающие это положение. К этому можно добавить, что, по нашим данным, интродукция основателей морской формы трехиглой колюшки Белого моря в пресноводные изолированные небольшие водоемы (затопленные карьеры) приводила к массовому изменению окраски рыб уже в первом поколении. Морские колюшки — основатели с характерной пелагической окраской (темная спина, серебристое брюхо) при пересадке в карьер «Черный» (с темной малопрозрачной водой, прозрачность 10 см) уже в первом поколении дали мономорфное потомство рыб с чрезвычайно темной однотонной окраской по всему телу, почти меланистов. Такое массовое, групповое изменение — верный признак его модификационной, а не генетической природы.
Однако тем интереснее представляются факты обнаружения генетического полиморфизма по брачной окраске («красные» и «черные» самцы), найденного в районе северо-западной Пацифики (США). Поэтому дальнейшие исследования этого полиморфизма должны пролить свет на эволюцию и механизмы видообразования колюшковых рыб.
1.5. ПЛАВНИКИ
Все виды колюшковых рыб имеют полный набор плавников, характерных для типичной костистой рыбы, за исключением брюшных плавников, модифицированных в колючки. Спинной (D) и анальный (А) плавники Gasterosteus aculeatus расположены вдоль тела со сдвигом спинного слегка вперед по сравнению с анальным. Грудной плавник (Р) широкий и закругленный, в спокойном состоянии колюшки плывут, работая грудным плавником как парными веслами. Брюшной плавник (V) содержит только колючку и один мягкий луч. У грудного и брюшного плавников мягкие лучи простые, а у анального, спинного и хвостового (С) — членистые и ветвистые. Число лучей в спинном и анальном плавниках у трехиглой колюшки более изменчиво, чем в грудном и хвостовом (табл. 1), что, вероятно, свидетельствует о большей функциональной значимости двух последних. Однолопастной хвостовой плавник прежде всего — движитель, и число лучей в нем во всех популяциях неизменно — 12, а грудной плавник кроме функции движения и маневрирования имеет еще одну важную функцию — вентиляцию икры на стадии заботы о потомстве и испытывает большие нагрузки в течение сезона размножения (см. раздел 2.8), поэтому число лучей в нем также инвариантно — 10. Перед спинным плавником у всех видов колюшек расположены колючки (модифицированный первый спинной плавник, аналогичный плавнику окуневых). Число колючек перед спинным плавником (аналогичным 2-му спинному плавнику окуневых) является таксономическим признаком, дискриминирующим роды в семействе. Строение и форма плавников у других колюшковых рыб сходны с описанным у трехиглой колюшки (табл. 1). При описании других видов мы будем отмечать только их отличия от Gasterosteus aculeatus.


У Gasterosteus wheatlandi в отличие от Gasterosteus aculeatus в брюшном плавнике содержится не 1, а 2 мягких луча (очень редко 1 или 3 с одной стороны) (Nelson, 1971а, с. 438). Спинной плавник содержит 9—11 лучей, анальный 6—9. В остальном по плавникам различий между ними нет.
У Pungitius pungitius структура и форма всех плавников принципиально не отличается от Gasterosteus aculeatus, пределы колебаний числа лучей во всех плавниках сходны с таковыми у трехиглой колюшки. Единственное отличие в том, что у Pungitius pungitius анальный плавник лежит прямо под спинным. У остальных видов рода Pungitius (Pungitius sinensis, Pungitius tymensis, Pungitius platygaster) строение и форма плавников принципиально не отличаются от Pungitius pungitius, лишь Pungitius tymensis не имеет мягких лучей в брюшном плавнике.
У Culaea inconstans анальный плавник слегка смещен вперед по сравнению со спинным. У Apeltes quadracus в брюшном плавнике 2 мягких луча. Spinachia spinachia имеет 2 мягких луча в брюшном плавнике. Брюшной плавник (маленькая колючка, связанная с двумя мягкими лучами) в отличие от других видов у Spinachia spinachia лежит относительно грудного плавника далеко назад вдоль тела. Если у остальных колюшковых брюшная колючка расположена под серединой грудного плавника, то у Spinachia spinachia — позади грудного плавника. Спинной и анальный плавники относительно маленькие, имеют треугольную форму и содержат по 6—7 лучей. О размахе изменчивости по числу лучей в плавниках колюшковых рыб можно судить по табл. 1.
1.6. КОЛЮЧКИ СПИННЫЕ И БРЮШНЫЕ
У всех видов колюшковых рыб имеются непарные спинные и анальная колючки и парные брюшные колючки (с этим связано название семейства). Не обнаруживает межвидовой и внутривидовой изменчивости лишь анальная колючка, расположенная перед анальным плавником, она инвариантно присутствует у всех родов и видов во всех изученных популяциях, но по брюшным и спинным колючкам отмечена широкая изменчивость.
Рассмотрим сначала спинные колючки. У всех видов спинные колючки расположены перед спинным плавником, каждая колючка изолирована одна от другой, а последняя — от спинного плавника (кроме Apeltes, у которой она слита с плавником). Все колючки имеют треугольную плавниковую мембрану. Размах изменчивости по числу спинных колючек в целом по семейству 0—16. Спинные колючки изменчивы по числу, длине и степени зазубренности. Они могут выпрямляться и фиксироваться в выпрямленной позиции.
Роды колюшек различаются и именуются по числу спинных колючек: Spinachia (пятнадцатииглая колюшка) — 15 (редко 14 или 16), Pungitius (девятииглые колюшки) — 8—10 (редко 7 или 12), Culaea (ручьевая колюшка) 4—6 (редко 1 или 7), Apeltes (четырехиглая колюшка) — 4—5 (редко 3 или 6), Gasterosteus (трехиглые колюшки) — 3 (редко 0 или 5) (Nelson, 1971а). У Pungitius, Spinachia и Apeltes спинные колючки наклонены в разные стороны (зигзагообразно), а у Gasterosteus и Culaea — прямо (основания колючек лежат на прямой линии, и нет наклона в стороны). Изменчивость спинных колючек (равно как и изменчивость любого другого признака колюшковых) полнее всего изучена на трехиглой колюшке. Одна из главных функций спинных колючек (так же, как и брюшных) у трехиглой колюшки — защита от хищных рыб. Весьма выразительно об этом написал Сабанеев: «Трехиглая колюшка, вооруженная твердыми, длинными и крепкими колючками, крайне редко достается в добычу щукам, окуням и прочим хищникам, которые если и вздумают с голоду охотиться за этими рыбами, то зачастую бывают наказаны за свою жадность: колюшка растопыривает свои острые спинные и брюшные шипы, обыкновенно плотно прилегающие к телу, и иглы эти вонзаются в пасть рыбы. Так же взъерошиваются они и в драках между собой и вообще в минуту опасности» (Сабанеев, 1982, с. 99).
Такая эффективная защита обеспечивается тем, что колючки могут фиксироваться в выпрямленной позиции не просто мускулатурой, а специальным замковым механизмом, так что колючка не складывается даже во рту хищника, под сильным давлением. Фиксация колючки обеспечивается сочленением ее основания с базальной костной спинной пластинкой с помощью связки (лигамента), которая скрепляет колючку с пластинкой. К колючкам прикреплены мышцы «эректор» (выпрямляющая) и «депрессор» (сжимающая), но для складывания колючки вдоль тела требуется участие и эректора, и депрессора. Связки удерживают выпрямленную колючку в такой позиции, что колючка имеет три точки контакта с базальной пластиной. Для усиления контакта между колючкой и пластинкой требуется сжатие только одной мышцы — депрессора, но для освобождения от контакта между основанием колючки и базальной пластины (спинного щитка) требуется координированное сжатие обеих мышц (эректора и депрессора). Сходным образом устроен и фиксирующий механизм брюшной колючки (Hoogland, 1951). Поэтому у живых и даже у мертвых колюшек невозможно руками сложить колючку, не сломав ее при этом.
Кроме защитной функции колючки играют роль при демонстрациях во время половой (ухаживания) и территориальной (родительской) фаз нереста (подробнее об этом будет сказано в разделах 2.8.2, 2.8.3).
В норме у трехиглой колюшки 3 колючки: 2 передние длинные и зазубренные, а третья самая короткая, ее длина не составляет и половины длины любой из двух передних. Тем не менее общие пределы колебания по числу колючек для Gasterosteus aculeatus составляют 0—5. Работы по скрещиванию особей с разным числом колючек показали, что различия по числу колючек имеют существенную генетическую компоненту (Lindsey, 1962а; Gross, 1977; Campbell, 1979). Подробнее эти работы будут обсуждены в разделе 4.5. Однако Линдсей (Lindsey, 1962а) показал, что воздействие повышенной температуры при выращивании икры и молоди колюшки может индуцировать фенотипы с 4 колючками, что свидетельствует о влиянии условий среды на число колючек.
Гросс (Gross, 1978а) обследовал большое число европейских популяций и нашел, что суммарно около 98 % особей колюшки имеют 3 колючки. В отдельных популяциях, однако, особи с 2 колючками составляли до 11 %, а с 4 до 17 %. Этот же автор обнаружил, что пресноводная форма leiurus более изменчива по числу колючек, чем морская trachurus. В ряде пресноводных популяций частота особей с 2 и 4 колючками в 5—6 раз превышала таковую в морских популяциях (Gross, 1978а). Отмечено возрастание частоты колюшек с 2 колючками по мере продвижения на юг Европы (Penczak, 1965). Гросс (Gross, 1977) полагает, что большая частота фенотипов с 2 колючками на юге говорит о меньшей интенсивности давления хищников на колюшку.
Популяции колюшки с редуцированным числом спинных колючек часто встречаются на северо-западе США и Канады, на Тихоокеанском побережье, например в озерах на островах близ Британской Колумбии (Moodie, Reimchen, 1973, 1976а; Bell, 1984). В оз. Бультон (острова Королевы Шарлотты, Канада) рыбы с 1 и 2 колючками составляли 47 % популяции (Moodie, Reimchen, 1976а), а в озере на о. Тексадо (Канада) те же фенотипы составляли 40% популяции (Bell, 1974). Как правило, в этих популяциях у рыб утрачиваются 1-я и 2-я спинные колючки. У ископаемых колюшек с того же о. Тексадо была обнаружена полная редукция всех 3 колючек у 96% рыб (Bell, Haglund, 1982). Дефицит числа спинных колючек отмечен также для ряда шотландских популяций (Великобритания) (Campbell, 1979). Во всех перечисленных случаях параллельно происходят утрата брюшных колючек, редукция тазового пояса и числа боковых костных пластин.
Для объяснения этого феномена выдвигают 2 причины (не взаимоисключающие): 1) редукция числа колючек детерминируется ослаблением пресса хищников или их отсутствием (Moodie, Reimchen, 1976а; Campbell, 1979), а также наличием убежищ от хищных рыб (Larson, 1976); 2) редукция числа колючек детерминируется низкой концентрацией ионов кальция в олиготрофных озерах, так что идет отбор на низкое содержание кальция в наружном костном скелете (Giles, 1983).
Интересное исследование провел Реймчен (Reimchen, 1980) на оз. Бультон, где он выявил разнонаправленные давления отбора со стороны разных хищников на спинные и брюшные колючки трехиглой колюшки. Автор нашел, что нормальный фенотип (3 спинные и 2 брюшные колючки) чаще встречается в открытой части озера, где особи подвергаются давлению хищничества со стороны рыбоядных птиц, а редуцированный фенотип (2 спинные и 0 брюшных колючек) — около побережья на мелководье в зоне растений. Отсутствие хищных лососевых рыб в этом озере привело к обилию крупных беспозвоночных (рыбоядных насекомых; личинок стрекоз, водных, жуков и т. д.), которым легче схватывать, по мнению Реймчена, «околюченную» поверхность рыбы, чем гладкую. Поэтому пространственную гетерогенность фенотипов колюшки он интерпретирует как отражение давления хищных птиц в открытых водах и насекомых — в литоральной зоне. Эта несомненно привлекательная гипотеза нуждается в экспериментальной проверке.
Логично предположить, что эффективность защиты от хищников-рыб зависит не только от полного набора колючек, но и от их длины и степени зазубренности. Положительную корреляцию между крупными колючками и наличием хищных рыб в водоемах Хаген и Гильбертсон (Hagen, Gilbertson, 1972) нашли на тихоокеанском побережье Сев. Америки в пресных водах, Муди (Moodie, 1972b) и Муди и Реймчен (Moodie, Reimchen, 1976а) на островах Королевы Шарлотты в озерных популяциях, а Гросс (Gross, 1978а) в пресных водоемах Европы. Последний также обнаружил, что морские колюшки имеют более длинные и зазубренные колючки, чем пресноводные. Однако все это лишь косвенные доказательства отбора на длинные колючки. Прямые доказательства были получены лишь Муди (Moodie, 1972b): он нашел, что колюшки из желудков лосося Salmo clarki имели более короткие колючки, чем рыбы из озера.
У чернопятнистой колюшки, Gasterosteus wheatlandi, не отмечено изменчивости по числу колючек, во всех изученных популяциях встречаются рыбы только с 3 спинными колючками (Sargent et al., 1984).
Все виды девятииглых колюшек рода Pungitius (Pungitius pungitius, Pungitius platygaster, Pungitius tymensis, Pungitius sinensis) в Евразии не обнаруживают заметной изменчивости по числу спинных колючек (пределы колебаний 7—11, модальное число колючек 8—10) и достоверно не отличаются по средним (Зюганов, 19846). Существуют две географические точки, где число спинных колючек у Pungitius pungitius меньше 8: Ирландия (Ure, 1962, — цит. по: Nelson, 1971а), где найдены рыбы даже с 1 спинной колючкой, и Греция (бассейн р. Сперхиос), где у рыб встречается от 1 до 6 спинных колючек (Stephanidis, 1971).
На Дальнем Востоке среди 3 видов девятииглых колюшек наблюдаются достоверные различия по длине спинных колючек: у солоноватой формы Pungitius pungitius они длиннее, чем у пресноводной пелагической Pungitius sinensis, а у последней в свою очередь длиннее, чем у придонной, обитающей в зоне густой вегетации, Pungitius tymensis, отличающейся очень короткими спинными и брюшными колючками. Pungitius tymensis также отличается меньшим числом спинных колючек от Pungitius sinensis и Pungitius pungitius. Различия по длине спинных колючек между Pungitius tymensis и двумя другими видами, очевидно, генетически закреплены, поскольку полученные в эксперименте гибриды tymensis х pungitius и tymensis х sinensis обнаруживают мозаичность по этому признаку: перед спинным плавником у них чередуются длинные и короткие колючки, т. е. гены взаимодействуют аддитивно (совместно, без доминирования) (Kobayashi, 1957).
В Европе спинные колючки Pungitius platygaster по длине меньше, чем у Pungitius pungitius (Зюганов, 19846), но различия эти недостоверны. Принимая во внимание более «зарослевый» образ жизни Pungitius platygaster, можно также было ожидать существенного уменьшения длины колючек, по аналогии с Pungitius tymensis, но, видимо, в лиманах Черного моря пресс хищников выше, чем в водоемах Сахалина (Гомелюк, 1978).
В Сев. Америке прибрежные популяции Pungitius pungitius (принадлежащей к так называемой берингийской форме) имеют достоверно большее число спинных колючек, чем колюшки из внутренних материковых популяций (миссисипская форма) (McPhail, 1963). Мак-Фейл полагает, что две формы переживали Висконсинское оледенение в разных рефугиумах (Берингийском и Миссисипском) и что различия по числу колючек означают различия в фенотипическом ответе организмов на условия среды во время развития.
Берингийская форма также имеет более длинные колючки, чем миссисипская, у первой наблюдается клина уменьшения длины колючек к северу, а у второй формы никаких пространственных клин не обнаружено (McPhail, 1963). Автор предполагает, что при высокой солености воды понижение температуры вызывает уменьшение длины колючек к северу.
Culaea inconstans в Канаде обнаруживает значительную изменчивость по числу спинных колючек (от 4 до 7, мода — 5), но не найдено какой-либо связи между числом колючек и факторами внешней среды (Moodie, 1977).
Нельсон (Nelson, 1969) исследовал изменчивость длины 1-й спинной и брюшной колючек у 62 популяций из Канады и США и нашел, что самые длинные колючки имели колюшки из района Великих Озер (от Висконсина до Огайо), и длина колючек уменьшалась на запад, север и восток от этого района. Самые короткие колючки у рыб были на северо-западе ареала этого вида. Автор полагает, что отсутствие альтернативных видов жертв на северо-западе ареала не позволяет хищникам переключиться на незащищенные колючками виды жертвы, и это переводит колючки Culaea inconstans в разряд неэффективного защитного механизма. Наоборот, в этом районе отбор благоприятствует короткоколючковым особям с прогонистым телом и легким тазовым скелетом и рыбам, более способным укрываться в густой растительности.
Apeltes quadracus обнаруживает широкую изменчивость по числу спинных колючек (от 1 до 7). По встречаемости числа колючек они располагаются в таком порядке: 4, 5 > 3, 6 > 1, 2, 7 (Blow, Hagen, 1981). Географических клин не обнаруживается, зато есть зачастую резкие различия между соседними популяциями. Наследуемость числа колючек довольно высока — коэффициент наследуемости равен 0.61 (Hagen, Blow, 1983). Авторы на базе своих обширных данных полагают, что отбор со стороны хищников благоприятствует фенотипам с наибольшим числом колючек, а отбор со стороны конкурентов — с наименьшим числом. От соотношения этих двух факторов в каждом конкретном водоеме и зависит разнообразие фенотипов Apeltes quadracus.
Spinachia spinachia не обнаруживает заметной изменчивости по числу спинных колючек; по данным Гросс (Gross, 1978b), средние по всем выборкам из северо-западной Европы существенно не отличались от 15 (пределы колебаний от 14 до 16).
У всех 5 родов сем. Gasterosteidae имеются парные брюшные колючки, вместе с 1 или 2 мягкими лучами образующие брюшные плавники. Брюшная колючка является элементом тазового пояса, имеющего у всех колюшковых в общем сходную структуру (Coad, 1973). Только в 3 родах тазовый пояс претерпевает ту или иную степень редукции, вплоть до полного исчезновения его в некоторых популяциях (Gasterosteus, Pungitius и Culaea). Тазовый пояс — билатеральный орган, каждая половинка его содержит восходящий отросток (у Gasterosteus он пространственно перекрывается и скреплен с передними костными латеральными пластинами) и брюшную пластину, имеющую передние и задние отростки. У Gasterosteus, Pungitius и Culaea левая и правая половинки брюшной пластины посредством шва сращены вместе, формируя единую костную пластину, покрывающую переднюю часть брюха (Nelson, 1971а; Wootton, 1976). Тазовый пояс всех видов колюшек располагается непосредственно под кожей и не связан с грудным скелетом.
Тазовый пояс у колюшковых обнаруживает значительную межродовую изменчивость (рис. 2). Задние отростки брюшной пластины у Apeltes и Spinachia содержат 2 заостренных зубца, образующих вилку; эти зубцы лежат латеральнее, чем колючки. У этих 2 родов нет восходящих отростков тазового пояса. Spinachia spinachia выделяется среди других видов тем, что ее тазовый пояс сдвинут сильнее всего назад по отношению к грудному плавнику. Кроме того, передние отростки брюшной пластины имеют вилкообразную форму, а у Apeltes передние отростки сращены посредством шва в единую пластину. Восходящие отростки тазового пояса у Gasterosteus имеют вогнутую форму, так же как и у Pungitius и Culaea, но относительно более высокие, чем у двух последних.
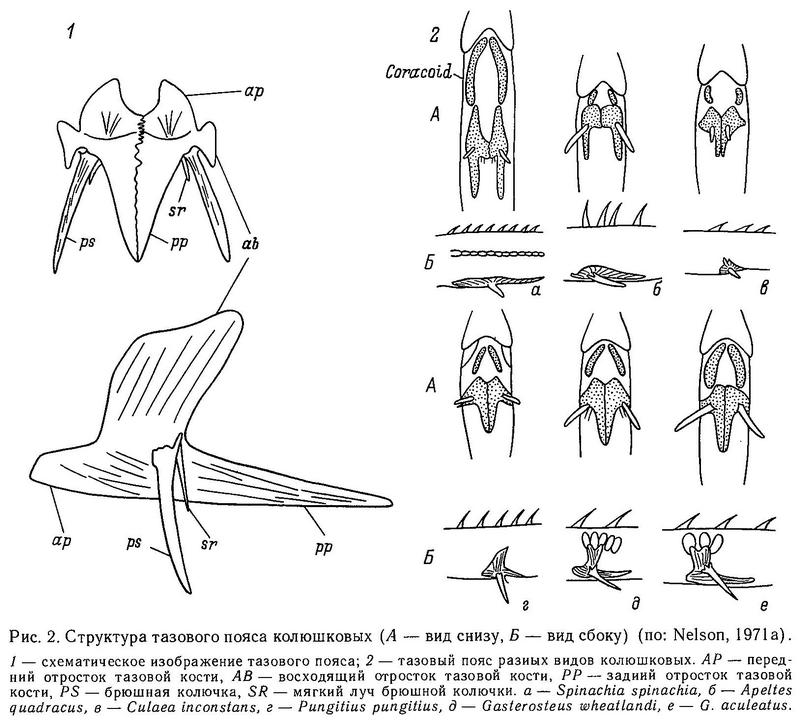
2 мягких луча в брюшном плавнике имеются у морских и солоноватых видов Gasterosteus wheatlandi, Apeltes quadracus, Spinachia spinachia. У Gasterosteus aculeatus, Pungitius pungitius, Pungitius sinensis, Pungitius platygaster имеется 1 мягкий луч, у Pungitius tymensis — мягкие лучи в брюшном плавнике отсутствуют (Берг, 1949).
Изменчивость тазового пояса у Gasterosteus aculeatus. Гросс (Gross, 1978а) показал, что восходящий отросток тазового пояса длиннее у морской формы колюшки на севере Европы, а также у пресноводных популяций, находящихся под прессом хищных рыб. Реймчен (Reimchen, 1983) отмечал положительную корреляцию между длиной спинной колючки и степенью перекрывания птеригофоров спинной колючки с боковыми пластинами, так что перекрывание это укрепляет прочность опоры спинной колючки. Чем длиннее восходящий отросток тазового пояса, тем больше степень перекрывания между ним и боковыми пластинками, так что это перекрывание может стабилизировать брюшные колючки при схватывании колюшки хищной рыбой.
Gasterosteus является одним из трех родов, где выражена та или иная степень редукции тазового пояса, вплоть до полной его утраты.
Большинство популяций с редуцированным поясом описаны с западного побережья Сев. Америки: островов Королевы Шарлотты (Moodie, Reimchen, 1973), о. Тексадо (Британская Колумбия, Канада) (Bell, 1974), у ископаемого позднемиоценового вида Gasterosteus doryssus (Невада, США). Однако Кэмпбелл (Campbell, 1979) описал редукцию пояса для озерных популяций колюшки на островах близ побережья Шотландии (Великобритания), что указывает на конвергентную природу и независимое возникновение этой редукции.
Кэмпбелл (Campbell, 1979) и Жиль (Giles, 1983), проведя скрещивания, продемонстрировали генетическую природу межпопуляционных различий фенотипов с разной степенью редукции тазового пояса. Белл (Bell, 1984) исследовал индивидуальное развитие тазового пояса у нормального (не редуцированного) фенотипа и обнаружил детальное сходство центров окостенения при формировании передних отростков тазового пояса с остатками тазового пояса в «редуцированных» популяциях. На основании этого он пришел к выводу о гомологии между ними, и редуцированные фенотипы он рассматривает как результат педоморфоза (неотении).
Часто наблюдается связь между редукцией тазового пояса и уменьшением числа спинных колючек. Выше была описана работа Реймчена (Reimchen, 1980), показавшая связь между обилием водных насекомых, имеющих хватательные придатки (личинки стрекоз), и утратой у колюшек спинных и брюшных колючек. Видимо, колючки увеличивают вероятность схватывания мальков рыб насекомыми — такой механизм Реймчен (Reimchen, 1980) предлагает для объяснения этого феномена. На западном побережье Сев. Америки Муди и Реймчен (Moodie, Reimchen, 1976а) и Белл (Bell, 1974) для многих популяций обнаружили существенную корреляцию между отсутствием хищных рыб в водоемах и отсутствием тазового пояса. Такая ситуация может быть результатом сдвига в селективной смертности: от доминирующей роли хищников к доминированию насекомых. Однако имеются и иные случаи: в оз. Пакстон (о. Тексадо, Канада) (Larson, 1976) и в некоторых шотландских популяциях (Campbell, 1979; Giles, 1983) обнаружены популяции колюшек с редуцированным тазовым поясом при наличии хищных рыб, симпатричных с колюшкой (Salmo clarki, Salmo trutta и другие лососевые). Эти озера имеют низкую концентрацию кальция (важнейшего элемента, необходимого для формирования костной ткани), в то же время соседние с ними озера с большей концентрацией кальция являются местообитаниями колюшек с нормальным тазовым поясом. Жиль (Giles, 1983) предлагает кальциевый механизм редукции тазового пояса (редукция таза вследствие трудностей изъятия кальция для постройки костной ткани тазового пояса из слабоминерализованной воды резко олиготрофных озер). Белл (Bell, 1984) предполагает, что редукция тазового пояса детерминируется обоими механизмами (недостатком кальция и отбором со стороны насекомых в отсутствие хищных рыб), но сам же приводит данные, противоречащие обеим гипотезам (на Аляске найдены колюшки с редуцированным тазовым поясом и нормальной выраженностью 3 спинных колючек).
К этому можно добавить, что, по моим наблюдениям, в бассейне Белого моря (Лоухский р-н КАССР) колюшки с 3 спинными колючками и нормальным тазовым поясом обитают в олиготрофных озерах при наличии хищников Salmo trutta, Perca fluviatilus (оз. Кривое и оз. Святое на о. Великом), в олиготрофных озерах при отсутствии хищников (озера Лобанежское, Безымянное), а также в эвтрофных озерах при наличии хищников (оз. Ваняево) и при отсутствии хищников (озера Крестовое, Машинное). Это еще более запутывает ситуацию. Видимо, в разных регионах действуют разные механизмы отбора на этот признак, и относительный вклад каждого механизма меняется как в пространстве, так и во временной шкале в эволюции вида.
Популяции Pungitius pungitius с высокой частотой фенотипов с редуцированным тазовым поясом найдены в 5 районах ареала: в бассейне р. Солт (Северо-Восточная Канада), бассейне р. Шэннон (Ирландия) (Nelson, 1971а), бассейне р. Сперхиос (Греция) (Stephanidis, 1971), бассейне Кандалакшского залива Белого моря (Зюганов, 1989) и в бассейне р. Тымь (Сахалин) (Таранец, 1937). Это явно свидетельствует о политопном происхождении редукции таза. В канадских выборках из бассейна р. Солт наблюдался следующий размах изменчивости тазового пояса: от полной выраженности через присутствие одной из колючек и части брюшной пластины до наличия лишь остатка одной маленькой косточки брюшной пластины (Nelson, 1971а).
В 10 ирландских популяциях, обнаруживающих редукцию таза, 86% особей были лишены таза вообще (суммарно для всех популяций), 6.5% имели промежуточную степень редукции и 7.5% имели нормальный тазовый пояс (всего n=109) (Nelson, 1971b). Среди 3 популяций бассейна р. Солт (Канада), имеющих ту или иную степень редукции таза, 1 (оз. Фокс Хольс) обнаружила 100%-ное отсутствие таза, а в 2 других примерно 30% особей имели полную или частичную редукцию (Nelson, 1971b). Судя по канадским и ирландским выборкам, редукция таза возникает в одном бассейне реки, а популяции из сопредельных бассейнов такой редукции не обнаруживают. Коад (Coad, 1973) на большом числе выборок, собранных на востоке и северо-западе Канады, обнаружил, что феномен редукции пояса имеет место во многих популяциях, но с очень низкой частотой — около 2%. Видимо, «редуцированные» фенотипы достигают высокой частоты в каких-то отдельных географических точках, где для них имеются благоприятные условия. Попытки определить, что это за условия, пока больших успехов не имели. Нельсон (Nelson, 1971b) отмечал некоторое уменьшение у «редуцированных» фенотипов длины брюшных, спинных колючек и расстояния между основаниями брюшных колючек, однако это уменьшение укладывается в размах изменчивости тех же признаков у «нормальных» фенотипов. Белл (Bell, 1984) полагает, что уменьшение у «редуцированных» фенотипов вышеуказанных 3 признаков в совокупности приводит к уменьшению поперечной площади сечения рыбы. По его мнению, все это связано с различиями в интенсивности давления хищничества на разные фенотипы и отражает отбор структуры тазового пояса у Pungitius. Однако Gasterosteus aculeatus, симпатричная с ирландскими популяциями Pungitius (с редуцированным тазом), имеет нормальный тазовый пояс, в то время как Culaea inconstans, симпатричная с одной из канадских популяций Pungitius pungitius с редуцированным поясом, также полностью утратила pelvis, и редукция pelvis у Culea из этого региона Канады — обычное явление (Nelson, 1971b). В Греции в бассейне р. Сперхиос обитает Pungitius pungitius с редуцированным тазовым поясом (причем есть серия переходов от наличия брюшной пластины до наличия лишь одной — остатков левой или правой небольшой косточки pelvis). В том же водоеме обитает Gasterosteus aculeatus с нормальным pelvis (Stephanidis, 1971).
На территории СССР редукция тазового пояса у Pungitius pungitius отмечена только для Северной Карелии (Лоухский р-н, побережье Кандалакшского залива, Белое море). Интересно, что 100%-ную утрату таза обнаруживают не только озерные пресноводные популяции (озера Машинное, Безымянное), но и солоноватоводная форма из морских заливов (губа Чупа, Левин Наволок). Если редукцию таза у озерных популяций и можно объяснить отсутствием пресса хищников в озерах, то для морской популяции это объяснение не годится, поскольку в прибрежной зоне Белого моря разнообразие хищников велико: навага, сельдь, бельдюга, маслюк, различные бычки, тресковые и т. д. (Алтухов и др., 1958). Кроме того, в тех же озерах (например, Машинное, Безымянное), где нет других видов хищных рыб, симпатрично обитают популяции трехиглой колюшки с нормальным тазовым поясом.
У Pungitius platygaster, ведущей зарослевый образ жизни в большей степени, чем Pungitius pungitius, редукции тазового пояса не отмечалось ни в одной из описанных популяций (Световидов, 1964, с. 173; Miinzing, 1969), и в среднем длина брюшной колючки не отличается от таковой у Pungitius pungitius (Зюганов, 19846). У дальневосточного вида Pungitius sinensis также нет существенных отличий по длине брюшной колючки от Pungitius pungitius (Kobayashi, 1957; Зюганов, 1985а). Однако вид Pungitius tymensis, встречающийся на Сахалине и о. Хоккайдо (Япония) и ведущий (подобно Pungitius platygaster) донный, зарослевый образ жизни в литоральной зоне пресных водоемов, имеет очень короткие брюшные колючки, не имеет мягких лучей в брюшном плавнике, внешние отростки тазового пояса слабо развиты (Берг, 1949, с. 969). Таранец (1937, с. 29) отмечал, что в р. Тымь многие колюшки Pungitius tymensis были лишены брюшных колючек.
Итак, несмотря на сходные ниши, занимаемые Pungitius tymensis и Pungitius platygaster (зона густой литоральной растительности), и сходство в соответствующих адаптациях (оба имеют одинаковую маскирующую окраску, короткое и высокое тело, закругленной формы хвост, короткий и высокий хвостовой стебель, обнаруживают поведенческую реакцию затаивания и т. д.), у Pungitius tymensis наблюдаются закономерное уменьшение длины спинных и брюшных колючек и редукция тазового пояса, а у Pungitius platygaster нет. Возможно, это связано с тем, что обитающий в более низких широтах Pungitius platygaster все же сталкивается (несмотря на уход в зону густой вегетации) в южных водоемах с прессом хищников — бычки рода Neogobius, водяной и обыкновенный ужи, болотная черепаха (Гомелюк, 1978), а более северный Pungitius tymensis избежал давления хищничества, уйдя в зону растительности (в более высоких широтах меньше разнообразия хищников).
Culaea inconstans. Географическая изменчивость тазового пояса этого североамериканского эндемика изучена в основном благодаря работам Нельсона (Nelson, 1969, 1977; Nelson, Atton, 1971). В большинстве популяций pelvis развит полностью, но по длине брюшных колючек (как и по длине спинных) имеется клина к уменьшению колючек с юго-востока на северо-запад ареала. На «коротком» конце клины в Онтарио, Саскачеван, в провинциях Альберта (Канада) существуют популяции с высокой частотой редукции и утратой pelvis. Частота фенотипов, «редуцированных» в относительно нормальных популяциях, с развитым pelvis никогда не превышала в провинции Манитоба (Канада) 2.7 % (Moodie, 1977), в то время как частота колюшек, утративших pelvis, в некоторых популяциях из Альберты достигает 100 % (Nelson, Atton, 1971; Nelson, 1977). Степень редукции pelvis и форма редуцированных тазовых поясов имеют непрерывную серию промежуточных форм от полностью выраженного таза до полной его утраты, все эти переходы можно наблюдать внутри одной популяции (Nelson, Atton, 1971). Белл (Bell, 1984) на основании наблюдения индивидуального развития тазового пояса у Culaea пришел к выводу, что механизмом редукции pelvis является педоморфоз. Нельсон (Nelson, 1977) отмечал стабильность частот фенотипов с разной выраженностью развития тазового пояса в разные годы в одной и той же популяции. Он показал, что отсутствие тазового пояса находится под частичным генетическим контролем.
Что касается механизма, детерминирующего клину уменьшения длины брюшных и спинных колючек и относительной высоты тела Culaea к северозападным районам Канады, и причин существования популяций с редуцированным pelvis на северном окончании этой клины, то Нельсон (Nelson, 1969) и Белл (Bell, 1984) предполагают, что главным фактором отбора являются хищники. Большая длина брюшных, спинных колючек и большая высота тела колюшки в совокупности обеспечивают большую площадь сечения рыбы, что затрудняет проглатывание рыбы хищными позвоночными. Известно, что хищные рыбы (щука, окунь) при наличии выбора в эксперименте склонны скорее хватать рыб с мягкими лучами в плавниках, нежели колюшек (Hoogland et al., 1957). Нельсон (Nelson, 1969) полагает, что отсутствие альтернативных видов рыб-жертв с мягкими лучами в плавниках на севере не позволяет хищникам переключиться на эти виды, что влечет за собой перевод колючек Culaea в разряд неэффективного защитного механизма, и это приводит в итоге к укорочению колючек. Фенотипы Culaea с отсутствием таза чаще встречались в водоемах, где нет хищников (Nelson, 1977), что предполагает исключение отбора по тазовому поясу. Тем не менее популяции Culaea inconstans с редуцированным тазом не обнаруживают укорочения или уменьшения числа спинных колючек по сравнению с популяциями с нормальным тазом, как это происходит в большинстве случаев у трехиглой колюшки.
Интересную работу по выявлению селективных факторов поддержания полиморфизма по «тазовым» фенотипам провел Рейст (Reist, 1980а, 1980b, 1981) на популяции оз. Вакомао (провинция Альберта, Канада). Он сочетал наблюдения в природе с аквариальными экспериментами. Обнаружилось, что в ручьях, впадающих в озеро, частота рыб с нормальным pelvis (в сравнении с редуцированным фенотипом) существенно выше, чем в озере. После зимы также увеличивается частота рыб с нормальным тазом по сравнению с редуцированным фенотипом, но летом наблюдается возврат к первоначальному положению. Несмотря на сезонную динамику частот «тазовых» фенотипов в озере, они оставались стабильными за 7-летний период, что свидетельствует о различиях в приспособленности фенотипов на разных стадиях жизненного цикла. Экспериментально было выявлено, что смертность от дефицита кислорода была одинаковой у двух фенотипов. Однако было обнаружено, что в желудках крупных щук (Esox lucius) (более 18 см длиной) рыбы с нормальным тазом встречались с большей частотой, чем ожидаемая, а рыбы с редуцированным тазом — с меньшей. Аквариумные эксперименты выявили, что мелкие щуки (длиной 11—18 см) потребляли колюшек разных фенотипов в среднем случайно (в одинаковой степени), но когда в аквариумах были сделаны укрытия, то бестазовые колюшки выедались намного сильнее, чем дикий тип. Эксперименты эти хорошо согласуются с природными наблюдениями о том, что в ручьях, где больше укрытий по сравнению с озером, наблюдается избыток дикого типа. Однако Рейст в своих опытах пошел еще дальше: он предлагал щукам на выбор (при отсутствии укрытий в аквариуме) колюшек без таза и колюшек «дикого типа», но с отрезанными брюшными колючками — в этом случае селективно больше выедались искусственно «обесколюченные» рыбы. Отсутствие следов зубов щуки на теле оставшихся в живых в эксперименте указывает, что отнюдь не механическим преимуществом в выскальзывании изо рта хищника обладает бестазовый фенотип. Скорее всего, бестазовые рыбы компенсируют отсутствие колючек более скрытным, осторожным поведением.
Факт сезонных флюктуаций частот фенотипов объясняется действием других хищников — водных насекомых. Рейст (Reist, 1980а) в аквариумных опытах установил, что жук-плавунец Dytiscus селективно выедал «дикий тип» в том случае, если у рыб было 5, но не 6 спинных колючек, гигантский водяной жук Letocerus americanus и личинки стрекоз рода Aeshna не являются селективными хищниками по тазовым фенотипам. Рейст пришел к выводу, что наличие в водоемах обилия водных насекомых приводит к отбору на утерю тазового пояса, в то время как мелкие хищники-рыбы обеспечивают противодействующий отбор. Возможно, из-за разных соотношений этих двух факторов в разных водоемах и наблюдаются различия в частотах по тазовым фенотипам в разных популяциях Culaea inconstans. Кроме того, поскольку хищные рыбы также выедают водных насекомых, то при полном отсутствии хищных рыб эффект насекомых может проявляться в полной мере и приводить к 100%-ной утере тазового пояса в таких популяциях (Reimchen, 1980).
Apeltes quadracus. Этот вид имеет длинные и зазубренные брюшные колючки, каждая из парных колючек связана с 2 мягкими лучами и образует брюшной плавник (Leim, Scott, 1966; Scott, Crossman, 1973).
Spinachia spinachia. Брюшные колючки этого вида очень маленькие, каждая спарена с 2 мягкими лучами и образует брюшной плавник. По отношению к грудному плавнику брюшной сдвинут назад дальше, чем у любого другого вида колюшковых. У Spinachia и Apeltes не обнаружена редукция таза.
Таким образом, у колюшковых рыб колючки имеют в целом три важные функции: защитный механизм от хищных рыб, сигнальная роль для полового партнера при размножении и сигнальная роль для конспецифичных конкурентов при охране потомства. Две последние функции будут проанализированы в соответствующих разделах (2.8.2 и 2.8.3). Анализ изменчивости колючек в свете их защитной функции дает возможность исследовать эффект хищничества как механизма отбора по защитным структурам колюшковых. Редукция числа спинных колючек известна только у Gasterosteus aculeatus и Apeltes quadracus, и в обоих случаях в большинстве исследованных популяций обнаружена корреляция между снижением давления хищничества рыб и редукцией числа колючек. Уменьшение длины спинных колючек показано для Culaea inconstans и Pungitius tymensis, но вызвано оно у двух видов, по-видимому, разными причинами: у Pungitius tymensis переходом в новую адаптивную зону густой растительности, недоступной для лососевых рыб-хищников, а у Culaea inconstans из-за неэффективности колючек как средства защиты от хищников ввиду отсутствия на северо-западе Канады альтернативных видов—жертв.
Редукция брюшного плавника и тазового пояса колюшковых также весьма интересна. Дело в том, что среди лучеперых рыб (Actinopterygii) известны по крайней мере 33 семейства (Nelson, 1971b), где имеет место редукция таза. Причем в некоторых из них лишь отдельные виды претерпевают редукцию pelvis, а в других целые группы теряют pelvis (Anguilloidei, Syngnatidae), и лишь у 3 видов колюшек (Gasterosteus, Pungitius и Culaea) отсутствие — присутствие pelvis встречается в пределах отдельной локальной популяции, что является уникальным среди рыб. Несмотря на то что брюшные колючки играют у колюшек важную сигнализирующую роль при нересте (например, ярко-белые брюшные колючки самца Pungitius pungitius на фоне угольно-черного тела помогают ориентированию самки при ведении ее самцом к гнезду), диморфизм (присутствие — отсутствие колючек) не приводит к репродуктивной изоляции между этими двумя фенотипами. Например, групповые скрещивания между самцами Pungitius pungitius из р. Сходня (с колючками) и самками из оз. Машинного (без колючек), а также реципрокное скрещивание в небольших изолированных прудах дали плодовитое потомство (Зюганов, Розанов, 1987). Белл (Bell, 1984) отмечал, что только у 3 родов колюшковых тазовый пояс имеет восходящий отросток (Gasterosteus, Pungitius, Culaea), и только у них же наблюдается редукция таза. Причины такой связи остаются неизвестными. Ясно одно, что редукция эта полифилетична, произошла независимо в каждом таксоне. Кроме того, географическое распространение редукции таза у Gasterosteus aculeatus и Pungitius pungitius нельзя объяснить монофилетическим происхождением ее в каждом таксоне. У Culaea inconstans эта редукция, напротив, имеет место только на северо-западе ее ареала.
Эксперименты по скрещиванию фенотипов с разной степенью редукции таза у Gasterosteus (Campbell, 1979; Giles, 1983), Culaea (Nelson, 1977) и у Pungitius (наши данные) показывают, что редукция эта находится под генетическим контролем, но в разных родах детерминируется разными способами.
Существование симпатрических популяций бестазовых Pungitius и имеющих нормальный тазовый пояс Gasterosteus в водоемах Ирландии (р. Шеннон) (Nelson, 1971b), Греции (Stephanidis, 1971) и озерах Беломорского побережья (СССР) (Зюганов, Розанов, 1987) говорит о том, что редукция pelvis у этих двух родов вызывается разными причинами.
Однако для Gasterosteus и Culaea предполагаются общие причины (Bell, 1984): хищники выступают в качестве селективных сил, благоприятствующих хорошо развитому тазу, но в отсутствие в водоеме хищных рыб водные насекомые становятся более обильными, и они выступают как селективная сила, благоприятствующая колюшкам с редуцированным тазом. Эта гипотеза экспериментально подтверждена только на Culaea (Reist, 1980а, 1980b, 1981).
Мне кажется, что и для родов Culaea и Gasterosteus хищники не являются общей причиной редукции таза. Вследствие того что роды занимают в водоеме разные ниши (более пелагическая и привязанная к открытым пространствам Gasterosteus aculeatus и придонная зарослевая Culaea inconstans), они несомненно имеют и разный набор хищников. Хищники эти применяют разную тактику охоты за жертвами, а жертвы разную тактику защиты. В частности, Gasterosteus aculeatus использует свои морфологические адаптации (крепкие и длинные спинные и брюшные колючки, скрепленные боковыми пластинками и восходящим отростком тазового пояса) и подпускает хищника на близкое расстояние (Hoogland et al., 1958), а Culaea inconstans, лишенная связи спинных и брюшных колючек посредством боковых пластин, должна использовать поведенческие адаптации, подобно такой же зарослевой форме, как Pungitius pungitius, которая, как известно, демонстрирует скрытное и осторожное поведение и реагирует на хищника с дальней дистанции (Wootton, 1976).
Нашу точку зрения подтверждает тот факт, что у Gasterosteus наблюдается четкая корреляция между редукцией таза и редукцией других защитных структур (спинными колючками, боковыми пластинами) (Campbell, 1979; Reimchen, 1980; Giles, 1983), а у Pungitius и Culaea такой корреляции нет, за исключением двух точек — в Ирландии (Nelson, 1971b) и Греции (Nelson, 1971b; Nelson, Atton, 1971; Stephanidis, 1971).
Многое еще предстоит выяснить в отношении механизмов редукции таза в этих 3 родах и механизмов поддержания полиморфизма внутри популяций по этому признаку. В частности, Белл (Bell, 1984) выдвинул интересную гипотезу о возможности дифференциального репродуктивного успеха среди имеющих колючки и не имеющих колючек фенотипов, поскольку сигнальное значение выпрямления колючек во время территориальных стычек и ухаживания за самкой известно у всех 3 родов (Wootton, 1976). Экспериментальная проверка этой гипотезы обещает интересные результаты.
Пока же ясно, что редукция таза имеет во всех 3 родах генетическую основу и полиморфизм по «редукции» в ряде популяций поддерживается селективными механизмами. Дальнейшее детальное выяснение генетической детерминации редукции таза у разных видов и в разных популяциях колюшек, а также взаимодействия и относительного вклада разных селективных сил в поддержание полиморфизма по этому признаку обещает обогатить теорию эволюционной и экологической генетики.
1.7. БОКОВЫЕ КОСТНЫЕ ПЛАСТИНЫ
Как уже отмечалось в разделе 1.3, в отличие от большинства костистых рыб у колюшковых рыб нет чешуи, а тело покрыто боковыми костными пластинами (щитками) — гомологом дермальных костей (Penczak, 1961а). Число, форма и характер расположения этих пластин на теле обнаруживают значительную изменчивость как между разными видами колюшковых, так и внутри некоторых видов, входящих в семейство. Исследования этой изменчивости формируют один из главных разделов эволюционной биологии колюшковых рыб. Интересно, что у ближайших родственников колюшек — представителей сем. Aulorhynchidae также имеются боковые костные пластины (Wootton, 1976). Боковые пластины — метамерные структуры, расположенные в один ряд вдоль боковой линии тела, обычно одна пластина на миомер. У Gasterosteus, Pungitius и Spinachia пластины на теле перекрываются друг с другом, налегая одна на другую черепицеобразно. Боковые пластины — билатеральный признак. Если на теле пластины — плоские структуры, то на хвостовом стебле у ряда видов родов Gasterosteus, Pungitius и Spinachia они имеют сильно выраженный гребень на каждой пластине. Пластины на стебле сливаются друг с другом, и гребни образуют киль, расположенный в дорсовентральной плоскости. Киль — также билатеральный признак. Вуттон (Wootton, 1976) полагает, что киль помогает рыбе, ускользающей от хищника, лучше маневрировать в пространстве, в вертикальной и горизонтальной плоскости (известно, например, что киль на хвостовом стебле есть у таких хороших пловцов, как скумбриевые и тунцовые).
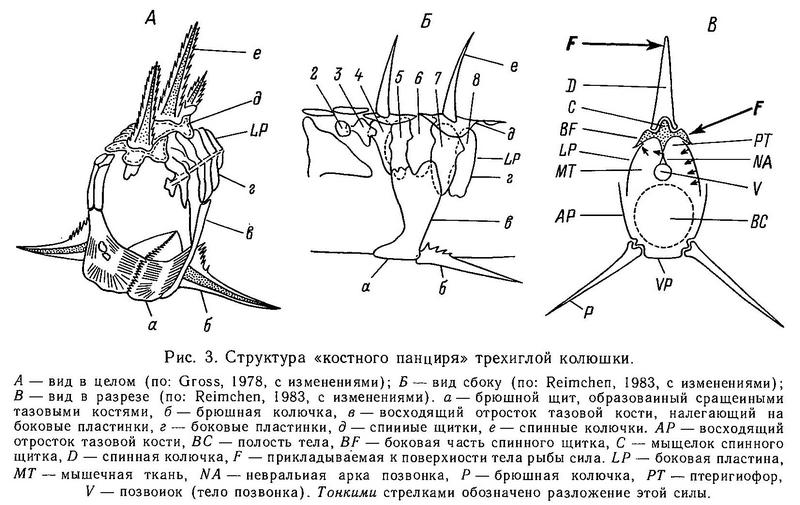
Адаптивное значение боковых пластин на теле до конца непонято. В принципе боковые пластины относятся многими авторами к разряду защитных структур (Bell, 1984), особенно это относится к видам Spinachia spinachia (морская форма), Gasterosteus aculeatus (морская форма) и Pungitius sinensis (пелагическая пресноводная форма). У перечисленных видов полный ряд пластин как бы заключает тело с боков в костный панцирь (хотя и не со всех сторон). Леа (Lea, 1968, — цит. по: Wootton, 1976) показал, что многопластинковые особи Gasterosteus aculeatus будто бы испытывали меньший урон после схватывания хищников, чем малопластинковые, но экспериментальных доказательств этого пока мало. К тому же на севере ареала в Европе, Азии и Америке малопластинковые колюшки сосуществуют с хищными рыбами (лососями) в тысячах озер. Реймчен (Reimchen, 1983) на трехиглой колюшке показал, что когда внешнее усилие прикладывается к первым двум спинным колючкам, то оно передается на боковые пластины, предотвращая отклонение спинных колючек в стороны (рис. 3). В разделе 1.6 описывался замковый механизм, обеспечивающий фиксацию колючек в выпрямленном состоянии и предотвращающий складывание колючек назад. Боковые же пластины обеспечивают предотвращение наклона колючек в стороны. Стабильность колючек весьма важна, когда хищная рыба пытается заглотить колюшку, поэтому 4—5 абдоминальных боковых пластин, связанных, с одной стороны, с восходящим отростком тазового пояса, а с другой — с птеригофорами спинных колючек, функционально очень важны, так как создают как бы жесткое кольцо вокруг передней части тела. Неясно, однако, какова роль других боковых пластин, лежащих спереди и сзади от этих 4—5 абдоминальных пластин. Кроме того, неясно, какова роль полного ряда относительно мелких пластин у Spinachia spinachia и Pungitius sinensis, не связанных с брюшными и спинными колючками, как у Gasterosteus aculeatus.
Межродовая изменчивость числа боковых пластин. В пределах всего семейства число боковых пластин варьирует от 0 до 41. Наибольшее число пластин (суммарно на теле + на киле) у Spinachia spinachia — 41. Судя по всему, этот вид не обнаруживает заметной изменчивости по числу пластин (Leiner, 1934; Nelson, 1971а; Wootton, 1976; Gross, 1978b).
У трехиглой колюшки число пластин колеблется (суммарно на теле + на киле) от 0 до 35. Огромная изменчивость пластин у представителей этого таксона и факторы, ее определяющие, рассмотрены в обширной литературе, более подробный анализ которой будет дан ниже. Можно привести лишь ссылки на некоторые обобщающие работы: Penczak, 1965, 1966; Miller, Hubbs, 1969; Hagen, McPhail, 1970; Wootton, 1976; Bell, 1976, 1984; Hagen, Moodie, 1979, 1980; Зюганов, 1983г. В ряде работ дан анализ наследования разных морф по числу пластин (Munzing, 1959; Lindsey, 1962а; Hagen, 1973; Hagen, Gilbertson, 1973; Avise, 1976; Ross, 1973; Paepke, 1982; Зюганов, 1983г.).
У чернопятнистой колюшки, Gasterosteus wheatlandi (американского эндемика), до недавнего времени была выявлена изменчивость лишь 5—11 пластин на теле (киля нет) (Wootton, 1976), но позднее были обнаружены популяции с большим числом пластин — до 30 (Sargent et al., 1984).
У видов рода Pungitius число пластин варьирует от 0 до 34, киль есть у всех видов, кроме Pungitius platygaster и Pungitius pungitius laevis.
У Gulaea inconstans имеется ряд в 30—36 маленьких круглых, не налегающих друг на друга пластин вдоль боковой линии тела, и второй дополнительный ряд из 4—5 пластин в передней части тела, лежащий выше основного ряда, киля нет (Nelson, 1969, 1971а).
У Apeltes quadracus пластин на теле и киля нет, тело голое, вид этот мономорфен (Nelson, 1971а).
Таким образом, по степени развития боковых щитков можно построить следующий ряд (от наиболее полной выраженности к полной редукции признака): Spinachia — Gasterosteus — Pungitius — Culaea — Apeltes.
Обзор межродовой изменчивости колюшковых по числу боковых пластин выявляет 3 мономорфных рода, где нет заметной изменчивости по этому признаку (Spinachia, Culaea, Apeltes), и 2 чрезвычайно полиморфных рода Gasterosteus и Pungitius, включающих комплекс видов и форм, где в сумме реализованы 8 фенотипов, обнаруживающих удивительный межродовой параллелизм (Зюганов, 19836).
Все разнообразие морфологических вариантов по числу костных пластин в родах Gasterosteus и Pungitius по существу можно свести к 8 основным типам (рис. 4). Имеется всего 4 градации признака «пластины на теле»: 1) пластины полностью покрывают тело (20—30, чаще 25—27), 2) пластины частично покрывают тело (10—20, чаще 12—15), 3) пластин на теле мало (2—10, чаще 5—7), 4) пластин на теле нет (0). Это не условно выделяемые градации с плавным непрерывным переходом друг в друга, а реально существующие дискретные варианты в природных популяциях; если строить кривую распределения этого признака, суммируя множество популяций, то мы получим 4-модальную кривую с 4 пиками и 3 провалами между ними.

Имеется также 2 градации признака «киль на хвостовом стебле»: а) киль есть, б) киля нет. Более дробное разделение — киль сильно выражен и киль слабо выражен — мы не учитываем (здесь, как и в любой другой классификации живых объектов, неизбежно некоторое огрубление, поскольку чрезмерное дробление еще более опасно, чем огрубление).
Таким образом, все возможные сочетания 4 градаций пластин на теле и 2 градаций киля дают нам 8 возможных фенотипов (=морф, =морфотипов) у Pungitius и Gasterosteus. На основании литературных данных и собственных эксперименов по скрещиванию разных морф я полагаю, что пластины на теле и киль — два разных признака, детерминируемые разными локусами, но в ряде популяций эти локусы сцеплены (Зюганов, 1983 г.) (см. раздел 4.5).
Как и всякая попытка формализации, эта схема не лишена некоторых элементов условности. Например, в полиморфных природных популяциях Gasterosteus aculeatus иногда трудно отнести некоторые особи к варианту 1(а) (trachurus) или к 2(а) (semiarmatus) в том случае, когда у этих особей имеется разрыв шириной в одну пластину между пластинами на теле и килем. Однако Хаген и Гильбертсон (Hagen, Gilbertson, 1973) отмечали, что скрещивания между такими особями давали расщепления в F1, характерные для trachurus. Скрещивания между особями с аналогичными разрывами, но шириной в 2 пластины (или более) давали расщепления, характерные для semiarmatus. Бывают случаи, когда с одной стороны тела у рыбы полный ряд пластин, а с другой — разрыв между килем и пластинами на теле. В этом случае, вероятно, надо при отнесении рыбы к тому или иному морфотипу ориентироваться на ту сторону, где признак наиболее развит, а другую сторону считать недоразвитием признака. Я не исключаю также возможности существования в ряде случаев фенокопий (модификация фенотипа, вызванная особыми условиями среды, напоминающая изменение фенотипа, обусловленное мутацией) (Майр, 1974), хотя до сих пор у трехиглой колюшки они обнаружены не были (Hagen, Gilbertson, 1973).
Род Gasterosteus. У трехиглой колюшки Gasterosteus aculeatus наиболее полно реализованы 4 фенотипа: 1(a) (trachurus), 2(a) (semiarmatus), 3(b) (leiurus), 4(b) (hologymna) (рис. 4). Остальные фенотипы встречаются намного реже, а фенотип 4(a) (hologymna с килем) вообще до сих пор не найден в природных популяциях и никогда не выщеплялся в экспериментах по скрещиванию разных морф. Фенотип 1(b) (trachurus без киля) до недавнего времени также не был найден в природе. Лишь в 1983 г. мной был обнаружен 1 экз. трехиглой колюшки, представленный этим фенотипом (24 пластины на теле слева, 23 — справа, киля нет) в популяции «Карьер-солоноватый» на побережье губы Чупа (Кандалакшский залив, Белое море). Фенотип 2(b) (semiarmatus без киля) также представлен лишь 5 экз., пойманными в пресном оз. Марцы (о. Великий, Белое море), где обитает триморфная популяция (trachurus + semiarmatus + leiurus). Все 5 рыб не имели киля и имели от 15 до 17 пластин на теле (Зюганов, 1983 г). Данными о колюшках этого фенотипа из других мест я не располагаю. Фенотип 3(a) (leiurus с килем) обнаружен в турецком оз. Изник (Munzing, 1962). Популяция «Изник» мономорфна по этому фенотипу (3—7 пластин на теле, киль есть). Мономорфные популяции «leiurus с килем» описаны для некоторых озер Сев. Америки (Hagen, Gilbertson, 1972; Kynard, Curry, 1976; Coad, Power, 1974; Hagen, Moodie, 1982).
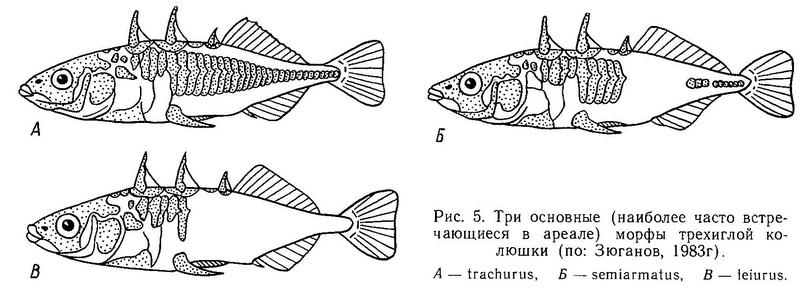
Классификация морф, принимаемых зарубежными авторами, несколько отличается от вышеизложенной классификации, принимаемой мной, хотя последняя базируется на классификации европейских авторов, просто она несколько расширена, в нее включены фенотипы, ранее неизвестные. Кроме того, главное ее отличие от других классификаций в том, что пластины на теле и на киле рассматриваются мной как разные признаки, а зарубежные авторы объединяют их в один признак. К тому же европейские и североамериканские авторы для обозначения одних и тех же морф используют разную терминологию.
Европейские авторы выделяют всего 4 фенотипа (trachurus, semiarmatus, leiurus, hologymna) (Bertin, 1925; Münzing, 1959; Wootton, 1976). Trachurus — тело полностью покрыто пластинами, переходящими на хвостовом стебле в киль; semiarmatus — пластины есть на теле и киле, но между первыми и последними всегда есть разрыв; leiurus (в старой литературе gymnurus) — пластины есть лишь в передней части тела, киля нет; hologymna — пластин на теле и киля нет. Таким образом, европейские авторы не выделяют фенотип «leiurus с килем», относя его к морфе semiarmatus (например, Мюнцинг, (Münzing, 1962) мономорфную популяцию «leiurus с килем» из оз. Изник называет semiarmatus-тип»),
В Европе большинство особей морфы trachurus образует анадромную морскую форму, морфа leiurus образует жилые пресноводные популяции, и в зоне пространственного перекрывания между ними (побережье западной части Балтийского моря и южной части Северного моря) наблюдается повышенная частота морфы semiarmatus, которую большинство европейских авторов трактует как результат интерградации (гибридизации) в послеледниковое время (Münzing, 1972; Paepke, 1982). Американские авторы считают, что в европейской терминологии термины trachurus, leiurus и semiarmatus приобрели нежелательные экологическое и эволюционное сопутствующие значения и что все это приводит к путанице, и воздерживаются от использования европейской классификации. Хаген и Муди (Hagen, Moodie, 1982) и Белл (Bell, 1984) используют свою классификацию морф: complete — полная серия пластин вдоль тела; partial — серия пластин в передней и хвостовой части тела, разделенная «неопластиненным» голым участком: low — серия пластин только в передней части тела. Нетрудно видеть, что complete, partial и low соответствуют trachurus, semiarmatus и leiurus по фенотипическому выражению. Однако американские авторы настаивают, что термином trachurus были обозначены все морские популяции, а термином leiurus — все жилые пресноводные популяции независимо от их фенотипической структуры; сюда же они предлагают включить и partial, и complete.
На мой взгляд, как раз это и будет вносить путаницу в терминологию, поскольку в Европе нет такой большой генетической дистанции, как в Америке, между пресноводной и морской группировками. Как будет показано ниже, пресноводная leiurus легко возникает из морской trachurus при определенных условиях (см. раздел 4.5).
Вид Gasterosteus wheatlandi также изменчив по числу боковых пластин, как и Gasterosteus aculeatus. У него выделены морфы, сходные с low, complete и partial, но между partial и complete нет дискретности, а наблюдается непрерывный переход (Sargent et al., 1984).
Род Pungitius. В нем реализованы все 8 фенотипов, причем в отличие от Gasterosteus каждый фенотип имеет достаточно широкую распространенность. Тем не менее самое ограниченное распространение имеет фенотип 2(a) (semiarmatus), встречаясь лишь в гибридных зонах интрогрессии между Pungitius sinensis и Pungitius pungitius в Японии на островах Хонсю (Tanaka, 1982), Хоккайдо (S. Tanaka, личн. сообщ.) и в СССР на Сахалине (наши данные). Вид Pungitius sinensis имеет фенотип 1(а) (обширный ареал на Дальнем Востоке от Кореи до Камчатки). Форма Pungitius platygaster имеет фенотип 1(b) (бассейны Черного и Каспийского морей). Форма Pungitius platygaster aralensis имеет фенотип 2(b) (бассейн Аральского моря). Фенотип 3(a) представлен видами Pungitius pungitius (обширный циркумполярный ареал в Евразии и Сев. Америке) и Pungitius tymensis (Сахалин и Хоккайдо); фенотип 3(b) — многими популяциями Pungitius platygaster aralensis; фенотип 4 (а) — миссисипской формой Pungitius pungitius (Сев. Америка) и многими популяциями вида Pungitius tymensis, фенотип 4(b)— формой Pungitius pungitius laevis (Франция, Великобритания).
Как можно видеть из всего вышеизложенного, в изменчивости по боковым пластинам между родами Gasterosteus и Pungitius наблюдается поразительный параллелизм, и фенотипы по числу пластин в обоих родах образуют гомологические ряды. Интересно, что «пластинковые» фенотипы Spinachia spinachia (trachurus, 1(a) и Apeltes guadracus (hologymna, 4(b)) занимают в гомологическом ряду сем. Gasterosteidae крайние положения и лишь фенотип Culaea inconstans не вписывается в этот ряд. Возможные механизмы гомологической изменчивости «пластинковых» фенотипов, генетика, онтогенез и географическое распространение этих фенотипов и селективные факторы, детерминирующие становление и преобразование фенотипической изменчивости по числу боковых пластин, будут подробно рассмотрены в разделе 4.5.
1.8. КИШЕЧНИК
Пищеварительный тракт колюшек состоит из пищевода, желудка, сравнительно короткой и прямой передней тонкой кишки и задней прямой кишки (ректума). С кишечником функционально связаны печень, желчный пузырь, поджелудочная железа и селезенка. Жировые отложения обнаруживаются вдоль кишки: они начинаются сразу позади желудка, но количество их возрастает к концу кишечника (Wootton, 1976). Желчный проток открывается, как и у других рыб, имеющих желудок, позади желудка.
Морфологию и гистологию желудочно-кишечного тракта трехиглой колюшки подробно исследовал Хейли (Hale, 1965). В ротовую полость колюшки пища всасывается посредством расширения ротовой и жаберной полостей. Затем из ротовой полости пища проходит в глотку и пищевод. Передняя кишка четко обособлена от желудка пилорическим сфинктером, а от задней кишки илеоректальным клапаном. У колюшки длина кишки ненамного превышает длину полости тела. Поверхность внутренней стенки кишечника имеет характерную складчатость. Складки увеличивают поверхность кишечника и тем самым способствуют лучшему воздействию пищеварительных соков на пищу. Гистологически кишечник колюшки в принципе сходен с кишечником других костистых рыб и относительно прост. Внутренняя стенка кишечника покрыта однослойным цилиндрическим эпителием, среди которого имеются бокаловидные слизистые клетки (секретирующие слизь) и недифференцированные полихедральные клетки. Последние располагаются в желобках продольных складок слизистой оболочки, а слизистые клетки — по сторонам складок. Под эпителиальным находится слой соединительной ткани, волокна соединительной ткани расположены «беспорядочно», среди них изредка встречаются отдельные волокна поперечнополосатых мыщц. Под слоем соединительной ткани расположен тонкий слой кольцевых поперечнополосатых мышечных волокон, а под ними — слой продольных мышечных волокон. Пищевод отделен от желудка мощным сфинктером, состоящим из субэпителиальной соединительной и мускульной ткани. Вероятно, этот сфинктер предотвращает возврат пищи из желудка в пищевод. В желудке пища начинает подвергаться биохимической обработке, т. е. начинается процесс пищеварения. Желудок изнутри выстлан эпителием, имеющим секреторные клетки, которые выделяют пищеварительные соки. Ниже лежит слой субэпителиальной соединительной ткани, слой продольных мышц и слой круговых мышц. В передней части желудка больше поперечнополосатых мышц, а в задней — гладких. Кроме того, задняя часть желудка почти не содержит пищеварительных желез, но мускульный слой в несколько раз толще, чем в передней части желудка. Пилорический сфинктер предотвращает возврат пищи из кишки в желудок, а илеоректальный клапан — возврат фекалий из прямой кишки в переднюю.
При перемещении пищи по кишечному тракту происходит не только выделение пищеварительных соков, но и всасывание питательных веществ. Вероятно, поэтому в передней кишке кроме секретирующих слизь бокаловидных клеток появляются бокаловидные абсорбирующие клетки с бороздчатой поверхностью, обращенной в просвет кишечника. Также появляются лимфоциты и мелкие лейкоциты. Подобно пищеводу и желудку, в передней кишке под эпителиальным слоем расположен слой соединительной ткани, далее слой круговых мышц и слой продольных мышц. Складчатость слизистой эпителиальной оболочки кишечника (по типу елочки) напоминает таковую у морского ерша (Строганов, 1962; Hale, 1965). Гистологически прямая кишка («ректум») не отличается от передней кишки (Hale, 1965).
С точки зрения классификации пищеварительной системы рыб Строганова ( 1) хищный (= окуневый), тип кишечника, когда желудок хорошо отдифференцирован; 2) мирный (= карповый), когда желудка нет, — 1962, с. 282), колюшка несомненно относится к первому типу, хотя и питается мелкими живыми объектами в силу собственных малых размеров. Тем не менее в ориентации на пищу колюшка пользуется почти исключительно зрением, имеет хищные повадки охоты и предпочитает животный корм, хотя, являясь эврифагом, не чурается и фитопланктона. Поэтому неудивительно, что у нее относительно короткий кишечник и хорошо отдифференцированный желудок, как у типичной хищной рыбы. Пилорических придатков у колюшки нет.
Кроме желудочно-кишечного тракта в пищеварении колюшки, как и других рыб, играют роль еще ряд органов: печень, желчный пузырь и поджелудочная железа. У печени колюшки две доли, правая несколько больше левой, изгибается вокруг желудка. В печени откладываются запасы жира и гликогена, протекают и другие биохимические реакции. Печень вырабатывает желчь, которая собирается в желчном пузыре. У колюшки желчный пузырь заключен между правой долей печени и желудком, протока желчного пузыря открывается в кишку сразу позади пилорического сфинктера. Ткань поджелудочной железы (которая продуцирует ферменты, расщепляющие белки, жиры и углеводы) в значительной степени срастается с печенью и располагается рядом с пилорическим сфинктером. Кроме того, поджелудочная железа продуцирует гормон — инсулин (Hale, 1965). В ней найдены крупные островки Лангерганса (Baron, 1934).
Желудочный сок у колюшек кислый (рН 2.5—5.5), что означает наличие в желудке НСl, продуцируемой железистыми клетками желудка (Hale, 1965).
1.9. ПЛАВАТЕЛЬНЫЙ ПУЗЫРЬ
Колюшковые относятся к закрытопузырным рыбам. Как и у других рыб, у колюшек развитие плавательного пузыря может рассматриваться как выпячивание кишечной трубки с последующей специализацией. Пузырь несет функцию гидростатического органа. У взрослых колюшек непарный плавательный пузырь расположен в дорсальной части брюшной полости. У молоди он связан с кишечником, но через несколько дней после вылупления (на 2—3-й день) личинки поднимаются на поверхность и заглатывают воздух для наполнения пузыря. Вскоре после этого ductus pneumaticus закрывается и атрофируется и связь с пищеварительным трактом прерывается. При условии заглатывания воздуха на ранних стадиях колюшки развиваются в дальнейшем нормально. Если же не дать им заглотнуть воздух (отделить их сеткой от верхнего слоя воды), то колюшки погибают, как правило, через несколько дней (Ledebur, 1928, — цит. по: Строганов, 1962).
У колюшки после заглатывания воздуха в первые дни жизни дальнейшая регуляция газов в пузыре происходит за счет секреции газов. Поскольку колюшка не может менять давление газа в пузыре посредством глотания, изменение давления достигается за счет секреции газа специальным органом — «чудесной сеткой» (сеть капилляров в стенке пузыря). У Gasterosteus aculeatus пузырь разделен на переднюю и заднюю части посредством диафрагмы. Передняя часть — секреторная, в ней расположено «красное тело», или газовая железа с «чудесной сеткой», а в задней части газ поглощается (резорбируется) (Fange, 1953; Строганов, 1962).
У закрытопузырных рыб регуляция объема плавательного пузыря происходит путем секреции дополнительного количества газа в пузырь при погружении и резорбции газа из пузыря в кровь при подъеме. Процессы адаптации к смене давления, вызываемые компрессией и декомпрессией, обеспечивают стабильность объема плавательного пузыря и минимальные энергетические затраты на поддержание нейтральной плавучести. Ход компрессии и декомпрессии контролируется рефлекторно. Цветков (1973) экспериментально показал, что у девятииглой колюшки компрессия и декомпрессия регулируются сигналами с рецепторов натяжения стенки пузыря (интерорецепторов). Экстерорецепторы (зрение и тактильная рецепция) играют в этой регуляции лишь вспомогательную роль.
1.10 СКЕЛЕТ И МЫШЦЫ
Детальное описание скелета колюшковых дано во многих работах (Kampf, 1962; Banister, 1967, — цит. по:Wootton, 1976; Nelson, 1971а; Mural, 1973; Anker, 1974). Поскольку я не имею в распоряжении целиком работы Банистера, а только рисунки из нее, то буду ссылаться на монографию Вуттона (Wootton, 1976), широко использовавшего описания скелета, сделанные Банистером.
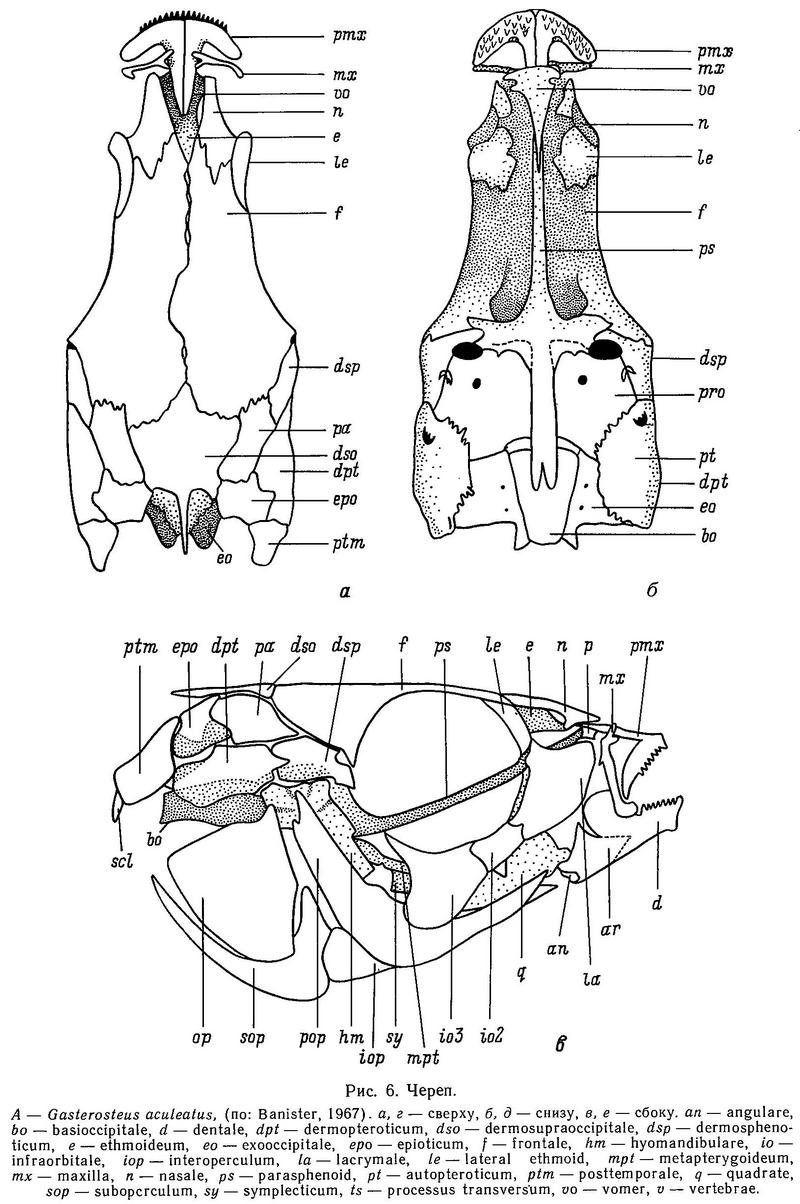
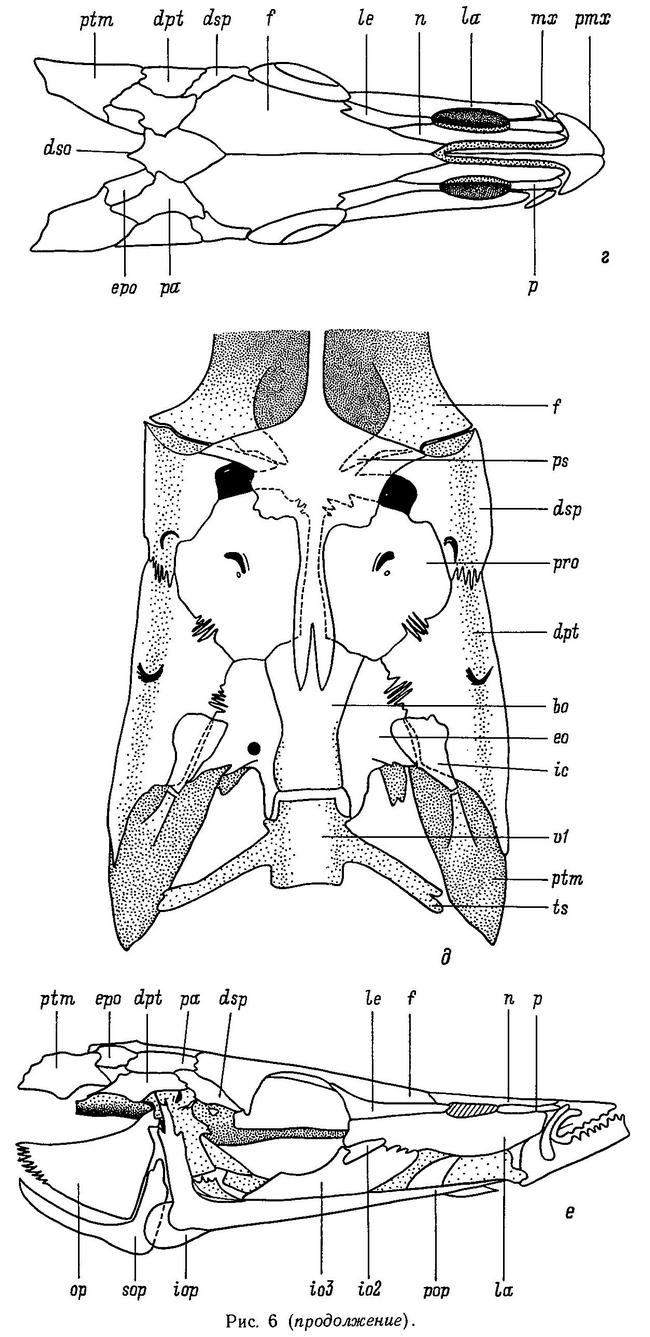
У трехиглой колюшки Gasterosteus aculeatus маленький конечный рот, однако нижняя челюсть несколько выдается за верхнюю. Парная верхняя челюсть состоит из 2 костей: premaxilla и maxilla, восходящий отросток premaxilla лежит на ростральном хряще. Парная нижняя челюсть состоит из 3 костей: dentale, angulare и articulare; последняя сочленяется с quadrate, формируя челюстное сочленение (рис. 6). Только premaxilla и dentale несут мелкие острые зубы, на остальных костях зубов нет. Связь между челюстями и neurocranium (мозговой коробкой) осуществляется через подвеску, состоящую из 6 костей: hyomandibulare, metaptherygoid, symplecticum, quadrate, pterygoid и autopalathine (рис. 7). В верхней дорсальной части центральной «рукоятки» hyomandibulare имеются две головки, которые сочленяются с мозговой коробкой (neurocranium): одна головка входит в полость у стыка autosphenoticum и костей prooticum,a другая головка входит во впадину на вентральной поверхности кости autopteroticum (есть еще третья головка, hyomandibulare, она сочленяется с operculum, образуя связь между челюстью и жаберным отделом головы, — Wootton, 1976).
Особенность устройства челюстного сочленения колюшки состоит в том, что у нее отсутствуют челюстные связки (ligamentum), которые перекрещивались бы со связками между ethmoid-блоком и palatine, premaxilla и maxilla. Это связано со способностью колюшки к выпячиванию верхней челюсти при захвате пищи. Механизм этого выпячивания описан Александером (Alexander, 1967). В исходном положении, когда рот закрыт, premaxilla втянута (отведена назад), но когда колюшка открывает рот, чтобы схватить жертву, premaxilla выпячивается и остается в таком же положении даже когда жертва схвачена и рот уже закрыт. Выпячивание достигается двумя способами. 1. При открывании рта maxilla поворачивается вперед так, что соединяется с каракоидным отростком нижней челюсти, вследствие этого premaxilla сдвигается относительно maxilla. Это вызывает сжатие рострального хряща с этмоидным хрящом и таким образом premaxilla выпячивается. 2. При открывании рта натягивается артикулярно-максиллярная связка (лигамент); натяжение этой связки поворачивает maxilla вдоль ее продольной оси, двигая мыщелок maxilla вперед. Ткань хрящевая, связывающая premaxilla с премаксиллярным мыщелком maxilla, также связана с ростральным хрящом, так что поворот maxilla вокруг своей продольной оси влечет за собой выпячивание premaxilla (Alexander, 1967). Выдвижной рот обычно имеют рыбы, питающиеся мелкими объектами (Алеев, 1963).
Выпячивание челюстей дает колюшке при питании немалые преимущества. Во-первых, рот колюшки выдвигается очень быстро и резко приближается к пищевому объекту, так что жертве остается меньше шансов увернуться от рта. Во-вторых, выпячивание облегчает колюшке сбор пищи со дна, когда тело рыбы находится под углом ко дну. В-третьих, при питании мелким планктоном можно втянуть в рот больший объем воды. И, в-четвертых, это облегчает глотание (Alexander, 1967).
Другим (передним) краем hyomandibulare сочленяется с metaptherygoid — следующей костью в подвесной системе. У Gasterosteus hyomandibulare образует с продольной осью тела угол 80°, а «сфенотическая» и «оперкулярная» головки расположены относительно рукоятки под острым углом. Между тем у Pungitius угол hyomandibulare с осью тела составляет 65°, а «сфенотическая» и «оперкулярная» головки образуют с рукояткой почти прямой угол. Hyomandibulare у Culaea по форме и ориентации промежуточен между Gasterosteus и Pungitius. Hyomandibulare Apeltes сходен с таковым Gasterosteus, но образует с metaptherygoid особо прочное сочленение. Мурал (Mural, 1973) предполагает, что в отличие от всех других родов колюшек, вентилирующих гнездо с помощью хорошо развитых грудных плавников, Apeltes вентилирует гнездо всасыванием-выплевыванием воды. Возможно, поэтому требуется более прочная связь между этими двумя элементами подвески. У Spinachia угол между hyomandibulare и осью тела самый острый по сравнению с другими родами; видимо, такая ориентация связана с необычайно длинной головой и «острорылостью» Spinachia (Mural, 1973).
Следующая кость в подвесной системе — metaptherygoid; она простирается от переднего конца hyomardibulare и наклонена вниз к symplecticum, примыкая к ее боковой поверхности. В свою очередь symplecticum своим передним концом сочленяется с quadrate. Эта кость формирует переднюю часть челюстного сочленения. У Gasterosteus symplecticum имеет относительно широкий задний конец и суживается кпереди. И дорсальная и вентральная части symplecticum имеют костяные выступы (гребни), но гребень дорсальной части значительно шире. Culaea имеет сходный symplecticum, но дорсальный гребень выражен слабее, чем у Gasterosteus. Pungitius имеет длинный и узкий symplecticum с более слабо выраженными дорсальным и вентральным гребнями. У Apeltes дорсальный гребень (выступ) symplecticum перекрывается с отростком pterygoid — костью, которая расположена впереди и выше от symplecticum и сзади от quadrate. Spinachia имеет удлиненный, слабо окостеневший symplecticum, но дорсальный гребень его увеличен по сравнению с другими родами и перекрывается с pterygoid, как и у Apeltes (Mural, 1973; Banister, 1967, — цит. по: Wootton, 1976).
Сочленение с передним концом symplecticum обеспечивает кость quadrate. Именно эта кость вкупе с другими сочленовными костями формирует челюстное сочленение. Quadrate имеет форму развернутого веера с длинным тонким вентральным отростком, который прикрепляется к переднему концу preoperculum (одной из костей жаберной крышки). У Spinachia этот отросток и длинный, и широкий, а сама quadrate слабо разделена на 2 сегмента мелкой выемкой в кости. Сзади от quadrate расположен pterygoid. У костистых рыб эта кость обычно состоит фактически из 3 костей: meta-, endo- и ectopterygoid, но у сем. Gasterosteidae имеется только две из них — metapterygoid и трехлучевой pterygoid. Банистер (Banister, 1967, — цит. по: Wootton, 1976) полагает, что трехлучевой pterygoid колюшек фактически представлен слившимися endo- и ectopterygoid. Однако Мурал (Mural, 1973) считает, что endopterygoid у колюшек утерян и трехлучевая кость есть не что иное, как ectopterygoid.
Задний широкий отросток pterygoid контактирует с symplectic, маленький средний отросток примыкает к quadrate, а передний отросток (называемый палатинным) прилегает к autopalatine.
Gasterosteus имеет относительно широкий pterygoid, Pungitius — относительно узкий, a Culaea — промежуточный. Apeltes, как и Gasterosteus, имеет широкий pterygoid, но у него также имеется дорсальный гребень на конце заднего отростка. Задний отросток pterygoid у Spinachia очень длинный и широкий (Mural, 1973; Banister, 1967, — цит. по: Wootton, 1976).
Судя по костям головного отдела, наиболее сходная группа родов — Gasterosteus, Pungitius, Culaea, a Apeltes и Spinachia отличаются от них и друг от друга. Spinachia также имеет ряд вышеописанных особенностей в форме костей из-за вытянутого рыла (Wootton, 1976).
Крыша черепа. Череп у колюшковых удлиненной формы и суживается кпереди (конусообразный) (Anker, 1974). Топографически череп делится на 4 отдела: этмоидальный, орбитальный, отический и затылочный (Anker, 1974). Крыша черепа сформирована костями: nasale, frontale, parietale, dermosupraoccipitale (рис. 6). Ha palatine отсутствуют зубцы. Особенностью черепа колюшковых являются большие размеры глазниц. Глазные орбиты окаймляют следующие кости: дорсальную часть окаймляет frontale, переднюю часть глазниц — lacrymale и 2-я + 3-я infraorbital, а заднее окаймление глазниц у колюшек необычно в сравнении с другими костистыми, поскольку есть редукция некоторых костей infraorbital. У колюшек заднюю стенку глазницы формирует нисходящий отросток frontale, который контактирует со спинным выступом parasphenoid. Supraethmoid отсутствует, что также не характерно в целом для костистых рыб. У колюшек неполная серия инфраорбитальных костей, причем меньше всего инфраорбитальных костей у Apeltes. Pterosphenoid у колюшек также отсутствует (Wootton, 1976).
Жабры. Жабры колюшковых защищены от внешней среды жаберной крышкой, фактически состоящей из 4 кожных костей: sub-, inter-, preoperculum и operculum (Anker, 1974). У колюшек имеется 5 жаберных дужек, но только 4 из них несут жабры. В норме каждая дужка состоит из дорсального (epibranchiale) и вентрального элементов (ceratobranchiale). Каркасом, который скрепляет эти элементы, является pharyngobranchiale, который расположен дорсальнее epibrachiale; роль каркаса выполняют также hypo- и basibranchiale, которые расположены вентральнее ceratobranchiale. У Gasterosteus epibranchiale имеются на дужках от 1-й до 4-й, ceratobranchiale — от 1-й до 5-й, в то время как hypobranchiale и basibranchiale найдены на дужках от 1-й до 3-й. Pharyngobranchiale имеется на 2-й дужке (рис. 7).
На внутренних сторонах жаберных дужек имеются выступы — жаберные тычинки, а на внешних — жаберные лучи, к которым прикреплены жаберные лепестки. Жаберные лепестки свободно висят в жаберной полости, они покрыты тонкими, поперечно стоящими складочками (вторичные пластинки), которые называются лепесточками. Служат они для увеличения площади поверхности диффузии кислорода. Обе стороны лепесточков имеют эпителий, состоящий из плоских клеток, есть также опорные клетки, разделяющие обе стороны лепесточков. Края этих опорных клеток ограничивают кровяной промежуток в лепесточках. Такое устройство лепесточков укорачивает путь, который должен пройти кислород, чтобы диффундировать в кровь. Хлоридные клетки, принимающие участие в осморегуляции (см. раздел 2.7), расположены у основания лепестков и изредка в лепесточках (Matthiessen, Brafield, 1973).
У Gasterosteus и Culaea operculum имеет прямоугольную форму с хорошо развитыми передним и задним отростками. Pungitius и Spinachia имеют треугольный operculm с хорошо развитыми отростками. Operculum у Apeltes треугольный, но с вогнутым дорсальным краем и менее развитыми отростками. Все виды колюшковых имеют серповидный suboperculum и по его форме распадаются на две группы: Gasterosteus, Culaea, Spinachia и Apeltes, Pungitius. Interoperculum имеет заострение в передней части и широкий задний сегмент, сходный у всех родов. Preoperculum завершает серию жаберных костей. Эта кость имеет вертикальный сегмент и горизонтальную рукоятку, так что напоминает по форме букву Г. У Culaea и Gasterosteus угол между сегментами прямой, а у Pungitius и Spinachia меньше 90°, в то время как у Apeltes больше 90°. Таким образом, по строению жаберной крышки, с одной стороны,объединяются Gasterosteus и Culaea, а с другой — Pungitius и Spinachia (Mural, 1973).
Число жаберных тычинок на 1-й жаберной дужке является таксономическим признаком. Изменчивость по этому признаку у колюшковых будет рассмотрена в разделе 4.5.
Позвонки. Первый позвонок сочленяется с затылочным мыщелком (occipitale condyle), который сформирован только костью basioccipitale. У колюшковых рыб в целом от 28 до 42 позвонков. О межродовой изменчивости позвонков дает представление табл. 2.
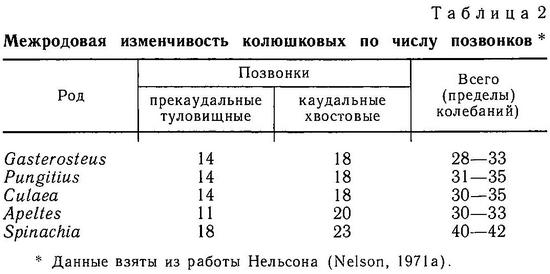
У трехиглой колюшки обычно 14 прекаудальных (абдоминальных) и 18 каудальных позвонков, так что 1-я гемальная дуга обычно начинается с 15-го позвонка. Эпиплевральные ребра находятся, как правило, на первых 13 позвонках, а плевральные ребра с 3-го по 14-й позвонок (рис. 8).
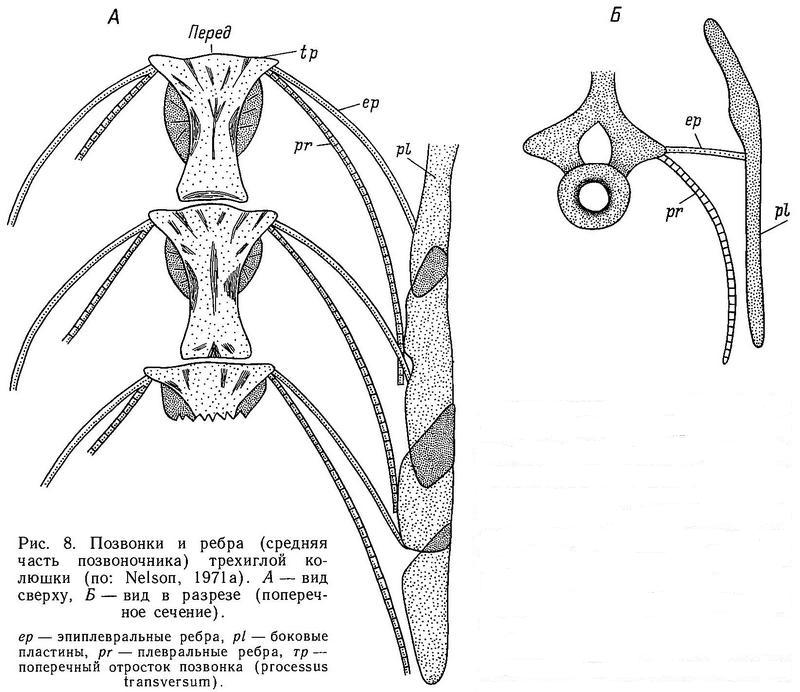
Хвостовой плавник у колюшковых, как и у других костистых рыб, поддерживается гипуральными костями, которые представляют собой увеличенные гемальные арки последнего каудального позвонка. У Gasterosteus aculeatus и Gasterosteus wheatlandi гипуральная пластина расщеплена на верхнюю и нижнюю. Эта особенность является диагностическим признаком рода Gasterosteus (Nelson, 1971а). Гипуральная пластина Spinachia выглядит как единая (Nelson, 1971а). Другие элементы скелета хвостового плавника также обнаруживают межродовую изменчивость. Для Gasterosteus обычна лишь 1 эпиуралия, для Pungitius 2, но они находятся в тесном контакте и представляются как одна косточка; у Culaea эпиуралии разделенные; Spinachia также имеет 2 эпиуралии, Apeltes 1 (Mural, 1973).
Тазовый (брюшной) пояс. Описание тазового пояса было дано ранее в разделе 1.6. Можно лишь напомнить, что по структуре брюшного пояса в одну группу объединяются роды Gasterosteus, Pungitius, Culaea, а 2 остальных рода (Spinachia и Apeltes), не имеющие восходящего отростка пояса и имеющие другой тип строения брюшной пластины, хорошо отличимы от первой группы и сильно различаются между собой (Nelson, 1971а).
Плечевой пояс колюшковых состоит из следующих костей: cleithrum, scapula, coracoid и ectocoracoid, а также костей posttemporale и supracleithrum, связывающих грудной скелет с черепом (рис. 9). Лучи грудного плавника, за исключением самого верхнего, сочленены с 4 actinost (radialii), которые расположены сразу же за scapula и coracoid. Наиболее дорсально расположенная posttemporale (на самом деле являющаяся костью головного отдела) примыкает к черепу. Связь posttemporale с черепом самая прочная у Gasterosteus aculeatus, а самая непрочная у Culaea; у других родов степень прочности сочленения промежуточна. У Gasterosteus wheatlandi posttemporale отсутствует, у Gasterosteus aculeatus она имеет ромбическую форму, у Pungitius и Culaea продолговатую, у Apeltes треугольную с остроконечной нижней частью; у Spinachia она широкая и удлиненная, с разноразмерными нижней и верхней частями. Supracleithrum — маленькая узкая кость, которая связана с posttemporale и cleithrum. У Gasterosteus wheatlandi и Spinachia spinachia она отсутствует. Функциональное значение отсутствия posttemporale и supracleithrum у Gasterosteus wheatlandi неясно. Возможно, это связано с невысокой интенсивностью вентиляции гнезда по сравнению с Gasterosteus aculeatus с помощью грудных плавников во время фазы заботы о потомстве (McInereney, 1969). Однако у Apeltes этот поведенческий элемент (обмахивание грудными плавниками гнезда) вовсе отсутствует: Apeltes вентилирует гнездо при помощи рта (Wootton, 1976), однако и posttemporale, и supracleithrum у нее есть. Cleithrum у всех колюшковых имеет вид длинной и прямой рукоятки с широкой треугольной головкой в верхней дорсальной части кости (Nelson, 1971а). Gasterosteus, Spinachia и Pungitius имеют cleithrum сходной формы: широкий край заднего конца рукоятки с острым дорсальным выступом на головке. У Apeltes и Culaea головка рукоятки имеет округлую форму. Scapula расположена под головкой cleithrum и имеет относительно большое отверстие в передней части (у Apeltes это отверстие редуцировано). Pungitius и Gasterosteus имеют гребень на заднем конце scapula, а под ним расположены несколько actinost. Coracoid расположен под scapula. В переднем отделе coracoid колюшковых нет отверстия, но следы его обнаружены у Apeltes, Culaea и Pungitius. У ближайших родственников колюшек — рыб сем. Aulorhynchidae — отверстие coracoid хорошо развито. Ectocoracoid (= infracleithrum) — наиболее вентрально расположенная кость плечевого скелета. У взрослых особей колюшек она частично сливается с вентральной частью coracoid. У Gasterosteus, Pungitius и Spinachia ectocoracoid вытянут вперед, вниз и по направлению к срединной линии тела рыбы.
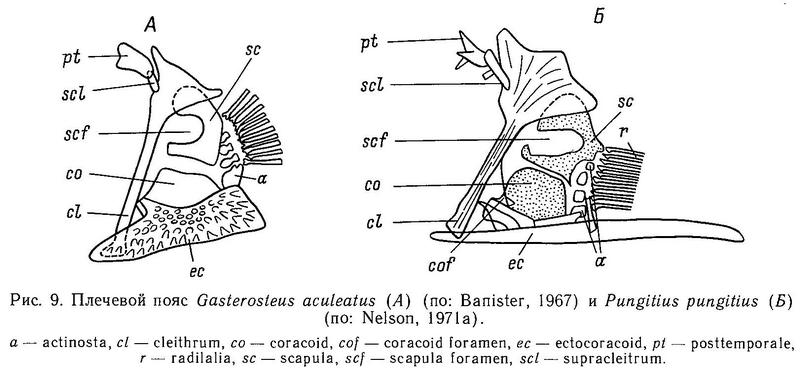
Ectocoracoid у Gasterosteus имеет треугольную форму, а у Pungitius и Spinachia — эта длинная и тонкая кость. У Spinachia (единственного рода среди всех колюшковых) ectocoracoid перекрывается с передним отростком брюшной пластины тазового пояса. У Apeltes нет переднего выступа ectocoracoid, и эта кость не примыкает к нижнему концу cleithrum. Паз (вырезка) заднего края ectocoracoid у Apeltes как бы окружает переднюю часть тазового пояса, который у Apeltes расположен ближе всего к грудному поясу среди колюшковых (Nelson, 1971а).
В целом наиболее сходные грудные скелеты (плечевые пояса) имеют Gasterosteus и Pungitius. Apeltes и Culaea имеют относительно сходные ectocoracoid, cleithrum и scapula, они же в меньшей степени имеют следы коракоидного отверстия. Однако, как видно из обзора изменчивости скелета колюшковых, трудно выявить продвинутые и примитивные признаки для объяснения эволюционных взаимоотношений родов (Nelson, 1971а).
Кампф (Kampf, 1962) и Анкер (Anker, 1974) подробно описали мышцы головного отдела; Хуглэнд (Hoogland, 1951) описал мышцы, ответственные за эрекцию и депрессию колючек. Титчак (Titschak, 1922) описал мускулатуру грудного скелета и отмечал увеличение грудных мышц у самцов при нересте из-за необходимости вентилировать гнездо. Однако, как отмечает Вуттон (Wootton, 1976), мышечная система колюшковых привлекает мало внимания исследователей из-за маленьких размеров объекта.
l.ll. МОЗГ
Нервная система колюшковых, как и других позвоночных животных, состоит из головного, спинного мозга и автономной нервной системы. Головной мозг подразделяется на 3 части: передний (prosencephalon), средний (mesencephalon) и задний (rombencephalon). В свою очередь передний мозг подразделяется на telencephalon и diencephalon (рис. 10) (Nieuwenhuys, 1959).
Как и у других позвоночных, telencephalon колюшковых дифференцируется в процессе онтогенеза из передней части нервной трубки эмбриона. Парные bulbus olfactorius, принимающие аксоны nervus olfactorii, расположены в передней части telencephalon. Основную массу telencephalon составляют парные полушария. В полушариях различают 2 отдела: вентральную и дорсальную области telencephalon. Вентральная область состоит из групп клеток, принимающих нервные волокна из ольфакторных бульб. Часть клеток дорсальной области полушарий также принимает волокна из bulbus olfactorius, но наибольшие нервные связи дорсальная область полушарий имеет с thalamus и hypothalamus (составными элементами diencephalon). Эти связи включают как эфферентные, так и афферентные волокна, из чего следует, что дорсальная часть полушарий и получает, и посылает нервные импульсы к diencephalon. Между вентральной областью полушарий telencephalon и thalamus также есть нервные связи. В задней части telencephalon есть комиссура, связывающая два полушария telencephalon. Позади этой комиссуры расположен preoptic nucleus; клетки, его составляющие, имеют нейросекреторные функции. Нейросекреты выделяются в кровяное русло в нейрогипофизный отдел гипофиза (Segaar, Nieuwenhuys, 1963). Удаление telencephalon не приводит к каким-либо отличиям в общем поведении колюшек и в их способности различать разную окраску (Nolte, 1933). Однако влияние повреждений telencephalon на репродуктивное поведение колюшек выявлено, оно будет обсуждено в разделе 2.8. Diencephalon состоит из epithalamus, hypothalamus и thalamus. Epithalamus содержит пинеальный комплекс и парный хабенгулярный ганглий, принимающий нервные волокна от пинеального комплекса, теленцефалона и преоптических ядрышек. Thalamus имеет нервные связи с передним (telencephalon), средним и задним мозгом и с hypothalamus. Hypothalamus составляет вентральную часть diencephalon. Hypothatamus посылает нервные волокна в гипофиз, где они формируют нейрогипофиз (Dodd, Kerr, 1963). Hypothalamus связан нервными связями со многими отделами мозга: он принимает нервные волокна от переднего и заднего мозга и посылает волокна к переднему, заднему мозгу, thalamus, optic tectum и мозжечку. Повреждение hypothalamus влияет на репродуктивное поведение колюшек (Wootton, 1976). Позади от hypothalamus находятся saccus vasculosus (Benjamin, 1974).
Средний мозг содержит optic tectum, формирующий крышу 3-го желудочка мозга, и tegmentum, формирующий нижний отдел — «пол» желудочка. Lobi optici у колюшки крупные, поскольку зрение в образе жизни колюшек играет важную роль. Каждая доля lobi optici принимает нервные волокна nervus optici с противоположной стороны головы (крест-накрест). Удаление крыши среднего мозга приводило к слепоте колюшек, но не нарушало их нормального плавания (Wootton, 1976).
Мозжечок расположен позади среднего мозга. Предполагается, что его функция заключается в контроле над регуляцией движения (Dodd, Kerr, 1965). Medulla oblongata — наиболее задний участок мозга, здесь головной мозг постепенно переходит в спинной. Гипофиз у колюшек расположен ниже hypothalamus, позади оптической хиазмы и впереди от saccus fasculosus. С мозгом он соединен впереди и сзади тонкой нитевидной тканью. Этот орган имеет 2 компонента, различающихся по своему эмбриологическому происхождению: нейрогипофиз и аденогипофиз. Нейросекреты гипофиза играют большую роль в осморегуляции (Follenius, 1971) (см. также раздел 2.7). Аденогипофиз продуцирует разнообразные гормоны. У всех позвоночных животных гипофиз является главным эндокринным органом, контролирующим активность всей эндокринной системы организма. Он тесно связан с hypothalamus и ответствен за связь между нервной и эндокринной системами. Тонкая структура гипофиза у колюшковых достаточно подробно изучена (Follenius, 1968, 1971; Leatherland, 1970; Benjamin, 1974а, 1974b, 1974с).
1.12. ОРГАНЫ ЧУВСТВ
Зрение является одним из самых важных органов чувств у колюшек. Зрительная поверхность у Gasterosteus aculeatus составляет 3.5% от общей поверхности тела (Beukema, 1968). Поведенческие исследования показали, что Gasterosteus aculeatus имеет цветное зрение с пиком чувствительности к свету 510—594 нм для самок и 502—594 нм для самцов (Cronly-Dillon, Sharma, 1968); показано, что колюшки хорошо различают геометрические фигуры (Meesters, 1940).
Обоняние. Обонятельный эпителий у Gasterosteus aculeatus составляет 0.4% от общей поверхности тела (Teichmann, 1954). Колюшковые рыбы относятся к микросматикам (рыбы, у которых обоняние играет незначительную роль среди других органов чувств) (Голубев, Марусов, 1979). На рыле колюшковых имеются 2 носовых отверстия, ведущих в обонятельную полость, в которой обонятельный эпителий образует всего лишь 2 складки. Вода входит и выходит из обонятельной полости из-за периодического изменения давления, связанного с дыхательными движениями (Wootton, 1976).
Боковая линия. У колюшковых боковая линия развита слабо, особенно в головном отделе (Miyadi, 1929). Вдоль тела каналы боковой линии имеют выход наружу от головы и вплоть до хвостового отдела, выходы канальцев располагаются по одной линии, которая не образует ветвей. У видов колюшковых, имеющих полный ряд боковых пластин (Spinachia spinachia, морская форма Gasterosteus aculeatus, Culaea inconstans, Pungitius sinensis, Pungitius platygaster), канальцы прободают костные пластинки (один каналец на пластинку). У видов и форм колюшковых, не покрытых пластинами (Apeltes quadracus, Pungitius tymensis, Pungitius pungitius laevis, морфа hologymna Gasterosteus aculeatus) или имеющих сильно редуцированный ряд пластин на теле (морфа leiurus Gasterosteus aculeatus, Pungitius pungitius, Pungitius platygaster aralensis), выходы каналов боковой линии окаймлены костными ободками.
Лабиринт, или внутреннее ухо, имеет общее эмбриологическое происхождение с боковой линией, но полностью изолирован от внешней среды. Функция внутреннего уха — информация в мозг для сохранения равновесия. Лабиринт может также выступать как детектор шума, хотя значение звука для колюшковых неизвестно. По моим, наблюдениям в аквариумных и полевых условиях, трехиглая и девятииглая колюшки никак не реагируют на резкий и сильный звук, но моментально спасаются бегством при малейшем резком движении любого предмета, расположенного на берегу поблизости от воды. В лабиринте имеются 3 отолита (небольших известковых тела), самый крупный из них — сагитта используется для определения возраста колюшковых (см. раздел 2.2). В коже колюшек имеются свободные окончания рецепторных волокон, принимающих тактильные и температурные сигналы (Whitear, 1971а).
2. ОБРАЗ ЖИЗНИ
2.1. СОЗРЕВАНИЕ И РАЗВИТИЕ
Размножение колюшковых рыб — процесс сравнительно хорошо изученный, особенно у трехиглой колюшки. Как и у других рыб, размножение колюшковых складывается из трех процессов: 1) образования половых клеток, 2) процессов, приводящих к оплодотворению (называемых у рыб нерестом), и 3) формирования и развития нового организма. Наибольшее внимание физиологов, экологов и этологов привлекает процесс нереста у колюшковых, поскольку у этих рыб обнаружена исключительно интересная картина репродуктивного поведения, гнездостроения и заботы о потомстве. Поэтому описание и обсуждение особенностей нереста колюшковых выделены в самостоятельный раздел (2.8). Здесь же будут обсуждены процессы созревания половых продуктов колюшковых и эмбриональное развитие, описанные в основном на трехиглой колюшке.
2.1.1. СОЗРЕВАНИЕ САМОК
Строение и развитие яичника. У трехиглой колюшки длиной менее 9—10 мм гонады еще невозможно дифференцировать на мужские и женские. Зачатковые клетки заключены в парные генитальные гребни, расположенные вентральнее пронефроса (головной части почки), и хорошо отличимы от окружающих их тканей. Эти генитальные гребни принимают форму дефинитивных яичников по достижении самкой длины свыше 10 мм. С ростом рыбы овидукты от каждого яичника сливаются в общий овидукт, открывающийся в клоаку (Swarup, 1958а). Стенка яичника трехслойная. Наружный слой эпителиальный, в середине — толстый слой соединительной ткани и самый внутренний слой — собственно зародышевый эпителий, из которого формируется яичник. Полость яичника постепенно переходит в овидукт. В дальнейшем стенки яичника впячиваются в его полость, формируя поперечные пластины, и в этих пластинах развиваются ооциты (Stanworth, 1953).
Овогенез. Зародышевые клетки, оогонии, делятся митотическим делением, продуцируя ооциты. В ооците можно видеть ядро и множество ядрышек. Каждый ооцит окружен несколькими слоями клеток: текой (дериватом соединительной ткани), фолликулярным эпителием (дериватом зародышевого эпителия) и вителлиновой мембраной (= хорионом). Созревающий ооцит начинает наполняться желтком (процесс, называемый вителлогенезом). На периферии цитоплазмы появляются вакуоли, содержащие желток, которые в конечном счете заполняют всю цитоплазму ооцита. Последующие мейотические деления приводят к гаплоидизации хромосомного набора, это событие происходит непосредственно перед нерестом (Tromp-Blom, 1959).
Колюшковые рыбы — порционно-нерестующие, и поэтому ооциты созревают с разной скоростью. Например, сразу же после первого нереста зрелая икра отсутствует в яичнике, но там остаются ооциты на разных стадиях развития (Stanworth, 1953).
В нерестовый период масса яичника Gasterosteus aculeatus может составлять до 30 % от общей массы тела, тогда как в зимний период она равна 4 % (Meakins, 1974).
Факторы контроля созревания. Колюшковые рыбы обитают в средних и северных широтах и подвергаются резкому влиянию сезонных изменений, поэтому размножение колюшковых должно быть приспособлено к ним. Это приспособление выражается в том, что созревание и вымет половых продуктов приурочены к одному сезону (весенне-летнему), в течение которого колюшки совершают несколько нерестов.
Соответственно этому на созревание половых продуктов влияют 3 главных фактора: температура, продолжительность светового дня и обеспеченность пищей. На основании многочисленной серии экспериментов Баггерман (Baggerman, 1957) показала, что самыми благоприятными условиями для созревания самок трехиглой колюшки из Нидерландов являются температура 20° С и световой режим 16 ч света и 8 ч темноты в сутки (16 С + 8 Т). Самки, пойманные в природе в осенне-зимний период (с ноября по апрель), все созрели в аквариумах при этом режиме. Время созревания «ноябрьских» самок составило 31 сут, а «апрельских» — всего 2 сут. Интересно, что световой режим играет более важную роль в созревании, чем температурный: длинный световой день индуцировал созревание рыб даже при температуре 5° С (Baggerman, 1957), напротив, короткий день (8 С + 16 Т) при высокой температуре (20 °С) слабо индуцировал созревание.
Интенсивность света, по мнению Баггерман (Baggerman, 1957, 1969), также имеет значение: самая благоприятная интенсивность 300 лк, и дальнейшее увеличение интенсивности света не ускоряет созревания, однако Мак-Инерней и Эванс (Mclnerney, Evans, 1970) на канадских колюшках показали, что свет интенсивностью 5 лк индуцирует нормальное созревание гонад, причем независимо от длины волны света (рыбы в эксперименте освещались зеленым, голубым, пурпурным и красным светом и обнаружили сходные скорости созревания гонад).
Описанные выше эксперименты, на мой взгляд, хорошо отражают широкую норму реакции Gasterosteus aculeatus по способности к созреванию в различных световых и температурных условиях. Ведь таксон Gasterosteus aculeatus имеет огромный ареал в широтном отношении от южной Европы, южной Калифорнии и южной Кореи до Аляски, Гренландии, Новой Земли и Чукотки, т. е. районов высокоарктических. В водоемах высокоарктических районов сезон, свободный ото льда, включает буквально несколько недель, и температуры воды даже летом сравнительно низкие, однако световой день очень длинный. Поэтому колюшки в описанных экспериментах созревали даже при низкой температуре при условии длинного светового дня. То же самое можно сказать и об интенсивности света: поскольку колюшки обитают в водоемах с разной окраской и прозрачностью воды (в чистых олиготрофных озерах и в болотистых водоемах с темной непрозрачной водой), то для созревания им достаточно интенсивности света в 5 лк независимо от его окрашенности.
Возвращаясь снова к вышеописанным экспериментам по влиянию света на созревание колюшек, отметим, что наблюдалось 2 исключения из правил положительного влияния длины светового дня на созревание (Baggerman, 1957). Ювенильные колюшки менее 22 мм длиной и посленерестовые рыбы в течение 1.5 мес после нереста не реагировали созреванием на высокие температуры и длинный световой день. Баггерман (Baggerman, 1972) полагает, что в обоих случаях яичники находились на стадии начального периода деления оогониев и формирования ооцитов, отсюда отсутствие эффекта температуры и света на созревание рыб. В целом же при благоприятных световых и температурных условиях, при хорошей обеспеченности пищей в аквариуме колюшки могут созревать за 4 мес (Baggerman, 1972).
Как и у других рыб, длина светового дня и повышенные температуры стимулируют созревание колюшковых рыб посредством гормональной системы. Xoap (Hoar, 1962b) стимулировал созревание колюшек, содержавшихся в неблагоприятных для созревания условиях (8 С + 16 Т), путем инъекций гормонов из группы гонадотропинов (лютеинизирующим гормоном — ЛГ). Инъекция сырого экстракта гипофиза лосося также стимулировала созревание гонад. Следовательно, длинный световой день стимулирует продуцирование гипофизом гонадотропина, а тот в свою очередь стимулирует развитие гонад. Исследования на других видах рыб показывают, что гонадотропин не действует на ранние стадии развития икры, а действует только тогда, когда в ооците происходит формирование желтка (вителлогенез), поэтому, видимо, гонадотропин стимулирует завершение созревания яичника (Hoar, 1926b).
Обеспеченность пищей — важный фактор созревания гонад. Вуттон (Wootton, 1973а, 1973b) экспериментально показал, что низкий уровень обеспеченности пищей задерживал созревание гонад, а созревшие самки были меньшего размера, чем самки, хорошо снабжавшиеся пищей. Самки, которых не кормили после первого нереста, продуцировали еще лишь одну кладку икры.
Плодовитость. Колюшки порционно-нерестующие рыбы, поэтому их плодовитость складывается из 2 компонент: одноразовой плодовитости и числа нерестов. Оба эти показателя положительно коррелируют с размером самки — крупные самки продуцируют больше икры за 1 нерест и нерестятся большее число раз за сезон, чем мелкие, при одинаковой обеспеченности пищей (Wootton, 1973а, 1973b). Вуттон (Wootton, 1976), много занимавшийся плодовитостью трехиглой колюшки, приводит такие цифры: одноразовая плодовитость мелких рыб, имеющих минимальную массу половозрелой стадии (0,4 г), составляет 20—30 икринок, а крупные самки, весящие 3 г и более, продуцируют за 1 нерест 300—400 икринок. Плодовитость Gasterosteus aculeatus Белого моря Мухомедияров (1966) оценивает от 300 икринок у мелких рыб (длиной в 62—72 мм) до 530 у крупных (длиной 83—86 мм); общий предел изменчивости плодовитости 477—923 (в среднем в порции 324) икринок. При этом Мухомедияров учитывал и крупную икру (созревшую), и икру незрелых порций. Смирнов (1951) оценивает максимальную плодовитость Gasterosteus aculeatus Черного моря в 1400 икринок (учитывая все порции — всего 6), размах колебаний плодовитости 782—1381 икринка. Диаметр икринок в яичниках колебался от 0.2 до 1.95 мм. Баггерман (Baggerman, 1957) показала, что у самок трехиглой колюшки, выдерживавшихся в аквариумах при температуре 20 °С и световом режиме 16 С + 8 Т, продолжительность нереста составляла 60 дней; в среднем они продуцировали за это время 15 кладок икры. При температуре 20 °С и световом режиме 8 С + 16 Т сезон размножения составлял лишь 6.5 дней, при 2 отложенных кладках икры за это время. По данным Вуттона (Wootton, 1976), самка трехиглой колюшки массой в 1 г при хорошей обеспеченности может нереститься в сезон до 20 раз.
Вуттон (Wootton, 1973а) не нашел связи между уровнем обеспеченности пищей и размером икринок, а также между размером самки и диаметром икринок, откладываемых самкой. Однако Потапова и соавт. (1968) обнаружили у трехиглой колюшки дифференциацию самок на быстро- и медленнорастущих. В нерестовый сезон быстрорастущие самки весили больше и продуцировали больше икры, но икринки их имели меньшую массу и меньшее содержание липидов и белков, чем икринки медленнорастущих рыб.
Сведения о созревании и плодовитости других видов колюшковых более скудны. Известно, например, что плодовитость Gasterosteus wheatlandi в одной из природных популяций составляла 171—272 икринок, а диаметр икринок равнялся 1.2—1.5 мм, что в общем вписывается в пределы колебаний соответствующих показателей для Gasterosteus aculeatus (Scott, Crossman, 1964).
Структура яичников Pungitius pungitius сходна с таковой Gasterosteus aculeatus, и развитие ооцитов Pungitius pungitius идет по той же схеме, что и у Gasterosteus aculeatus. Существенное отличие от terosteus наблюдается у Pungitius при овуляции икры в полость яичника: овулирующая икра окружается слизью, секретируемой кубическими эпителиальными клетками, которые выстилают полость яичника. Эта студнеобразная слизь коагулируется в воде и способствует прикреплению икры к гнезду (Yamamoto, 1963). Эта особенность имеет адаптивное значение, так как гнездо у Pungitius строится над грунтом на растениях и есть опасность выпадения икры на грунт и ее последующей гибели. Для икры Gasterosteus, гнездящихся на грунте, такой опасности нет.
Самки Pungitius откладывают несколько кладок икры в нерестовый сезон. Наименьший интервал между последующими актами откладывания икры 6 ч, наибольший 48 ч (у Pungitius pungitius из Великих озер США — Griswold, Smith, 1973). В среднем интервалы между актами откладывания икры у Pungitius короче, чем у Gasterosteus aculeatus, но одноразовая плодовитость у Pungitius меньше: самки из оз. Верхнего (США) длиной 58—81 мм продуцировали 61 —112 икринок на 1 нерест (Griswold, Smith, 1973). Pungitius pungitius из устья р. Св. Лаврентия (Канада) имели одноразовую плодовитость 37—176 икринок (Fitzgerald, 1983). Диаметр икры равняется 1.4—1.8 мм (Nelson, 1968а). По нашим данным, одноразовая плодовитость самок Pungitius pungitius из р. Сходня (Московская обл.) в среднем составляет 140—160 икринок, плодовитость Pungitius platygaster из Сухого Лимана (г. Одесса) 80—90 икринок (Зюганов, 19846).
Самки Culaea inconstans имеют репродуктивный цикл, сходный с таковым Gasterosteus aculeatus. После нереста яичники содержат маленькие ооциты; нерест у Culaea ингибируется температурой свыше 19° С (Lamsa, 1963), у самок резорбируется зрелая икра в ястыках. Формирование желтка в ооцитах начинается в сентябре, но вскоре наступает прекращение созревания до весны. При весеннем увеличении светового дня ооциты наполняются желтком, и в апреле—мае икра готова к откладке. Масса яичника зрелой самки составляет 10—20 % от массы тела (Braekvelt, McMillan, 1967). За нерестовый период самка продуцирует до 250 икринок (Winn, 1960). Диаметр икринки Gulaea 1.0—1.3 мм (Nelson, 1968а).
У самок Apeltes quadracus зимой нет зрелых ооцитов, они созревают ранним летом при увеличении длины светового дня (Merriman, Schedl, 1941). Самки имеют одноразовую плодовитость 15—20 икринок, интервалы между нерестами составляют 3—4 дня, нерестуют в сезон несколько раз (Hall, 1956, — цит. по: Wootton, 1976).
О репродуктивной биологии Spinachia spinachia известно мало. Диаметр икры Spinachia spinachia 2 мм (самая крупная икра); в гнезде самца находили до 2—3 сотен икринок (от нескольких самок) (Sevenster, 1951).
Подводя итоги рассмотрения данных, изложенных в этом разделе, можно сказать, что, несмотря на малые размеры, самки колюшек продуцируют относительно большое количество икры вследствие порционности ее созревания.
2.1.2. СОЗРЕВАНИЕ САМЦОВ
Морфология семенников. Парные семенники расположены в вентральной области брюшной полости. У зрелого самца трехиглой колюшки длина кобласовидного семенника в среднем 1.5 мм и диаметр 0.8—0.9 мм, масса семенников составляет около 1 % от массы тела. Снаружи семенники обильно пигментированы. Они снабжаются кровью генитальной артерии, дорсальйо входящей в семенник. Парные семявыводящие протоки vas deferens сливаются в общий проток, открывающийся в клоаку между анальным отверстием и выходом мочеточника (Craig-Bennett, 1931).
Кроме продуцирования спермы семенник производит стероидные гормоны андрогены, влияющие на вторичнополовые признаки самца.
В каждом семеннике участок, продуцирующий сперму, содержит 150—200 трубочек, расположенных радиально. Они сливаются в дорсальный каналец, который переходит в vas deferens. Стенки трубочек содержат слой эпителиальных клеток и слой соединительной ткани. Сперматогонии расположены в трубочках, а интерстициальные клетки, продуцирующие андрогены, расположены между трубочками (Courrier, 1922; Stanworth, 1953).
У мальков дифференциация генитальных (зародышевых) гребней начинается по достижении рыбы 14 мм длины, и при длине 25 мм семенники становятся полностью дифференцированными и содержат сперматоциты и сперматиды (Swarup, 1958а). Однако самец становится полностью половозрелым по достижении длины 40 мм (Wootton, 1976).
Созревание сперматозоидов у колюшковых происходит так же, как и у других костистых рыб: сперматогонии — сперматоциты I порядка — сперматоциты II порядка — сперматиды — сперматозоиды. Зрелые сперматозиоды трехиглой колюшки имеют плоскую дисковидную головку, хорошо диффенцированную среднюю часть и типичный жгутиковидный хвост (Swarup, 1958а).
У самцов деление сперматогониев начинается сразу же после предыдущего нереста, и при достаточно высокой температуре воды уже зимой в семенниках присутствуют зрелые спермии (Craig-Bennett, 1931). Условия высокой температуры воды и короткого светового дня ингибируют сперматогенез (Hoar, 1962b). Как и созревание самок, созревание самцов зависит от увеличивающегося светового дня. Только при длинном световом дне интерстициальные клетки начинают секретировать достаточное количество андрогенов, чтобы самец стал полностью половозрелым (Baggerman, 1957). В условиях короткого дня (8 С + 16 Т) инъекция лютеинизирующего гормона млекопитающих (андрогена) стимулировала сперматогенез и развитие вторичнополовых признаков трехиглой колюшки (Hoar, 1926b). Следовательно, удлинение светового дня влияет на нервную систему колюшек, в свою очередь нервная система активирует продуцирование гипофизом гонадотропного гормона, который активирует созревание сперматозоидов и продукцию андрогенов интерстициальными клетками. Андргены же стимулируют развитие вторичнополовых признаков (брачную окраску, продуцирование клея), без которых невозможен нерест самца.
Кроме Gasterosteus aculeatus созревание самцов и сперматогенез подробно были изучены у Culaea inconstans (Ruby, McMillan, 1970, 1975) и Apeltes quadracus (Merriman, Schedl, 1941). Было показано принципиальное сходство в протекании этих процессов у исследованных видов. Как и у Gasterosteus aculeatus, у этих видов колюшковых созревание сперматозоидов индуцируется длинным световым днем и эффект света опосредован секрецией гонадотропина гипофизом и стимулирующим эффектом этого гормона на интерстициальные клетки семенников, секретирующих андрогены.
Вторичнополовые признаки. Созревание сперматозоидов у колюшковых в отличие от многих других групп костистых рыб является необходимым, но отнюдь не достаточным условием для успешного нереста. Для того чтобы нерест начался, необходимо развитие ряда вторичнополовых признаков, а именно, брачной окраски и характерных изменений почек для продуцирования клея, жизненно важного для постройки гнезда.
Описание брачной окраски у разных видов колюшковых было дано в разделе 1.4. К этому остается лишь добавить, что развитие брачной окраски, как и других вторичнополовых признаков, находится под строгим гормональным контролем. Если самец колюшки кастрирован, но содержится в благоприятных световых условиях (16 С + 8 Т), у него не развивается брачная окраска, а почечные трубочки не модифицируются для продукции клея. Кроме того, он не может строить гнезда и не демонстрирует сексуального поведения. Однако инъекция тестостерона (из группы андрогенов) стимулирует развитие всех этих признаков (Hoar, 1962а, 1962b; Baggerman, 1966; Mourier, 1976а).
Почечные канальцы претерпевают характерные изменения в средней и дистальной частях (относительно почечного клубочка — glomerulus), активируются секретирующие слизь клетки. Эти клетки модифицируются таким образом, что увеличиваются в высоту в 2.5 раза, в них происходит увеличение секреторных гранул. Клетки почечного канала-коллектора также модифицируются для продукции слизи. Продукт коллекторного канальца химически отличен от слизевого продукта клеток канальцев; в первом случае вырабатывается мукополисахаридная кислота, а во втором — нейтральная мукосубстанция (Mourier, 1976b). Эта слизь запасается в мочевом пузыре в виде тесно упакованных тонких волокон (Wourms, 1973).
2.1.3. РАЗВИТИЕ ИКРЫ И МОЛОДИ
Кладки икры у колюшковых рыб всех без исключения видов развиваются в гнезде под охраной самца. Кроме того, самец вентилирует икру в гнезде и убирает неоплодотворенные и погибшие икринки, а после выклева молодь в течение нескольких дней также находится под защитой самца. В силу этого выживаемость икры у колюшковых рыб колеблется между 90 и 100 %, что намного превышает аналогичный показатель у ряда других групп костистых рыб, не имеющих заботы о потомстве.
Икра трехиглой колюшки окрашена в желтый цвет за счет каротиноидного пигмента, который принимает участие в окислительных процессах, связанных с дыханием зародыша.
Каждая икринка покрыта оболочкой, называемой вителлиновой мембраной, или хорионом. В этой мембране есть поры, называемые микропиле. При оплодотворении спермий проникает в икру через микропиле. После оплодотворения в течение 1 ч икра колюшки обнаруживает обычную для костистых рыб кортикальную реакцию (образование перивителлинового пространства), блокирующую проникновение в икру других спермиев.
Ниже приводится описание стадий эмбрионального и личиночного развития трехиглой колюшки при температуре воды 17—18 °С (Swarup, 1985b; Петина, 1973) (рис. 11).
I. Образование перивителлинового пространства. При образовании перивителлинового пространства в результате оводнения яйца и растяжения яйцевой оболочки диаметр икринок увеличивается с 1.6 до 1.8 мм. Цитоплазма концентрируется на анимальном полюсе, образуя плазменный бугорок. Этот процесс продолжается около 75 мин и заканчивается формированием бластодермального диска.
II. Дробление бластодиска (бластуляция). Через 1.6—2 ч после оплодотворения бластодермальный диск начинает делиться и образует сначала 2 бластомера, затем 4, 8 и в возрасте 3—3.5 ч 16 бластомеров. Желток не затрагивается этим делением. В возрасте 6 ч происходит образование крупноклеточной морулы, 7.5 ч — среднеклеточной и 14 ч — мелкоклеточной морулы. В возрасте 17 ч зародыш находится на стадии бластулы, бластодерма куполообразно выступает над поверхностью желтка. В процессе интенсивного деления клеток между бластодермой и желтком формируется синцитиальный слой (перибласт), ядра которого принимают участие в питании клеток развивающегося зародыша. В возрасте 21 ч бластодерма отделена от перибласта узкой щелью (бластоцелем, или субгерминально-подзародышевым пространством). Клетки краевой зоны бластодиска начинают наползать на желток и подворачиваться (инвагинировать).
III. Гаструляция. В самом начале гаструляции заметны волнообразные движения поверхности яйца, обусловленные периодическим сокращением перибласта. Это приводит к вращению яйца внутри оболочки и постоянному перемешиванию перивителлиновой жидкости, особенно интенсивному на анимальном полюсе яйца, что улучшает газообмен развивающегося зародыша. В возрасте 34 ч гаструляция продолжается: бластодерма продолжает обрастать желточный мешок. На одном из участков краевой зоны нарастания образуется бугорок, клетки которого интенсивно делятся, и бластодерма подворачивается внутрь. В этом месте образуется зачаток тела зародыша, который постепенно расслаивается на зародышевые пласты — экто-, эндо- и мезодерму. Тело зародыша удлиняется и утолщается.
IV. Органогенез. В возрасте 48 ч края бластодермы, обрастающей желток, смыкаются. В головном отделе зародыша образуются два выпячивания — глазные пузыри, производные промежуточного мозга. Становятся различимыми передний, средний и задний отделы головного мозга. В хвостовом отделе виден Купферов пузырек, а в средней части зародыша закладываются первые три сегмента тела зародыша (сомита).
В возрасте 56—63 ч в глазных пузырях появляются щелевидные углубления, они начинают прогибаться внутрь, образуя глазные бокалы. Виден зачаток хорды. В возрасте 72 ч происходит образование слуховых капсул, продолжается дифференциация на 5 отделов зачатка мозга, появляются обонятельные ямки, в глазах образуются хрусталики. У зародыша имеется уже 10—20 сомитов.
V. Функционирование кровообращения. В возрасте 80—90 ч появляется зачаток сердца. Обонятельные ямки начинают преобразовываться в обонятельные капсулы. Сердце начинает пульсировать. Тело зародыша начинает пигментироваться. Продолжается дифференциация головного мозга. Происходит образование сосудов кровеносной системы зародыша. Появляются подкишечно-желточная вена (vena subintestinalis vitellina), спинная аорта (aorta dorsalis). Появляются зачатки грудных плавников.
VI. Подвижное состояние зародыша. В возрасте 100—112 ч продолжается формирование кровеносной системы, появляется пигмент в форменных элементах крови. В слуховых капсулах закладываются отолиты. Хвост начинает отделяться от желточного мешка, и тело приобретает подвижность, начинаются биения хвоста. На желточном мешке образуется разветвленная кровеносная сеть. Продолжается дифференциация головного мозга. Глаза сильно пигментированы. Желудочки мозга начинают покрываться крышей.
В возрасте 130 ч сердце хорошо дифференцировано на желудочки, предсерие и sinus venosus. Появляются жаберные щели. В возрасте 160 ч передний желудочек мозга закрывается, и головной отдел эмбриона полностью сформирован. Видны все отделы головного мозга: передний — tel-, промежуточный — dien-, средний — mesencephalon, мозжечок — cerebrellum, продолговатый мозг — medulla oblongata. Перикардиум и сердце продолжают увеличиваться в размере. В возрасте 182 ч кровеносная система на желточном мешке развита очень мощно. В венозный синус (sinus venosus) сердца с левой стороны зародыша впадает желточный Кювьеров проток (ductus Cuvieri vitellina). С левой стороны по желточному мешку проходит крупный непарный сосуд — подкишечно-желточная вена (vena subintestinalis vitellina), которая впадает в левый желточный Кювьеров проток. Из сердца кровь по парным мандибулярным дугам аорты (arcus mandibularis aortae) течет в голову и спинную аорту (aorta dorsalis). Спинная аорта переходит в хвостовую артерию (arteria caudalis), которая загибается в хвосте в виде восьмерки и несет кровь в хвостовую вену (vena caudalis). Хвостовая вена переходит в подкишечную вену (vena subintestinalis), которая выходит на желточный мешок и образует сеть мелких желточных сосудов и один крупный — подкишечно-желточную вену. Из головного отдела кровь течет по передним кардинальным венам (vena cardinalis anterior) и впадает в Кювьеровы протоки.
Сосудистая сеть на желточном мешке является одним из эмбриональных органов дыхания, и сильное ее развитие является дополнительным приспособлением к не совсем благоприятным кислородным условиям внутри кладки икры, лежащей в гнезде (несмотря на усиленную вентиляцию самцом гнезда). Биение хвоста эмбриона способствует перемешиванию перивителлиновой жидкости и улучшению газообмена.
VII. Вылупление. При температуре 18—19 °С вылупление эмбриона происходит на 7—8-е сутки после оплодотворения. Биения хвостового и вибрирование грудных плавников приводят к тому, что эмбрион толкается головой в яйцевую оболочку. На голове эмбриона развиваются железы вылупления. Их лизирующий секрет ослабляет прочность яйцевой оболочки. Эта оболочка после резких движений хвоста прорывается. Сначала освобождается хвостовой отдел, затем голова зародыша.
Вылупившиеся предличинки имеют длину 4—6 мм. На теле имеются 14—17 туловищных и 12—14 хвостовых сегментов. На желточном мешке сильно развита кровеносная система, длина желточного мешка составляет 1/3 длины тела. Подкишечная вена (vena subintestinalis) теперь несет кровь в печень, а не в желточный мешок. Связь хвостовой вены с подкишечной прерывается, и она (vena caudalis) теперь продолжается непосредственно в заднюю кардинальную вену (vena cardinalis posterior), которая, сливаясь, с передними кардинальными венами (vena cardinalis anterior), впадает в Кювьеровы протоки. В жаберном отделе заметны сосуды, несущие кровь к жабрам, в грудных плавниках проходит парная подключичная артерия (arteria subclavia). Рот неподвижен и закрыт (Vrat, 1949; Петина, 1973). Тело окаймлено непарной плавниковой складкой. Кишечник залегает над желтком, около анального отверстия закладывается мочевой пузырь. Печень также расположена над желтком. Глаза открыты. В желтке сохраняются две крупные жировые капли, выполняющие гидростатическую функцию.
Только что вылупившиеся предличинки активно плавают благодаря быстрым движениям хвостового плавника и вибрации грудных плавников. После каждого периода плавания предличинка ложится на дно на бок, но и в это время грудные плавники продолжают двигаться.
VIII. Формирование челюстного аппарата. В возрасте 190—240 ч у свободных эмбрионов наблюдается резорбция желтка. Начинается формирование челюстного аппарата. Меланофоры густо покрывают поверхность тела. Грудной (плечевой) пояс дифференцирован на scapula и coracoid. В течение 4 сут после выклева желток исчезает. Челюстной аппарат развивается, и рот может открываться и закрываться.
IX. Смешанное питание. В возрасте 5—6 сут после вылупления предличинка начинает переходить на активное питание, становясь личинкой. Над кишечником выпячивается плавательный пузырь, и для наполнения пузыря воздухом личинка плывет к поверхности и заглатывает воздух. В это же время формируется жаберная крышка. У личинки еще имеется небольшой остаток желтка, по-прежнему имеется общая плавниковая складка. В хвостовом отделе плавниковой складки формируются мезенхимные зачатки плавниковых лучей. Личинки активно плавают.
В последующие 8 дней личинки теряют личиночные признаки и принимают взрослую форму при длине 11 мм. Плавниковая складка дифференцируется на спинной, хвостовой и анальный плавники. После появления лучей в хвостовом плавнике лучи появляются в спинном и анальном плавниках. Первой проявляется брюшная колючка, затем анальная и 3-я спинная, затем 1-я и 2-я спинные колючки (Swarup, 1958b).
После резорбции желтка молодь начинает есть инфузорий, личинок копепод и другую планктонную пищу, имеющую достаточно малые размеры (см. раздел 2.3).
Сроки вылупления и темпы развития трехиглой колюшки зависят от температуры воды: при 8 °С вылупление происходит на 40-й день, а при 25 °С на 6-й (Heuts, 1956). Если развивающуюся икру Gasterosteus aculeatus подвергать температурному шоку высокими (33 °С) и низкими (0 °С) температурами, то наблюдаются ненормальное развитие эмбрионов (уродства) и триплоидизация: у колюшек вместо нормы 2п = 42 хромосомы образуются 63 хромосомы (Swarup, 1959).
В эксперименте молодь трехиглой колюшки достигала длины 17 мм за 1 мес после вылупления. При температуре воды 20 °С и хорошей обеспеченности пищей колюшку можно довести до состояния половозрелости за 4 месяца при длине 45 мм и массе 1 г (Van Mullem, 1967). В природных же популяциях трехиглая колюшка достигает половозрелости как минимум за 1 год (см. раздел 2.2).
Эмбриональное развитие девятииглой колюшки Pungitius pungitius идет по той же схеме, что и у трехиглой колюшки, и в целом развитие обоих видов сходно. Различия между ними незначительны: диаметр икринок Pungitius pungitius (1.3—1.5 мм) меньше, чем у трехиглой (1.6—1.8), желточный мешок у Pungitius pungitius менее интенсивно окрашен. У предличинок Pungitius pungitius туловищных сегментов меньше (14), чем у Gasterosteus aculeatus (16), а хвостовых миотомов больше (16—18), чем у Gasterosteus aculeatus (14). Пигментация предличинок у Pungitius pungitius сильнее, чем у Gasterosteus aculeatus (Василевская, 1971). В отличие от Gasterosteus aculeatus эмбриональное развитие Pungitius pungitius идет несколько более быстрыми темпами: при температуре 13—17 °С выклев наступает на 7-е сутки (Василевская, 1971). При 18—19 °С выклев наблюдался на 4—5-е сутки (Morris, 1958).
У Culaea inconstans в зависимости от температуры выклев происходит на 5—9-е сутки (Wootton, 1976), молодь Apeltes quadracus выводится за 8 дней при 18 °С (Rowland, 1974). Эмбриональное развитие Spinachia spinachia в принципе сходно с Gasterocteus aculeatus, и вылупление происходит за 18—25 дней при 10° С и за 40 дней при 5° С (Prince, 1885). Интересно, что вскоре после выклева. предличинки Spinachia длиной 6 мм имеют округлой формы голову и тупое рыло и не похожи по форме головы и тела на взрослых особей, имеющих необычайно удлиненное тело и трубковидное рыло. Однако уже через 2—3 мес длина мальков равняется 5—6 см, и они имеют форму головы и тела, характерную для взрослых (Prince, 1885).
Таким образом, эмбриональное развитие колюшковых сходно у всех видов и завершается быстро — в пределах 5—10 сут, за исключением Spinachia, у которой этот срок несколько длиннее.
В заключение этого раздела рассмотрим онтогенез важного образования, являющегося таксономическим признаком колюшковых — боковых костных пластин. Развитие пластин исследовано у нескольких видов: Gasterosteus aculeatus (Igarashi, 1964, 1970), Pungitius pungitius, Pungitius sinensis, Pungitius sp. (Igarashi, 1962, 1963, 1968).
У всех исследованных видов развитие пластин начинается, когда рыбы достигают длины тела 15 мм, и заканчивается при длине 35—40 мм. Однако если у Pungitius sinensis закладка пластин начинается с хвостового стебля и продолжается по направлению к голове, то у Gasterosteus aculeatus формирование полного ряда пластин происходит иначе. Начинается одновременная закладка 4 пластин в передней части тела. От этих образований закладка продолжается и к передней, и к задней части (по направлению к хвосту). На хвостовом стебле независимо появляется другой центр закладки (при длине рыбы в 20 мм). Затем ряд пластин нарастает по направлению к переднему отделу тела, и при длине рыб 40 мм пластины на теле и киле соединяются (рис. 12). Существование двух центров формирования пластин, по мнению Игараши (Igarashi, 1964), — уникальный случай среди костистых рыб. Таким образом, морфа trachurus у трехиглой колюшки в индивидуальном развитии проходит последовательно стадии hologymna, leiurus и semiarmatus. Морфа trachurus у Pungitius развивается, как видно из предыдущего, иным путем. Эволюционное значение этих межродовых различий будет обсуждено в разделе 4.5.5.
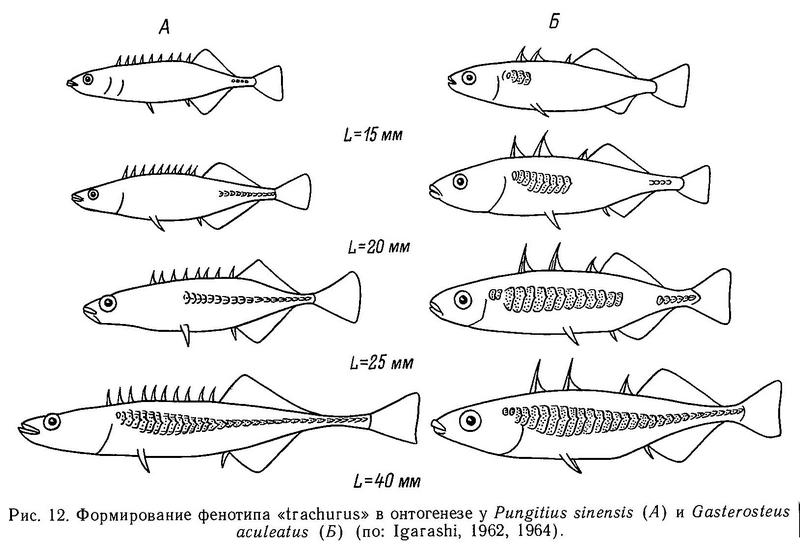
2.2. ВОЗРАСТ И ТЕМП РОСТА
Все виды колюшковых имеют небольшие размеры и являются короткоцикловыми рыбами. Поэтому трудно ожидать у колюшковых сложной возрастной структуры. Действительно, исследование возраста и роста колюшковых в природных популяциях и экспериментальных условиях (аквариумы) согласуется с этой парадигмой. Лучше других возраст и рост исследован у трехиглой колюшки (Jones, Hynes, 1950).
Возраст у колюшковых, как и у ряда других рыб, можно определить 2 способами: 1) с помощью Петерсеновских кривых (распределение длины рыб), 2) с помощью регистрирующих структур (отолитов).
Первый способ основан на том, что сезон размножения у колюшек бывает лишь 1 раз в год, и он относительно короток (1—2, от силы 3 мес). Следовательно, пополнение популяции происходит 1 раз в год, и каждая «волна» пополнения отделена от другой промежутком в 1 год. Поэтому каждый годовой класс дает пик на кривой распределения длины рыб, и количество пиков на кривой соответствует числу годовых классов.
Этот метод относительно прост и не связан со вскрытием рыб. Однако он недостаточно надежен, во-первых, по причине изменчивости темпа роста внутри одного годового класса и, во-вторых, из-за растянутости нереста колюшек в некоторых популяциях (Van Mullem, 1967). В обоих случаях возникает расплывчатая полимодальная кривая Петерсена при анализе распределения длины в таких популяциях. Противоречивые выводы разных авторов, использовавших этот метод анализа возрастной структуры, — наглядное тому подтверждение.
Так, Бертэн (Bertin, 1925) полагал, что пресноводная форма leiurus вида Gasterosteus aculeatus из Франции и Нидерландов живет только 1 год и погибает сразу же после нереста. К такому же выводу пришел Манн (Mann, 1971), исследовавший колюшек южной Англии (leiurus), и Хойтс (Heuts, 1947а), исследовавший колюшек leiurus Бельгии.. Напротив, Крейг-Беннетт (Craig-Bennett, 1931) заключил, что колюшки leiurus, обитающие близ Кембриджа (Англия), начинают нереститься в возрасте 2 лет и живут более 3 лет. Вундер (Wunder, 1930) заключил, что морская форма trachurus в Северном и Балтийском морях созревает лишь в возрасте 2 лет. Однако Лейнер (Leiner, 1931а) нашел, что в аквариуме морские колюшки trachurus размножаются в годовалом возрасте и могут жить 3 года. Вместе с тем Ван Муллем и Ван дер Флюгт (Van Mullem, Van der Vlugt, 1964) нашли, что морская форма trachurus на побережье Нидерландов живет 1 год и в большинстве случаев погибает после нереста.
Кроме недостаточной надежности методики противоречивость этих данных может быть объяснена географической изменчивостью возрастной структуры, обусловленной, возможно, широкой нормой реакции по продолжительности жизни и времени вступления в половозрелую фазу (возраста первого нереста) трехиглой колюшки.
Применение второго метода (регистрирующие структуры) и экспериментального подхода (содержание в аквариуме) помогло прояснить эту несколько запутанную ситуацию.
Метод использования регистрирующих структур для определения возраста колюшковых был разработан Джонсом и Хайнсом (Jones, Hynes, 1950). Наиболее крупный из трех отолитов — сагитта — является самым удобным для просмотра годовых слоев. Этот отолит впервые появляется при длине колюшки 6 мм, т. е. через несколько дней после вылупления. Отолит в это время либо весь прозрачный, либо более или менее мутный. В конце июня центр отолита почти полностью сформирован. Гиалиновые (прозрачные) зоны откладываются на отолите в июне—июле, а опаковые зоны (непрозрачные) — в остальные месяцы. Джонс и Хайнс (Jones, Hynes, 1950) предложили следующую классификацию отолитов: S—, опаковое ядро без гиалинового кольца по краю (соответствует месячной рыбе после нереста): S, опаковое ядро с одним гиалиновым кольцом по краю (рыбы между июлем и сентябрем, сеголетки); S+, опаковое ядро, затем гиалиновое кольцо и опаковое кольцо по краю (годовик, еще не доживший до следующего июня); 2S, опаковое ядро с одним опаковым и двумя гиалиновыми кольцами, одно из них по краю (двухлетки, прожившие 1 год плюс лето и встречающиеся только с июля по сентябрь); 2S+, опаковое ядро, два гиалиновых и два опаковых кольца, одно из них по краю (двухгодовики); 3S, три гиалиновых кольца, одно из них по краю (трехлетки); 3S+ (трехгодовики) и 4S (четырехлетки). Таким образом, рыбы, имеющие отолиты 2S, 3S и 4S (с гиалиновыми кольцами по краю), ловятся в водоеме обычно между июлем и сентябрем и называются летками, а рыбы (с опаковыми зонами по краю отолита) S+, 2S+, 3S+, 4S+ ловятся в остальные месяцы и летом бывают очень редки и называются годовиками, двух-, трех-, четырехгодовиками (Jones Hynes, 1950).
Джонс и Хайнс изучили возрастную структуру морфы leiurus Gasterosteus aculeatus из реки Биркет (Северо-Западная Англия) и морфы trachurus из солоноватого карьера, расположенного поблизости. По их данным, колюшки обоих морф живут максимум 4 года, и большинство начинает нереститься в годовалом возрасте при длине 36 мм. Сходную возрастную структуру и время первого нереста имеют пресноводные колюшки из небольшого пресного пруда «Придди Пул» на юго-западе Англии (Pennyquic, 1971) и оз. Дальнего (Камчатка, СССР) (Тиллер, 1972). Пресноводные колюшки морфы leiurus из озер на о. Кадьяк (Аляска, США) начинают нереститься в годовалом возрасте и живут до 4 лет (Greenbank, Nelson, 1959). Сходную продолжительность жизни обнаруживают пресноводные колюшки морф trachurus и semiarmatus из Восточной Канады (провинция Квебек) (Coad, Power, 1973b).
Колюшки морской формы trachurus, иследованной на побережье Нидерландов (Van Mullem, Van der Vlugt, 1964), нерестятся в годовалом возрасте, и большинство из них после нереста гибнут. Колюшки leiurus, обитающие в ручьях Южной Англии, также гибнут после первого же нереста в годовалом возрасте (Mann, 1971). Вместе с тем балтийские колюшки морф trachurus и semiarmatus живут до 4 лет, но начинают нереститься лишь по достижении двухгодовалого возраста (Апеег, 1973).

По данным Мухомедиярова (1966), морская форма trachurus трехиглой колюшки Кандалакшского залива Белого моря (СССР) живет до 4—5 лет, основу нерестового стада составляют двух- и трехгодовики (85—99 %). По моим данным (Зюганов, 1980), основу нерестового стада составляют трех- и четырехгодовики (80%) (табл. 3). По данным Мухомедиярова (1966), а также по моим данным (Зюганов, 1980), годовики в нерестовом стаде отсутствуют, видимо они не участвуют в нересте. В пресноводных озерах на побережье Кандалакшского залива возрастная структура колюшек морф trachurus и leiurus сходна с возрастной структурой морских колюшек: рыбы живут до 4—5 лет и созревают в двухгодовалом возрасте (табл. 3). Только в оз. Клюквенном (табл. 4), где обитают сразу обе морфы — жилая trachurus и leiurus, наблюдалось некоторое различие между ними по возрастной структуре. У leiurus не было пятигодовиков, а четырехгодовики составляли 2 %, в то время как у trachurus четырехгодовики составляют 12 %, и встречаются также пятигодовики.
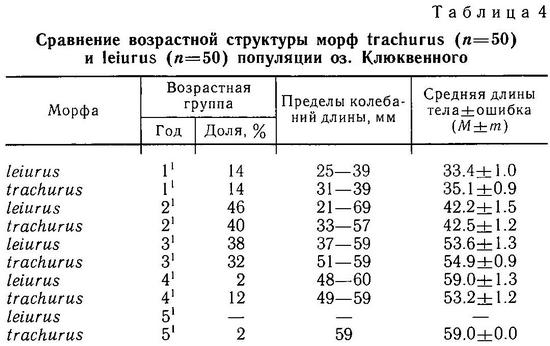
Интересно, что интродукция морских колюшек trachurus из Кандалакшского залива в пресноводные небольшие изолированные водоемы, где не было раньше колюшек (карьеры, затопленные грунтовыми водами), приводила к тому, что потомки 1-го поколения от запущенных основателей начинали нереститься в годовалом возрасте при длине 40—45 мм (Зюганов, 1983 г). Сходные результаты наблюдались при акклиматизации в эти водоемы и пресноводных колюшек leiurus из близлежащих озер (Зюганов, 1983 г). Видимо, вступление годовиков в фазу половозрелости в этих карьерах объясняется хорошей обеспеченностью пищей и небольшой плотностью колюшек в первые годы жизни в этих водоемах, пока популяции там не достигали высокой численности и плотности.
Выше (см. раздел 2.1.3) уже упоминалось, что в аквариумных условиях колюшек удавалось доводить до половозрелости при хорошей обеспеченности пищи за 4 мес (Van Mullem, 1967).
Подводя итоги этой части раздела, можно заключить, что норма реакции по предельному возрасту у морской и пресноводной форм такова, что рыбы могут жить от 1 до 5 лет и первый нерест может иметь место в возрасте 1 или 2 лет. Колюшки не созревают, пока не достигнут в длину 36—40 мм (Craig-Bennett, 1931; Baggerman, 1957; McPhail, 1977). Это хорошо согласуется с концепцией Никольского (1974) о критической длине тела рыбы, при которой происходит ее созревание. Таким образом, возраст первого нереста зависит от темпа роста рыбы. Если эта критическая длина не достигается рыбой на следующее лето после рождения, то она начнет нереститься только через год.
Однако неясно, почему в некоторых популяциях наблюдается гибель всех или почти всех особей после нереста (Van Mullem, Van der Vlugt, 1964; Hagen, 1967; Mann, 1971). В этих популяциях предельный возраст определяется возрастом первого созревания. Возможно, адаптивное значение этой массовой гибели такое же, как и у лососей рода Oncorhynchus: обильное развитие кормовых объектов на трупах родителей обеспечивает лучшее выживание потомству.
Предельный возраст Gasterosteus wheatlandi, судя по размерному ряду и отолитам, 1 год, все рыбы гибнут после нереста (Mclnerney, 1969; Goad, Power, 1973с).
Возрастная структура Pungitius pungitius сходна с таковой Gasterosteus aculeatus. Судя по отолитам, Pungitius pungitius из р. Биркет (Англия) живет 3.5 года и нерестится впервые на следующее лето после рождения (Jones, Hynes, 1950). Pungitius pungitius из оз. Икроавик (Аляска, США) живет 2.5 года (Cameron et al., 1973). Сходная возрастная стуктура наблюдается у Pungitius pungitius из р. Матамек (Восточная Канада) (Coad, Power, 1973d). В оз. Верхнем (Великие Озера, США) были найдены 5-летние самки, но самцы доживают лишь до 3-летнего возраста (Griswold, Smith, 1973). По нашим данным (Зюганов, 19846; Зюганов, Гомелюк, 1985), Pungitius pungitius из р. Сходня (Московская обл.) достигает половозрелости в годовалом возрасте, гибриды Pungitius pungitius х Pungitius platygaster, интродуцированные в карьеры на Беломорском побережье, также нерестились на следующее лето при длине 35—39 мм. Pungitius sinensis созревает на следующий год жизни при длине 40 мм, и большая часть рыб гибнет после нереста (Tanaka, Hoshino, 1979).
Culaea inconstans нерестится через год после своего рождения и живет до 3 лет (Winn, 1960). Apeltes quadracus из Матамек-ривер (Канада) живет до 2—3 лет и нерестится через год после рождения. Сходную возрастную структуру имеют прибрежные популяции из штатов Нью-Бруншвиг и Мэриленд (США) (Schwartz, 1965; Mclnerney, 1969; Coad, Power, 1973a). Джонс и Хайнс (Jones, Hynes, 1950) не обнаружили ежегодных колец на отолитах Spinachia spinachia, они были полностью непрозрачны (опаковые). Эти авторы, а также Лейнер (Leiner, 1934) полагают, что Spinachia spinachia живет только 1 год и после нереста гибнет.
Таким образом, возрастная структура других видов колюшковых полностью укладывается в пределы изменчивости возрастной структуры Gasterosteus aculeatus.
Темпы роста. У колюшковых темп роста лучше изучен на трехиглой колюшке. Темп роста у нее варьирует как внутри, так и между популяциями. В некоторых популяциях в пределах одного возрастного класса самки значительно крупнее самцов (Van Mullem, Van der Vlugt, 1964), так что межпопуляционная изменчивость по соотношению полов может быть причиной межпопуляционной изменчивости по темпу роста. Экстенсивность и интенсивность инвазии паразитами также влияют на рост рыб (влияние паразитизма на рост колюшек будет обсуждено в разделе 2.5). Другим важнейшим фактором, влияющим на рост колюшек, является обеспеченность пищей. Температура, соленость и световые условия в водоеме также влияют на рост рыб.
Например, в р. Биркет (Англия), где нерест в мае, колюшки-сеголетки leiurus достигали в длину в среднем 15 мм (к концу июля), двухлетки 42.7, трехлетки 45.6, четырехлетки 51.4 мм. Самый высокий темп роста — на первом году жизни, а потом он резко замедляется (Jones, Hynes, 1950). Несмотря на хорошую обеспеченность пищей в р. Биркет (обильная фауна планктонных и бентосных беспозвоночных), рост колюшек в этом водоеме самый слабый в сравнении с другими изученными случаями из Англии, Канады и США (Wootton, 1976), а также в сравнении с популяциями бассейна Белого моря (Зюганов, 1980) (рис. 13).
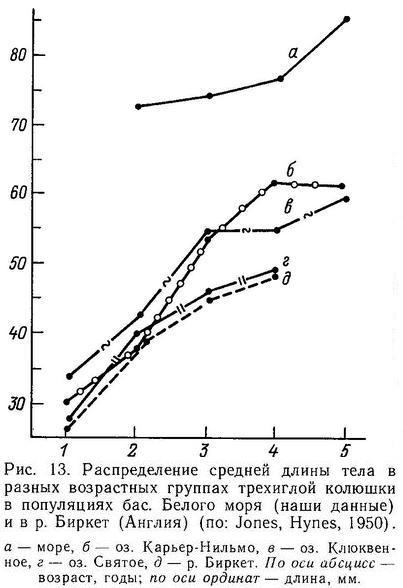
Интересен вопрос о различиях в темпе роста между морфами trachurus и leiurus. Хаген (Hagen, 1967) в р. Литтл Кэмпбелл (Британская Колумбия, Канада), где обитает жилая leiurus и туда же на нерест приходит морская trachurus, нашел, что trachurus растет быстрее, чем leiurus. Это может быть обусловлено двумя причинами: 1) генетическими различиями по темпу роста (в этой реке обе формы генетически изолированы) и 2) лучшей обеспеченностью пищей trachurus в море в нагульный период. В Западной Европе в смешанных популяциях вдоль побережья Северного моря морфы trachurus, semiarmatus и leiurus не различаются в размерах (Heuts, 1947а; Münzing, 1959; Van Mullem, Van der Vlugt, 1964). Популяции leiurus в двух озерах Аляски Бэйр и Карлук (Greenbank, Nelson, 1959) обнаруживают сходный темп роста рыб с особями trachurus и semiarmatus из пресных озер Квебека (Coad, Power, 1973b). В пресном оз. Клюквенное (бассейн Кандалакшского залива Белого моря, о. Великий) обитает триморфная популяция (trachurus + semiarmatus + leiurus). Сравнение размеров trachurus и leiurus в разных годовых классах показало сходство в средних размерах обеих морф по каждому годовому классу при незначительном превосходстве длин trachurus в младших годовых классах (годовики, двух- и трехгодовики) (Зюганов, 1980). Похоже, что превосходство в размерах морских trachurus над пресноводными leiurus обусловливается, скорее, более благоприятными условиями нагула в море, хотя для окончательного ответа на этот вопрос необходимы эксперименты в контролируемых условиях.
Другие виды колюшковых. Gasterosteus wheatlandi (является морской формой, гибнущей после первого нереста) обнаруживает более высокий темп роста, чем морская форма Gasterosteus aculeatus. Gasterosteus wheatlandi достигает к концу первого года длины в среднем 64 мм на побережье о. Нью-Фаундленд (Восточная Канада) и на атлантическом побережье США 76 мм (Scott, Crossman, 1973).
Начальная скорость роста Pungitius pungitius из р. Биркет (Англия) одинакова с симпатричной Gasterosteus aculeatus, но после первого года рост у нее почти прекращается (48 мм у трехгодовика против 46 мм у годовиков) (Jones, Hynes, 1950). Рыбы из североамериканских популяций Pungitius pungitius (оз. Икроавик, Аляска, — Cameron et al., 1973), из оз. Матамек, Канада (Coad, Power, 1973d), оз. Верхнее, Великие Озера, США (Griswold, Smith, 1973) достигают за год также длины 45 мм, но в последующие годы растут быстрее, достигая длины 80 мм. Culaea inconstans имеет темп роста, сравнимый с Pungitius pungitius, и даже несколько меньший, чем у Pungitius pungitius. Достигая максимальной длины в 65 мм (Winn, 1960), Culaea имеет обычно меньшие размеры (40—50 мм) в возрасте 2—3 лет.
Apeltes guadracus имеет сходный с Culaea темп роста (Mclnerney, 1969), достигая максимальной длины 60 мм и максимальной продолжительности жизни 3 года.
Если согласиться с точкой зрения Лейнера (Leiner, 1934) и Джонса и Хайнса (Jones, Hynes, 1950), что Spinachia живет один год, то, учитывая длину Spinachia (в среднем 100—150, а иногда и до 200 мм), приходится заключить, что у этого вида колюшковых самый высокий темп роста.
Подводя итоги этого раздела, можно резюмировать, что медленный рост, простая возрастная структура и малые размеры особей колюшковых рыб позволяют существовать многочисленной популяции рыб при сравнительно ограниченных кормовых ресурсах в водоеме. Вместе с тем малые размеры связаны с повышенным выеданием крупными хищниками и должны быть компенсированы повышением воспроизводительной способности популяции. У колюшковых это достигается ранним созреванием всех без исключения видов и особой репродуктивной тактикой — заботой о потомстве, которая будет рассмотрена в разделе 2.8.
2.3. ПИТАНИЕ
Колюшковые рыбы являются эврифагами, питающимися разнообразными кормами. Кроме того, несмотря на их малые размеры, их можно, скорее, назвать хищными рыбами, чем мирными, поскольку колюшки охотятся за движущимися пищевыми объектами, ориентируясь главным образом с помощью зрения. Вылупившиеся предличинки едят инфузорий, а затем мелких ракообразных по мере роста. Лучше других питание изучено у трехиглой и девятииглой колюшек.
Большинство кратких сообщений о питании Gasterosteus aculeatus, разбросанных в многочисленных работах, дает лишь качественный анализ. Однако есть несколько работ, где даются количественный анализ и сезонная изменчивость питания (Hynes, 1950; Абдель-Малек, 1963, 1968; Walkey, 1967). Спектр питания колюшек морфы leiurus в р. Биркет (табл. 5) очень широк: ракообразные (Cladocera, Copepoda, Ostracoda), членистоногие (личинки Chironomidae, Trichoptera, Coleoptera), моллюски, олигохеты, личинки и икра рыб, диатомовые водоросли. У этих колюшек обнаружены сезонные изменения в питании. Так, Cladocera, Copepoda и личинки Chironomidae составляют значительную долю в летнем рационе. Зимой же большую роль в рационе начинают играть моллюски и высшие растения. Пик питания диатомовыми водорослями приходится на сентябрь. Доля пустых желудков увеличивается в зимнее время, а в начале нереста интенсивность питания увеличивалась. Cladocera, Copepoda и личинки Chironomidae играли самую важную роль в питании колюшек leiurus из озер Северо-Восточной Англии (Walkey, 1967), озер северо-запада Англии (Hynes, 1950) и о. Кадьяк (Аляска, США) (Greenbank, Nelson, 1959).
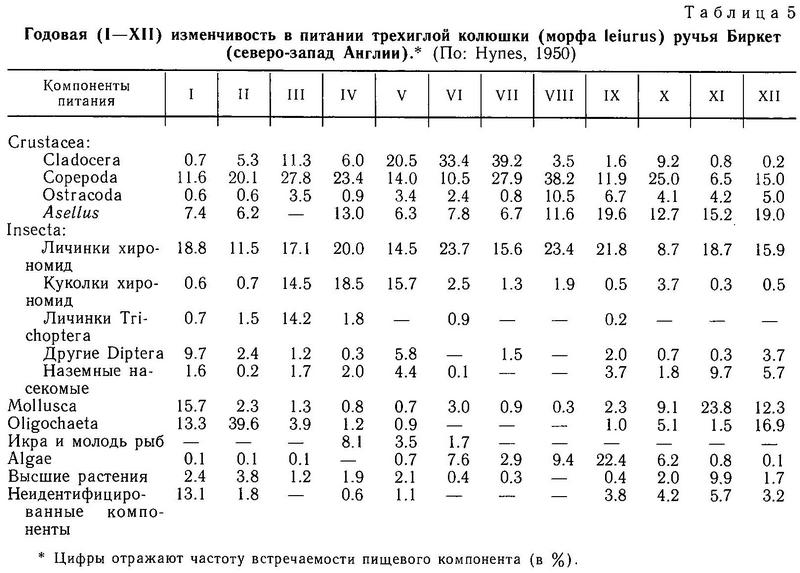
Саундерс (Saunders, 1914) отмечал, что крупные колюшки из прудов близ Кембриджа (Англия) круглый год питались в основном диатомовыми Nitzschia sygmoidea, но более мелкие рыбы питались личинками насекомых и мелкими ракообразными.
Для морских колюшек trachurus на побережье Дании, собранных среди зарослей зостеры, было отмечено питание Gammaridae, Amphipoda, Isopoda (Isotea faera), Amphipoda (Corophium), личинками насекомых и насекомыми, упавшими в воду (Blegwad, 1917). Абдель-Малек (1968) исследовал пищевой спектр морской формы trachurus из Кандалакшского залива Белого моря. Было обнаружено, что предличинки начинали питаться преимущественно Copepoda (nauplii), но по мере роста молодь колюшек переходила на копеподитные стадии копепод, в основном Harpacticus unermis. Уже при длине рыб 15 мм и выше колюшки обладали полным спектром питания, характерным для половозрелых стадий: высшие ракообразные, Copepoda, личинки Chironomidae, Annelida. По моим данным, в пресноводном изолированном водоеме резко олиготрофного типа — карьере «Нильмо», расположенном в том же районе, где работал Абдель-Малек (1968), колюшки жилой формы trachurus питались Polychaeta, Crustacea (Cladocera: Bosmina, Chydorus, Alona, Copepoda: Cyclops, Harpacticus), личинками Chironomidae, воздушными насекомыми — Thysanoptera, Hymenoptera, Coleoptera, Lepidoptera, собственными мальками, Diatomea.
Основной объект питания — упавшие в воду воздушные насекомые (Thysanoptera, Diptera, Coleoptera, Hymenoptera, Lepidoptera) 48.6 % по массе, планктон Cladocera и Copepoda 17.3, личинки стрекоз Aeshna grandis 9.7, мальки Gasterosteus aculeatus 11.5 %.
Мухомедияров (1966) указывает, что морская форма трехиглой колюшки Белого моря в весенне-летний период питается в основном личинками хирономид, планктонными рачками (Copepoda и Cladocera) и молодью рыб (в том числе собственной). Кроме того, незначительную часть пищевого спектра у нее составляли икра ивановской сельди, ракушечные рачки Ostracoda и воздушные насекомые.
Пресноводная жилая колюшка из Каунасского водохранилища, по данным Бубинас (1979), весной питалась в основном личинками Chironomidae и воздушными насекомыми, летом — личинками Chironomidae, Gammaridae, Cladocera и Copepoda, а осенью основу пищи составляли Cladocera.
В пресном оз. Дальнее (Камчатка) трехиглая колюшка является планктофагом и факультативным бентофагом (Марковцев, 1972). Пищевой спектр колюшки весьма широк: насекомые, ракообразные, моллюски и в период нереста собственная икра. Среди насекомых преобладали личинки и куколки Chironomidae. В зимние месяцы в желудках колюшки численно преобладали планктонные ракообразные, причем циклопы составляли 55—90 % от общего количества рачков. В желудках колюшки на литорали озера резко преобладали бентосные организмы, личинки Chironomidae, Gammarus и икра колюшки.
Таким образом, пищевой спектр трехиглой колюшки из разных районов Европы, Азии и Сев. Америки довольно широк, и преобладание в спектре тех или иных пищевых компонентов зависит от конкретных пищевых ресурсов в каждом водоеме. Такой широкий спектр питания трехиглой колюшки приводит к неизбежной конкуренции с другими видами рыб, и прежде всего с девятииглой колюшкой Pungitius pungitius.
В р. Биркет (Англия) Gasterosteus aculeatus и Pungitius pungitius имеют сходные спектры питания и даже сходные количественные соотношения пищевых объектов по частоте встречаемости и по весовому выражению, за исключением того, что Pungitius pungitius меньше питается водорослями. Однако в сезон размножения Gasterosteus aculeatus предпочитает более открытые места, а Pungitius pungitius уходит в зону густой вегетации водных растений в литоральной зоне водоема, что уменьшает конкуренцию между ними.
В оз. Матамек (провинция Квебек, Канада), где Pungitius pungitius и Gasterosteus aculeatus также симпатричны, Pungitius pungitius питается кладоцерами и хирономидами в литоральной зоне, a Gasterosteus aculeatus — пелагическим зоопланктоном (Coad, Power, 1973d). Личинки хирономид, кладоцеры, копеподы и другие виды зоопланктона формируют летний спектр питания Pungitius pungitius из оз. Икроавик (Аляска, США) (Cameron et al., 1973). Напротив, Pungitius pungitius из оз. Верхнее (Великие Озера, США) питается главным образом амфиподой Pontoporea affinis и мизидой Mysis relicta, а кладоцеры и личинки хирономид составляют незначительную долю в ее питании (Griswold, Smith, 1973).
Состав пищи Pungitius pungitius из Каунасского водохранилища (Литва) более простой, чем у симпатричной трехиглой колюшки: личинки хирономид, гаммарусы, кладоцеры и моллюски (Бубинас, 1979). Pungitius pungitius из водоемов Якутии питается в основном мелкими личинками хирономид и планктонными рачками (Cyclops, Bosmina, Chydorus) (Кириллов, Тетерин, 1979).
Питание других видов колюшковых изучено в значительно меньшей степени. Известно, что Gasterosteus wheatlandi (североамериканский эндемик, обитающий в прибрежных морских и солоноватых водах) во время нереста в литоральной зоне побережья питается в основном мелкими ракообразными и икрой колюшек. Большую часть этих ракообразных составляют гаммариды, меньшую — изоподы и остракоды. Полихеты были найдены лишь в 2 % исследованных желудков, личинки хирономид и водоросли также составляли незначительную долю в питании (Coad, Power, 1973с).
Пищевой спектр другого пресноводного североамериканского эндемика Culaea inconstans составляют в основном водные личинки насекомых, мелкие ракообразные, олигохеты, моллюски, водоросли и икра рыб (Winn, 1960). Culaea inconstans, ведущая скрытный зарослевый образ жизни в литоральной зоне, является бентофагом.
Apeltes quadracus, обитающая на Атлантическом побережье США и Канады в морских прибрежных водах, питается в основном гаммаридами, изоподами и личинками хирономид (Schwartz, 1965).
Spinachia spinachia — морская рыба, обитающая в Северном и Балтийском морях, питается в основном мелкими ракообразными (копеподы, амфиподы, изоподы) (Blegwad, 1917; Gross, 1979). Питание Pungitius platygaster, Pungitius tymensis и Pungitius sinensis изучено слабо (Kobayashi, 1932; Никольский, 1940, 1956; Линдберг, 1947; Световидов, 1964), но похоже, что Pungitius platygaster и Pungitius tymensis, населяющие зарослевую литоральную зону пресных водоемов, являются бентофагами, а Pungitius sinensis, населяющий пелагиаль и в меньшей степени литоральную зону водоемов, является планктофагом и факультативным бентофагом. Таким образом, из всех видов колюшковых наиболее широкий спектр питания имеют 2 вида — Gasterosteus aculeatus и Pungitius pungitius. Они являются и планктофагами, и бентофагами, и частично хищниками, поедающими икру и молодь своего вида и других видов рыб. Остальные виды колюшковых либо в большей мере планктофаги (Gasterosteus wheatlandi, Spinachia spinachia, Apeltes quadracus, Pungitius sinensis) , либо в большей мере бентофаги (Pungitius tymensis, Pungitius platygaster, Culaea inconstans).
Поскольку ареал трехиглой колюшки в значительной степени перекрывается с ареалами хозяйственно ценных видов лососевых рыб, особый интерес представляет рассмотрение пищевой конкуренции колюшки с лососевыми рыбами. Пищевая конкуренция Gasterosteus aculeatus и молоди Oncorhynchus nerka имеет место в озерах Аляски (США) и Камчатки, где оба вида многочисленны. Молодь нерки обычно проводит 1 год в озерах перед миграцией в море. В озерах бассейна р. Вуд (Западная Аляска) колюшки и молодь нерки имеют сходные спектры питания в пелагиали и литоральной части озер (Rogers, 1968). На литорали оба вида питаются мелкими ракообразными (кладоцера, копепода) и личинками хирономид. Но между обоими видами есть различия в относительном значении для них разных пищевых объектов. Так, колюшка в большей мере добывает корм со дна, а нерка — с поверхности воды. Колюшки в большей мере потребляют личинок хирономид, моллюсков, одноклеточных водорослей и собственную икру, тогда как молодь нерки — насекомых и коллембол, падающих в воду. В пелагиали оба вида потребляют зоопланктон, но нерка в основном поедает Dafnia и Bosmina, а колюшки — копепод. Пищевой спектр нерки шире спектра колюшки. Таким образом, налицо количественное смещение спектров питания, уменьшающее конкуренцию. Тем не менее Роджерс (Rogers, 1968) полагает, что при недостатке пищевых ресурсов конкуренция между этими видами может обостриться.
В оз. Дальнем (Камчатка) также симпатрично обитают колюшки и молодь нерки. Пищевой спектр колюшки приводился выше в этом разделе, и он достаточно широк, а пищевой спектр нерки в оз. Дальнем значительно уже, чем у колюшки (Марковцев, 1972). В спектр нерки входят ракообразные (Dafnia, Cyclops, Neutrodiaptomus) и насекомые (личинки и куколки хирономид и воздушные насекомые). Степень сходства пищевых спектров обоих видов имеет сезонные колебания. В зимние месяцы коэффициенты сходства (СП-коэффициенты) нарастают с 28 до 90 % в апреле, когда спектры обоих видов практически совпадают. В летние месяцы коэффициенты в целом снижаются и колеблются в зависимости от биотопа. Если в пелагиали они остаются высокими (более 80 %), то на литорали они не превышают 13 %. Основываясь на этих данных, Марковцев (1972) приходит к выводу, что между молодью нерки и колюшки в годы их высокой численности в пелагиали озера должны складываться весьма напряженные конкурентные взаимоотношения.
Расчеты, проведенные Крохиным (1970) для колюшки оз. Дальнее, показали, что колюшка в пик своей численности потребляет 1/3 от общего потребления пелагических ракообразных рыбами-планктофагами, а во время депрессии своей численности — 5—10 %. Численность колюшки по этим расчетам колеблется от 1 до 6 млн особей, или в весовом выражении 2—12 т. Численность же молоди нерки в весовом выражении колеблется от 15 до 30 т. Крохин (1970) подчеркивал, что это только грубые оценки. Однако, несмотря на это, влияние колюшки на биоценоз оз. Дальнее представляется впечатляющим.
Не менее впечатляюще влияние колюшки на ихтиоценозы Балтийского моря. Так, по данным Костричкиной (1970), популяция колюшки в Рижском заливе выедает за год около 200 тыс. т планктона и нектобентоса, а вблизи нерестилищ колюшка выедает значительное количество икры и личинок других видов рыб. В Куршском заливе колюшка потребляет только в июне около 150 т зоопланктона (Носкова, 1975) и уничтожает на нерестилищах щуки около 40 % ее икры. По мнению Мухомедиярова (1966), это является одним из факторов, влияющих на численность сельди в Белом море.
Более подробно хозяйственное значение колюшковых будет рассмотрено в разделе 5.
2.4. ХИЩНИКИ
По причине мелких размеров и широкой территориальной распространенности в северном полушарии колюшковые рыбы неизбежно должны иметь широкий набор поедающих их хищников. Действительно, во многих работах отмечалось, что колюшек выедают рыбоядные и хищные птицы, хищные рыбы, млекопитающие, ужи, лягушки, водные насекомые, пиявки (Wootton, 1976; Гомелюк, 1978; Bell, 1984).
Из млекопитающих колюшек выедает норка (Gerell, 1968), европейская выдра (Harris, 1968) и даже медведь. Так, на Камчатке во время недавней вспышки численности морской формы Gasterosteus aculeatus, нерестящейся в р. Камчатка, медведи в период нерестового хода стали потреблять трехиглую колюшку (Максимов, Долгов, 1983).
Из птиц, выедающих колюшек, можно назвать цаплю (Ardea cinerea), черноголовую чайку (Larus ridibundus), крачек Sterna paradisea и Sterna hirundo (Lemmetyinen, 1973). Нырковые утки и крохали также включают в свой спектр питания колюшек (Penczak, 1968; Bengston, 1971). Выедание колюшек чайками, крачками и крохалями обеспечивает замкнутость жизненного цикла паразитов Schistocephalus solidus и Diplostomum, для которых трехиглая колюшка является промежуточным хозяином, а перечисленные птицы — окончательными хозяевами. Подробнее об этом будет сказано в разделе 2.5.
Белл и Хаглунд (Bell, Haglund, 1978) отмечали, что водяной уж Tamnophis couchi интенсивно потреблял трехиглую колюшку в некоторых озерах Калифорнии (США). Гомелюк (1978) указывает, что в южных водоемах СССР (бассейн Черного моря) девятииглая колюшка Pungitius platygaster подвергается хищничеству со стороны водяного ужа и болотной черепахи.
Из хищников-беспозвоночных можно отметить пиявок (Haemopis mormorata), охотящихся в основном за икрой колюшек (Moodie, 1972а). По моим собственным наблюдениям, пиявка, проникшая в небольшой садок с колюшками, за несколько часов уничтожила 10 особей длиной 40—45 мм. Крупные водные насекомые, такие как жуки-плавунцы и личинки стрекоз, также нападают на колюшек Gasterosteus aculeatus, Culaea inconstans (Reimchen, 1980; Reist, 1980а, 1980b, 1981).
Тем не менее наиболее важными хищниками колюшковых являются хищные рыбы. Так, в Европе главными хищниками колюшковых являются щука (Esox lucius), окунь (Perca fluviatilus), семга (Salmo salar), голец (Salvelinus alpinus), голавль (Leuciscus cephalus), кумжа (Salmo trutta), сом (Silurus glanis), судак (Lucioperca lucioperca), налим (Lota lota), угорь (Anguilla anguilla), треска (Gadus morhua) (Фортунатова, 1959; Гофман-Кадошников и др., 1963; Gross, 1978а). В Сев. Америке, по данным Хагена и Гильбертсона (Hagen, Gilbertson, 1972), колюшкой питаются щука, индейская рыба Ptychoheilus oregonensis, лососевые рода Salmo, Salvelinus, Novumbra hubbsi.
На Дальнем Востоке СССР гольцы рода Salvelinus, микижа Salmo mykiss наряду со щукой и окунем являются серьезными хищниками по отношению к трехиглой и девятииглой колюшкам рода Pungitius (Карпов и др., 1969; Кохменко, 1972; Гриценко, Чуриков, 1977).
Но, пожалуй, как это ни странно, одними из самых существнных хищников, ограничивающих численность колюшковых рыб, являются сами колюшки. «Если б колюшки не истребляли и своей икры, то, конечно, они в скором времени перевели бы всех рыб», — писал Сабанеев (1982, с. 102). Действительно, во время сезона размножения икру и личинок собственного вида поедают самки, самцы, еще не захватившие территорию для гнезда, и даже территориальные (гнездующие) самцы пытаются «воровать» икру друг у друга (Hynes, 1950; Black, Wootton, 1970). Так, в оз. Вопато (штат Вашингтон, США) около 50 % колюшек обоих полов в нерестовый сезон имели в своих желудках икру собственного вида (Semler, 1971). Несомненно, что поедание собственной икры и молоди является одним из факторов саморегуляции численности популяции.
Противохищнические адаптации. Такие факторы противохищнических адаптаций, как число, длина и крепость спинных и брюшных колючек, механизм фиксации в выпрямленном положении колючек, число боковых пластин, размер колюшек и окраска, рассмотрены ранее в соответствующих разделах (1.1, 1.4, 1.6, 1.7). Все эти «морфологические» адаптации лучше всего реализованы у трехиглой колюшки, и экспериментально доказано, что при наличии выбора в аквариуме хищники (окунь и щука) предпочитают охотиться на гольяна (Phoxinus phoxinus), красноперку (Scardinius erythrophtalmus), карася (Carassius carassius) и в последнюю очередь на девятииглую колюшку Pungitius pungitius, избегая Gasterosteus aculeatus (Hoogland et al., 1957). Однако если колюшкам отрезали колючки, то хищники выедали их так же, как и остальных рыб. Колючки для Pungitius pungitius менее надежная защита, чем для Gasterosteus, но все же девятииглая колюшка в эксперименте меньше выедалась, чем рыба с мягкими плавниками.
Pungitius pungitius по сравнению с Gasterosteus «опирается» в большей степени на поведенческие адаптации; она реагирует на хищника с большего расстояния и старается скрыться в зарослях растений. Pungitius pungitius имеет сходный с Gasterosteus aculeatus набор хищников (Scott, Crossman, 1973).
Culaea inconstans еще более осторожная рыба, чем даже Pungitius pungitius, у которой описан такой поведенческий ответ на опасность, как закапывание в грунт. Рыба резким броском уходит от источника опасности вниз вперед головой, погружаясь в ил, и с помощью быстрых движений хвоста зарывается в грунт, проползая в нем расстояние до 60 см, затем выходит наружу и уплывает прочь (Degraeve, 1970). Culaea inconstans подвергается хищничеству со стороны щуки, крачек, чаек, выдры (Winn, 1960).
Apeltes quadracus реагирует на хищников, затаиваясь в растительности либо зарываясь в песок, или заползая в щели между камнями, что предполагает относительно большую важность поведенческих противохищнических адаптаций, чем морфологических (Hall, 1956, — цит. по: Wootton, 1976). Блоу и Хаген (Blow, Hagen, 1984) приводят список рыб, в желудках которых находили Apeltes quadracus: Anguilla rostrata (Anguillidae), Myoxocephalus aeneus (Cottidae), Esox niger (Esocidae), Scophthalmus aquosus (Bothidae), Microgadus tomcod (Gadidae), Morone americana, Morone saxatilis (Percichthydae), Perca flavescens (Percidae), Salvelinus fontinalis (Salmonidae).
Данных о хищниках Spinachia spinachia нет.
Эволюционное влияние хищников как селективного фактора, приводящего к изменению частот фенотипов, в популяциях ряда видов колюшковых будет рассмотрено в разделе 4.5. Следует подчеркнуть, что колючки и наружный костный скелет у колюшек не является абсолютной защитой от хищников, хотя и играют большую роль в эволюции колюшек. Когда колюшки находятся на ранних стадиях жизненного цикла и имеют малые размеры либо когда хищник в десятки раз крупнее колюшек, они могут интенсивно выедаться. Например, Фрост (Frost, 1954) отмечал, что в оз. Виндермере (Англия) щука свыше 40 см в длину охотнее выедает колюшек, чем гольянов, хотя последних в озере больше.
2.5. ПАРАЗИТЫ
Колюшковые являются промежуточными и окончательными хозяевами довольно большого числа видов экто- и эндопаразитов. Больше всего паразитов обнаружено у Gasterosteus aculeatus. Так, Вуттон (Wootton, 1976), обобщив данные ряда авторов-паразитологов, приводит в своей сводке перечень, включающий 94 вида паразитов, принадлежащих к 7 типам (Fungi, Protozoa, Platyhelmintes, Aschelmintes, Annelida, Arthropoda, Mollusca).
Только на территории СССР у трехиглой колюшки насчитывается 50 видов паразитов, относящихся к 6 типам. Ниже приведен список паразитов трехиглой колюшки Gasterosteus aculeatus для водоемов СССР (по: Определитель, 1962, 1975). Упомянутые определители не приводят для СССР седьмой тип паразитов — Fungi (Saprolegtiia spp.), фигурирующий в списке Вуттона (Wootton, 1976), однако, по моим наблюдениям, трехиглая колюшка и на территории СССР, когда находится в ослабленном состоянии (например, в аквариуме в скученном состоянии), поражается сапролегнией. Ниже приводится список паразитов трехиглой колюшки (по: Определитель, 1962).

Девятииглая колюшка Pungitius pungitius является хозяином 43 видов паразитов. Ниже приведен список паразитов девятииглой колюшки для водоемов СССР (по: Определитель, 1962; Определитель, 1975).

Интересно, что в пределах СССР, судя по Определителю (1962), у Gasterosteus aculeatus и Pungitius pungitius 29 видов общих паразитов, что составляет примерно 60 % перекрывания между двумя видами колюшковых.
Другие виды колюшковых являются хозяевами гораздо меньшего числа видов паразитов. Так, Gasterosteus wheatlandi имеет всего 3 (Hanek, Threllfall, 1969а; Hoffmann, 1967), Pungitius platygaster имеет 9 видов паразитов. Ниже приводится список паразитов Pungitius platygaster из водоемов СССР (по: Определитель, 1962; Определитель, 1975).

Culaea inconstans имеет 22 вида паразитов. Ниже приведен их список (по: Hoffman, 1967).

Apeltes quadracus имеет 6 видов паразитов (Hanek, Threllfall, 1968) (см. Систематическую часть). Spinachia spinachia является хозяином моногенетического сосальщика Gyrodactilus elegans (Platyhelmintes, Monogenea) (Sproston, 1946). Данных о других видах паразитов Spinachia не имеется. Вполне возможно, что относительная бедность паразитофауны других видов колюшковых по сравнению с Gasterosteus aculeatus и Pungitius pungitius объясняется недостаточной изученностью этих видов паразитологами, поскольку основное внимание уделялось вышеуказанным видам.
Баниной и Исаковым (1972) проанализированы закономерности становления паразитофауны трехиглой и девятииглой колюшек дельты р. Невы. Авторы отмечают сходство их паразитофауны как по видовому составу, так и по срокам заражения тем или иным видом паразита. Отличительная черта паразитофауны колюшек — необычайное обилие эктопаразитических инфузорий не только у молоди, но и у взрослых рыб. Это, по мнению авторов, объясняется малыми размерами рыб, отсутствием чешуи, что облегчает прикрепление эктопаразитических простейших. Гнездовое выращивание молоди колюшек самцом приводит к раннему заражению личинок колюшек триходинами и апиозомами от самца. В результате у колюшек молодь 3—4-дневного возраста (в котором у других видов рыб начинают проявляться только первые паразиты) оказывается сильно зараженной. Из других факторов, способствующих формированию богатой паразитофауны колюшек, авторы называют растянутость нереста (молодь от позднего нереста имеет возможность заражаться не только от взрослых рыб, но и от молоди более старшего возраста), стадный образ жизни, обитание в водоемах, богатых растительностью и содержащих повышенное количество органических веществ и бактерий. К факторам, перечисленным этими авторами, можно добавить еще и широкий спектр питания колюшковых. Несомненно, он способствует обогащению паразитофауны эндопаразитов колюшковых.
Баниной (1973) было сделано интересное описание своеобразного «биоценоза» из эктопаразитов на теле трехиглой колюшки р. Невы. Этот «биоценоз» включал в себя как истинных паразитов, питающихся за счет хозяина (триходин), так и бактериядных форм (апизомы, эпистилиса), а также хищников (эрастофрия). Колюшка в этом отношении является исключительным объектом среди всех других пресноводных рыб (Банина, 1973). Малые размеры колюшек облегчают их проникновение в самые небольшие водоемы. Колюшки, населяющие водоподающую систему рыбозаводов и пруды рыбхозов, могут быть прямым источником паразитарных заболеваний молоди рыб, выращиваемой в прудах (Банина, Исаков, 1972).
Колюшка родов Gasterosteus и Pungitius по причине их эвригалинности представляют большой интерес и для экспериментальных работ в области экологической паразитологии. Выяснилось, что у эвригалинных колюшек выработалась группа специфических эктопаразитов: инфузорий рода Trichodina, моногенетических сосальщиков рода Gyrodactilus, паразитических вислоногих рачков Thersitina gasterostei, приспособленных, как и их хозяева, к резким изменениям солевого режима водоема (Исаков, 1970). Если для эндопаразитов колюшек защитную роль играет хорошая осморегуляторная способность организма колюшки, благодаря чему в нем сохраняется постоянный осмотический режим и для эндопаразитов солевые условия остаются стабильными, то на эктопаразитах мы видим процесс коэволюции с хозяином, выражающийся в конечном счете в эвригалинности и паразита, и хозяина.
Девятииглая и трехиглая колюшки, как оказалось, могут играть роль в эпидемиологии дифиллоботриза, распространяя личинок широкого лентеца (Diphyllobotrium latum, Diphyllobotrium norvegicum) среди хищных рыб (щука, налим, окунь). В очагах массового скопления колюшки могут играть существенную роль. Из дифиллоботриид, паразитирующих у человека, колюшки легко заражаются лентецами: широким (Diphyllobotrium latum), чаечным (Diphyllobotrium dentdriticum) и норвежским (Diphyllobotrium norvegicum), причем экстенсивность инвазии в Карелии достигает 70 %. В то же время колюшки не представляют опасности для непосредственного заражения человека, так как не используются в пищу (Гофман-Кадошников и др., 1963).
Лучше других исследовано влияние на экологию трехиглой колюшки эндопаразита Schistocephalus solidus (сем. Ligulidae, класс Cestoda). Колюшка для этого паразита является промежуточным хозяином (Шульц, Гвоздев, 1972). В половозрелой фазе Schistocephalus solidus паразитирует в кишечнике многих рыбоядных птиц: крохалей, гагар, чаек и других. Сброшенные в воду с фекалиями птиц яйца паразита развиваются при температуре 10—18 °С за 17—20 дней. Вышедшие из яиц корацидии живут не более 2 сут. Первым промежуточным хозяином для паразита являются циклопы, в полости тела которых через 1—2 недели развиваются процеркоиды, способные заражать второго промежуточного хозяина — трехиглую колюшку. Близкий вид, Schistocephalus pungitii, поражает девятииглую колюшку, а экспериментальное заражение девятииглой колюшки Schistocephalus solidus приводило к гибели паразита из-за сильной иммунной реакции хозяина (Огг, 1968). Развитие плероцеркоида в полости тела рыбы до инвазионного состояния продолжается около 6 мес, в то время как его развитие в кишечнике окончательного хозяина до появления в матках паразита яиц завершается всего за 30 ч. Продолжительность жизни шистоцефалов в организме птицы не превышает 4 сут. Итак, жизненный цикл этого паразита протекает с участием 3 хозяев — триксенный тип развития (Шульц, Гвоздев, 1972).
Обычно величину инвазии паразита определяют двумя показателями. Экстенсивность инвазии — доля рыб в популяции, имеющих паразитов, и интенсивность инвазии — количество паразитов на одну рыбу. В ряде популяций трехиглой колюшки оба показателя достигают впечатляющих величин. Так, по моим данным, в небольшом пруду «Карьер-Нильмо» (побережье Кандалакшского залива Белого моря) 78 % рыб были поражены этим паразитом, интенсивность инвазии колебалась от 1 до 6 цестод на рыбу, отношение массы паразита к массе рыбы составляло в среднем 1 : 2, но иногда достигало значения 1.25 : 1, т. е. масса паразита превышала массу рыбы.
В ряде прудовых популяций Gasterosteus aculeatus на юго-западе Англии экстенсивность инвазии Schistocephalus solidus достигает 90%, а интенсивность — до 106 мелких плероцеркоидов на рыбу (Arme, Oven, 1967; Pennyquick, 1971).
Паразит сильно уменьшает упитанность рыбы, ее весовой и линейный рост, задерживает развитие гонад у самок, вызывает повышенное потребление кислорода у пораженных рыб (Arme, Oven, 1967; Lester, 1971). Сдавливание плавательного пузыря и искажение формы тела рыб из-за наличия паразита затрудняют плавание колюшек (паразитированные рыбы держатся в приповерхностном слое воды) и делают рыб легко доступными для птиц, способствуя этим завершению жизненного цикла (Arme, Oven, 1967). Паразитированные самцы не могут закончить постройку гнезд, а зараженные самки с трудом отвечают на ухаживание самцов и не могут проникнуть в гнездо, не разрушив его при этом (Arme, Oven, 1967).
Таким образом, Schistocephalus solidus является мощным фактором, регулирующим численность колюшек, вызывая прямую смертность рыб и разнообразные сублетальные эффекты на популяцию Gasterosteus aculeatus.
Интересно отметить высокую скорость нарастания экстенсивности инвазии Schistocephalus solidus во вновь образованной пресноводной популяции. Так, по моим данным, при интродукции морской формы Gasterosteus aculeatus (не имеющей этого паразита) в пресноводный изолированный водоем — затопленный карьер «Черный» на побережье губы Чупа (Кандалакшский залив Белого моря) — уже на следующий год после выпуска основателей в этот водоем 6 % колюшек — потомков первого поколения — было поражено паразитом. Через 5 лет уже 45 % рыб в популяции, было инвазировано шистоцефалом. В условиях ограниченного размера водоема (10 х 40 м, глубина 12 м) и, следовательно, лимитированной кормовой базы высокая экстенсивность инвазии паразитом явилась фактором, эффективно ограничивающим плотность популяции Gasterosteus aculeatus.
Летальные и сублетальные эффекты инвазии колюшек другими видами паразитов привлекли меньшее внимание паразитологов. Треллфалл (Threllfall, 1968) описал массовую гибель колюшек из пресноводного пруда на о. Ньюфаундленд (Канада), пораженных Schistocephalus solidus и эктопаразитом карповой вошью, Argulus canadiensis. Автор полагает, что гибель была вызвана стрессом вследствие двойного влияния обоих паразитов. По нашим личным наблюдениям, инвазия карповой вошью, Argulus foliaceus (широко распространенной в бассейне р. Невы), вызывает 50%-ную гибель колюшек в течение суток в 80-литровом аквариуме при помещении туда 20 экз. трехиглой колюшки (в среднем на каждой рыбе было 7—8 паразитов). Ichthyophthirius multifiliis (Ciliata, Protozoa) — эктопаразит кожи — вызвал массовую гибель Gasterosteus aculeatus в одном из пресных озер Шотландии (Великобритания). В 1958 г. там погибли все сеголетки и большая часть годовиков и двухгодовиков (Hopkins, 1959). Эктопаразит Gyrodactilus alexanderi (Monogenea, Plathyhelminthes), паразитирующий на коже рыбы, может вызвать гибель колюшки при интенсивности инвазии 300—400 паразитов на рыбу. Однако это происходит редко, так как колюшки имеют защитную реакцию в виде «сбрасывания» слизистого слоя с кожи и тем самым избавляются от эктопаразита. Более того, сброшенные паразиты поедаются колюшками (Lester, 1972). Вредные эффекты остальных паразитов на колюшек менее очевидны. Возможно, крупные цисты Glugea anomala (Sporozoa, Protozoa) — эндопаразиты в соединительной ткани трехиглой и девятииглой колюшки — мешают плаванию рыб, а метацеркарии ряда видов Diplostomum (Diplostomum spataceum, Diplostomum gasterostei, Diplostomum scudderi — Digenea, Plathyhelmintes) — эндопаразиты глаз Gasterosteus aculeatus и Pungitius pungitius — затрудняют зрение рыб, облегчая выедание их птицами — окончательными хозяевами (Arme, Oven, 1967; Lester, 1974).
Интересным аспектом биологии одного из североамериканских видов колюшковых Apeltes quadracus является его «чистящее» поведение. Apeltes quadracus поедает эктопаразита (Monogenea рода Gyrodactilus) с кожи другого вида рыбы Lucania parva (имеющего длину 5—6 см). Причем Lucania сама «просит» ее почистить, принимая характерную позу: голова вверх и грудные плавники быстро вибрируют (Tyler, 1963).
2.6. ТИПЫ ЖИЗНЕННОГО ЦИКЛА И МИГРАЦИИ
У колюшковых обнаружено три типа жизненного цикла: 1) морской тип: рыбы живут и размножаются в море, в морской и солоноватой воде; 2) пресноводный тип: рыбы живут и размножаются в пресноводных водоемах; 3) анадромный (проходной) тип: рыбы живут в морской воде, а для размножения мигрируют в пресные воды. К первому типу жизненного цикла относятся Spinachia spinachia, Apeltes quadracus, Gasterosteus wheatlandi и популяции морской формы Gasterosteus aculeatus. Ко второму типу относятся Culaea inoconstans, Pungitius tymensis, Pungitius sinensis, Pungitius platygaster, пресноводные популяции Pungitius pungitius, пресноводная форма Gasterosteus aculeatus. К третьему типу относятся проходная форма Gasterosteus aculeatus и полупроходные популяции Pungitius pungitius. Как видно, наибольшим разнообразием типов жизненного цикла обладает Gasterosteus aculeatus (у этого таксона есть все 3 типа). Если располагать все роды колюшковых в порядке уменьшения привязанности к морским водам, то этот ряд примет следующий вид: Spinachia — Apeltes — Gasterosteus — Pungitius — Culaea (Nelson, 1968b).
Весенние нерестовые миграции свойственны всем видам колюшковых: у зимующих в море колюшек имеют место миграции из пелагиали в прибрежные солоноватые или пресные воды, а у жилых пресноводных форм — миграции из более глубоких участков водоемов в более мелкие или из главного русла реки в притоки. Осенние миграции взрослых особей и молоди идут в обратном направлении.
При анадромных миграциях типа «морская вода — пресная вода» рыбы должны физиологически адаптироваться к изменяющейся солености среды, поэтому у анадромных форм колюшковых в процессе эволюции выработался весьма совершенный осморегуляторный аппарат двустороннего действия, обеспечивающий осмотическую стабильность внутренней среды организма и в морской, и в пресной воде. Подробнее осморегуляция колюшковых будет рассмотрена в следующем разделе (2.7).
Какие же факторы инициируют нерестовые миграции колюшковых и какое адаптивное значение имеют эти миграции? Как и у большинства анадромно мигрирующих рыб, весенняя нерестовая миграция анадромных колюшковых стимулируется увеличением длины светового дня и повышением температуры воды весной. Осенняя же миграция, наоборот, инициируется понижением температуры и уменьшением светового дня. Гормоны, продуцируемые гипофизом, являются посредниками влияния температуры и света на начало миграции (Baggerman, 1957).
Функциональное значение миграций подробно обсуждалось для генеративно морских и генеративно пресноводных рыб Никольским (1984, с. 230). Видимо, к колюшковым также применим ход рассуждений Никольского относительно миграций лососевых и сельдевых (также имеющих проходные и жилые формы). Наличие жилых и проходных форм позволяет колюшковым более широко «эксплуатировать» пищевые ресурсы целого «набора» местообитаний, чем если бы вид был либо морским, либо пресноводным. Для фитофильногнездящихся колюшковых условия нереста в литоральной зоне рек, ручьев, озер, проток и других типов пресных водоемов более благоприятны, чем в море. Перейти же полностью к жизни в пресных водоемах колюшкам опасно, поскольку при их эврифагии, короткоцикловости, высоких темпах размножения, т. е. способности к быстрому достижению высокой численности, наступило бы истощение кормовых ресурсов, которых больше в море, чем в пресных водоемах.
Наиболее впечатляюще выглядят анадромные нерестовые миграции у трехиглой колюшки. Так, Ригэн (Regan, 1911) описывал миграцию Gasterosteus aculeatus в реки восточного побережья Англии как «движение огромных колонн». Количество рыб было так велико, что местные фермеры могли наловить в день до 3 т колюшки каждый. Мухомедияров (1966) так описывал нерестовую миграцию трехиглой колюшки в Белом море: «Весной колюшка в огромных количествах подходит к берегам и поедает все, что ей доступно, особенно икру на нерестилищах других рыб... Когда температура воды в верхних слоях достигнет 6—8 °С, у берегов появляются первые косяки... эти подходы несомненно нерестовые. Неполовозрелых особей не бывает. Колюшка заходит в ручьи и реки и поднимается по ним вверх. Иногда по рекам она проходит в проточные озера и здесь нерестует, частично оставаясь на зимовку. Отнерестовавшаяся колюшка, и главным образом выклюнувшаяся молодь, достигнув длины 20—25 мм, в большом количестве скатывается в море» (с. 459). На Камчатке мигрирующая тихоокеанская колюшка заходит в р. Камчатку вверх на расстояние до 200 км от устья (В. А. Максимов, личн. сообщ.).
Между тем ранее ни отечественными авторами (за исключением Гомелюка (1978), описавшего нерест колюшки в солоноватой воде — 18 ‰), ни американскими и европейскими зарубежными авторами не отмечалось, что трехиглая колюшка нерестится в морской воде в прибрежной зоне (Munzing, 1959; Мухомедияров, 1966; Narver, 1969; Hagen, Gilbertson, 1972, и мн. др.). Однако в Кандалакшском заливе Белого моря мне приходилось наблюдать нерест колюшки в полносоленой морской воде — 26—28 ‰ в литоральной зоне морских заливов и литоральных лужах, остающихся после отлива (Кислая губа близ Беломорской биостанции МГУ, бухта Лобаниха на о. Великом, Бабье море близ о. Великий). В этих местах в 1975—1979 гг. наблюдались плотные и многочисленные нерестовые колонии, исчислявшиеся десятками тысяч особей, что исключает случайность этого явления (нереста в полносоленой морской воде) (Зюганов, 1980). Таким образом, можно говорить о морской форме колюшки, живущей и размножающейся в море. В Черном море (Севастопольская бухта, Одесский залив), на побережье Японского моря (Приморский край), окрестности морской базы ДВНЦ «Витязь», на побережье Охотского моря (Сахалин, о. Итуруп Курильской гряды) я не обнаружил нереста трехиглой колюшки в морской воде. Во всех перечисленных районах колюшка нерестилась в пресных ручьях, реках и озерах. Можно предположить, что береговая линия моря в этих районах была неблагоприятна для нереста колюшки из-за отсутствия растительности (песчаный и мелкогалечный грунт) и сильного прибоя. Однако в солоноватой (соленость 18 ‰) лагуне Хангузе (близ г. Оха, Северный Сахалин) трехиглая колюшка вместе с Pungitius pungitius нерестилась на мелководье в зоне водной растительности. Чрезвычайно изрезанная береговая линия Кандалакшского залива Белого моря с обилием заросших водной растительностью мелководных заливов и многочисленных литоральных луж с илистым грунтом создает благоприятные условия для нереста трехиглой колюшки, поэтому в данном районе и наблюдается «необычная» на первый взгляд картина — нерест колюшки в морской воде. Однако можно предположить, что любая популяция проходной формы трехиглой колюшки в любой части ареала способна при необходимости нереститься в морских условиях. Подтверждением этому служит тот факт, что сперматозоиды самцов проходной формы, выловленных из пресной воды на Черном, Японском, Балтийском и Белом морях, активировались в морской воде соленостью 35 ‰ (Зюганов, 1983в). Проведенные эксперименты по солеустойчивости икры и спермиев беломорских колюшек показали, что дифференциация беломорской колюшки на «морскую» и «проходную» генетически не детерминирована. Различия в физиологических характеристиках спермиев между морскими и проходными самцами носят фенотипический характер. Очевидно, вся беломорская популяция способна размножаться как в пресной, так и в морской воде, и разделение на «морскую» и «проходную» группировки весьма условно, так как спермии всех морских самцов способны переключаться на активацию в пресной воде, а спермии проходных самцов потенциально сохраняют жизнеспособность в морской воде весь сезон размножения (Соин, Зюганов, 1979; Зюганов, 1980).
Тем не менее сперматозоиды жилой пресноводной формы трехиглой колюшки в бассейне Белого моря (морфы leiurus) потеряли жизнеспособность в морской воде, что свидетельствует о глубоких генетических различиях между морской и жилой группировками Gasterosteus aculeatus на Белом море (Зюганов, 1980). Подробнее эта проблема будет обсуждена в разделах 2.7 и 4.5.1.
Gasterosteus wheatlandi обитает в прибрежных морских водах восточного побережья Сев. Америки и нерестует в приливных лужах, соленость которых, по данным Коада и Павера (Coad, Power, 1973с), колеблется от 10 до 32 ‰. Таким образом, этот вид не совершает анадромных миграций.
Анадромные нерестовые миграции девятииглой колюшки Pungitius pungitius в литературе описаны не были. Известно, что подавляющее большинство популяций Pungitius pungitius обитает в пресных водах Евразии и Сев. Америки (Wootton, 1976). Однако Мак-Фейл (McPhail, 1963) обнаружил в Канаде прибрежную солоноватую форму (которую он называет берингийская). Мной наблюдалась солоноватоводная форма Pungitius pungitius на Белом море (Кислая губа, губа Чупа) в распресненных участках морских заливов, а также в солоноватых лагунах на о. Сахалин (Тунайча, Анива, Хангузе). Весной 1975—1978 гг. (май — начало июня) мне приходилось наблюдать нерестовый ход Pungitius pungitius из морского залива Кислая губа в пресное оз. Ершовское (близ Беломорской биостанции МГУ), а в июне 1983—1984 гг. нерестовый ход из зал. Левин Наволок в пресный ручей (близ пос. Чкалов Лоухского района Карельской АССР, губа Чупа). Очевидно, солоноватоводная форма Pungitius pungitius способна к небольшим анадромным миграциям. У остальных видов рода Pungitius, видимо, крупных нерестовых миграций нет. Pungitius tymensis и Pungitius sinensis — типичные обитатели пресных вод (Kobayashi, 1932). Большинство популяций Pungitius platygaster также пресноводные, однако некоторые популяции обитают в слабосолоноватых лиманах Черного моря с соленостью до 6 ‰ (Гомелюк, 1978), и аральский подвид Pungitius platygaster aralensis обитает в прибрежной зоне Аральского моря с соленостью 10—12 ‰ (Берг, 1949).
Culaea inconstans — типичный пресноводный вид, обитающий в Сев. Америке, который имеет наименьшую солеустойчивость среди других колюшковых. Однако солеустойчивость Culaea выше, чем у многих других генеративно пресноводных видов рыб Сев. Америки (Winn, 1960; Nelson, 1968). Весной Culaea inconstans мигрирует с больших глубин водоема в меньшие. При таянии льда рыбы движутся вверх по течению и из главного русла рек устремляются в протоки и проточные пруды, заливы. Рыбы предпочитают температуру воды более высокую, чем в главном русле, но не выше 19 °С, и зону густой вегетации (Maclean, Gee, 1971).
Apeltes quadracus обитает в солоноватых и морских водах восточного побережья Канады и США, нерестится также в солоноватых прибрежных водах в зоне густой растительности (Blow, Hagen, 1984). Таким образом, это типично морская форма. Spinachia spinachia обитает в морях в прибрежной части не глубже 20 м при средней солености 33—35 ‰, но при нересте может проникать в эстуарии рек, где соленость понижена до 8 ‰. Нерестится в зарослях зостеры и фукусов в прибрежной зоне или в литоральных лужах, остающихся после отлива. В пресной воде погибает (Bertin, 1925; Raffy, 1954). Это типичная морская рыба, не совершающая анадромных миграций.
2.7. ОСМОТИЧЕСКАЯ РЕГУЛЯЦИЯ
Из всех видов колюшковых самой совершенной осморегуляцией обладает Gasterosteus aculeatus, которая, по мнению Хлебовича (1968, с. 1591), достойна занимать одно из первых мест в списке эвригалинных рыб мировой фауны. Из других видов рыб мировой фауны по степени эвригалинности с колюшкой, пожалуй, могут сравниться лишь представители рода Fundulus (Fieldmeth, Waggoner, 1972), которые, как и трехиглая колюшка, могут не только жить, но и нереститься в пресной и морской воде высокой солености. Популяции трехиглой колюшки обитают как в слабоминерализованной воде крайне олиготрофных пресных озер (Hagen, Gilbertson, 1972), так и в супергалинных водах, где соленость достигает 80—100 ‰ (соленое оз. Течиргиоль, Румыния) (Bacesku, Mayer, 1956). Остальные виды колюшковых имеют меньшие пределы толерантности (устойчивости) к воде разной солености. Так Spinachia spinachia выживает в пределах 5—35 ‰ (Bertin, 1925). При резком перемещении Spinachia spinachia из морской воды 35 ‰ в воду с соленостью 8—9 ‰ она выживает, но погибает при аналогичном перемещении в воду с соленостью 4—5 ‰ (Raffy, 1954).
Apeltes quadracus, обитающая в прибрежных морских водах восточного побережья Атлантического океана на о. Ньюфаунленд на юг до штата Вирджиния (США), образует, однако, небольшое число пресноводных популяций в Новой Шотландии и Пенсильвании (США) (Nelson, 1968). Нельсон (Nelson, 1968), исследуя жилую Apeltes quadracus из пресного ручья, показал, что соленостная толерантность ее достигает в эксперименте 45 ‰ при 8 °С и 38 ‰ при 16 °С. У пресноводной Pungitius pungitius в том же эксперименте верхний предел солеустойчивости был равен сответственно 32 и 26 ‰. В Саскачеване (Канада) верхний предел солеустойчивости Pungitius pungitius был 20 ‰ (Nelson, 1968b). Мюнцинг (Munzing, 1966) полагает, что Pungitius pungitius нерестится лишь в пресной воде, однако я наблюдал размножение Pungitius pungitius в солоноватых озерах на Северном Сахалине (лагуна Хангузе, в 5 км от г. Оха) при солености 18 ‰. Близ Беломорской биостанции МГУ (Кандалакшский залив Белого моря) в проливе, отделяющем о. Еремеевский от материка, на мелководье также происходит нерест Pungitius pungitius при колебаниях солености 5—21 ‰. Culaea inconstans (пресноводный североамериканский эндемик) имеет верхний предел солеустойчивости 21 ‰ при 22 °С (Armitage, Olund, 1962) и, по данным Нельсона (Nelson, 1968b), 21 ‰ при 8 °С и 15 ‰ при 16 °С.
Поскольку среди всех видов колюшковых наиболее широким диапазоном солеустойчивости обладает Gasterosteus aculeatus, то именно на этом виде были выполнены исследования механизмов водно-солевого обмена и осмотической регуляции (Gueylard, 1924; Heuts, 1942, 1943, 1946, 1947, 1949; Koch, Heuts, 1943; Mullins, 1950; Baggerman, 1957; Fridberg, Olsson, 1959). He только морская, но и жилая пресноводная форма trachurus трехиглой колюшки толерантна к высокой солености, хотя и в меньшей степени, чем морская (Heuts, 1946, 1947а, 1947b).
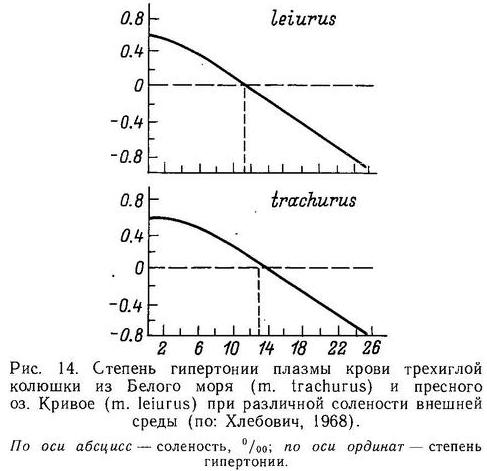
Эвригалинность трехиглой колюшки детерминируется осморегуляторным механизмом двустороннего действия, обеспечивающим гиперосмотическую регуляцию при жизни в пресной воде и гипоосмотическую регуляцию в море. Хлебовичем (1968) было показано, что у морской формы trachurus Белого моря относительное осмотическое равновесие между внешней средой и плазмой крови устанавливается при солености морской воды 13 ‰, а у жилой формы leiurus из оз. Кривое — при 11 ‰ (рис. 14). Таким образом, показатели осмотического давления внутренней среды пресноводной и морской колюшек различаются на 2 ‰. Интересно, что положение пиков максимальной продолжительности движения сперматозоидов (в воде разной солености) у обеих форм колюшки также различалось и почти совпадало с показателями осмотического давления внутренней среды организмов жилой формы leiurus и морской trachurus (Зюганов, Хлебович, 1979) (рис. 15). Максимальная продолжительность движения сперматозоидов свидетельствует о том, что при данной солености воды имеется осмотическое равновесие между осмотическим давлением цитоплазмы спермия и окружающей средой (Хлебович, 1974). Следовательно, при исследовании одного и того же материала двумя разными методами выявлены сходные различия в осмотических давлениях крови и цитоплазмы спермиев двух группировок колюшки.
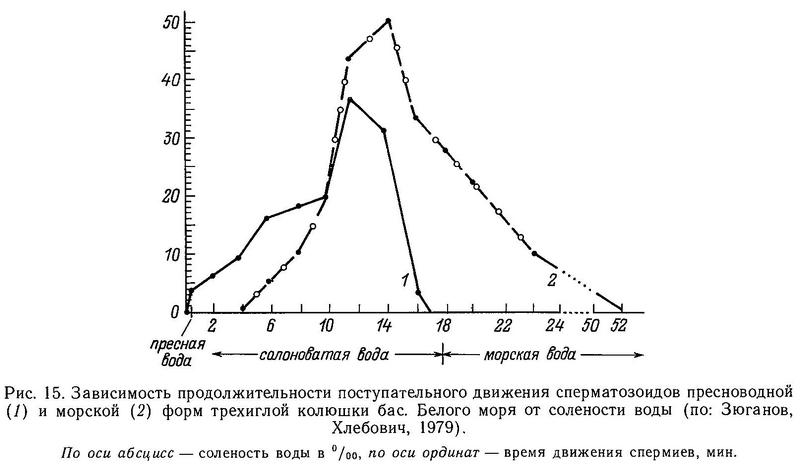
Представленные данные говорят о том, что при солености ниже 11—13‰ колюшки осуществляют гиперосмотическую регуляцию, а при солености выше 11—13 ‰ — гипоосмотическую.
В морской воде кровь и другие жидкости тела колюшки гипотоничны по отношению к внешней среде. Они имеют пониженную концентрацию неорганических ионов (по сравнению с внешней средой) и, следовательно, пониженное осмотическое давление, так что рыба имеет тенденцию терять воду и «приобретать» ионы из окружающей среды. Рыбы должны иметь механизм, сохраняющий воду и экскретирующий ионы. Когда рыба находится в пресной воде, возникает ситуация противоположная, соответственно противоположными становятся осмотические проблемы. И в морской, и в пресной воде колюшка должна иметь механизм, поддерживающий осмотическое давление и ионный состав внутренних жидкостей постоянными. Как и у других эвригалинных рыб, для этого используются главным образом почки и жабры (роль кожи незначительна). В море колюшка, компенсируя потерю воды, пьет морскую воду (Mullins, 1950). Избыток солей, «просочившихся» через жабры, поверхность тела и поступивших с выпитой водой, выводится с фекалиями, через почки и хлоридные клетки жабр (Гинецинский, 1963; Biether, 1970; Matthiessen, Brafield, 1977). В пресноводном водоеме избыток воды, приникающей в тело колюшки через жабры, поверхность тела и с пищей, удаляется с мочой, а одновалентные ионы адсорбируются теми же хлоридными клетками и реабсорбируются из клубочкового фильтрата клетками почечных канальцев (Mourier, 1970; Biether, 1970) (рис. 16).
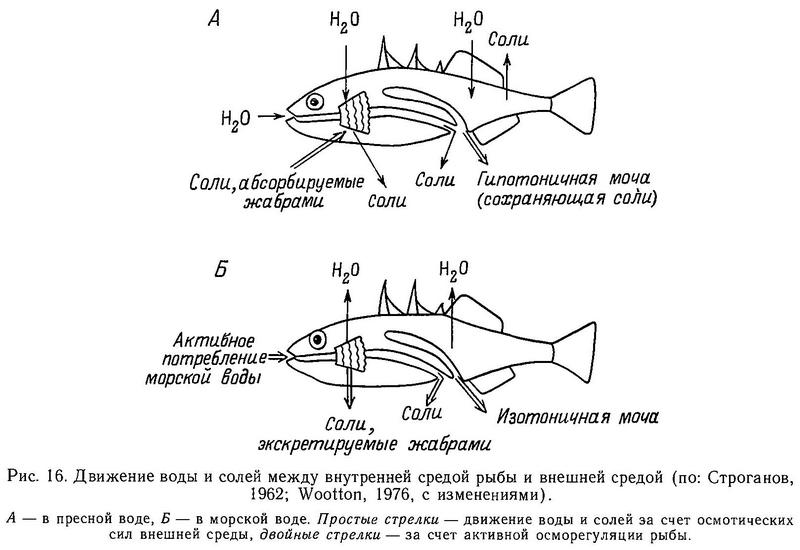
При перемещении в эксперименте морской колюшки морф trachurus и semiarmatus из пресной воды в морскую они обнаруживали увеличение потребления кислорода, что свидетельствует об активных энерготратах для поддержания осмотических и ионных характеристик жидкостей тела. Напротив, жилая leiurus не обнаруживала увеличения потребления кислорода в аналогичной ситуации. В то же время у leiurus наблюдалось увеличение массы «пула свободных аминокислот», что помогло рыбам пассивно приспособиться к увеличению осмотического давления внешней среды без затрат энергии (Gutz, 1970). Этот механизм пассивного процесса осморегуляции работает только при относительно высоких температурах (20 °С) и неэффективен при низких, 2.5—3.5 °С, — leiurus не выживали в холодной морской воде. Trachurus и semiarmatus, использующие активный процесс осморегуляции в морской воде, выдерживали высокую соленость даже при низких температурах. Так, в опыте Гуте (Gutz, 1970) использовал по 10 особей trachurus, leiurus и semiarmatus. Температуру морской воды соленостью 35 ‰ понижали в течение 7 дней с 20 до 1 °С. Все особи semiarmatus и trachurus выжили без потери своей типичной серебристой окраски и нормального поведения. Среди leiurus 7 особей погибали при температуре 2.5—3.5 °С, а оставшиеся 3 особи окрасились в черный цвет, вяло плавали. При наличии выбора: холодная пресная — холодная морская вода leiurus предпочитали пресную. Эти данные Гутса (Gutz, 1970) имеют принципиальное значение для понимания генетической дифференциации и распространения по ареалу разных форм трехиглой колюшки. Вероятно, морфологические варианты по числу костных боковых пластин генетически связаны с разными механизмами осморегуляции. При таком допущении становится понятным, почему leiurus ограничены лишь пресными водами на всем огромном ареале Gasterosteus aculeatus. Более подробно этот вопрос будет рассмотрен в разделе 4.5.
Несмотря на толерантность к широкому диапазону солености, leiurus даже в умеренных температурах имеет более узкие пределы, чем trachurus. Интересно, что даже внутри одной популяции leiurus с большим числом пластин более солеустойчивы (Heuts, 1947b).
По данным Коха и Хойтса (Koch, Heuts, 1943), полученным на бельгийских колюшках в нерестовый весенний сезон, и trachurus, и leiurus сужают свой диапазон солеустойчивости. Например, leiurus, которые вне нереста легко переносили воду соленостью 45 ‰, при созревании гибли даже в воде 35 ‰. У trachurus было отмечено сходное падение верхнего предела солеустойчивости: они лучше выживали в воде низкой солености. Осенью же мигрирующие trachurus, наоборот, начинали предпочитать морскую воду (Baggerman, 1957; Lam, Hoar, 1967). Исследования гормонального контроля осморегуляции выявили важную роль гипофиза и щитовидной железы в регулировании миграционного цикла проходных trachurus (Koch, Heuts, 1943; Baggerman, 1957; Gutz, 1970). Весной увеличение длины светового дня и повышение температуры воды индуцируют активность гипофиза, который секретирует гонадотропный и тиреотропный гормоны. Увеличение продукции тиреотропного гормона стимулирует щитовидную железу увеличить секрецию гормона тироксина, действие которого приводит к уменьшению способности рыб, живущих в морской воде, регулировать ионный состав жидкостей тела и изменяет их соленостные предпочтения так, что рыбы движутся в более пресную воду. Увеличение уровня тироксина в крови индуцирует также локомоторую активность рыб, что важно для успешного осуществления миграции. После нереста с уменьшением длины дня и понижением температуры воды активность гипофиза уменьшается, и координированно уменьшается активность щитовидной железы, что приводит к повышению способности осуществлять гипоосмотическую регуляцию и к предпочтению соленой воды (Baggerman, 1957; Gutz, 1970).
Интересно отметить, что осморегуляторный аппарат проходной трехиглой колюшки настолько хорошо «справляется с обязанностями», что мигрирующие в пресную воду колюшки не прекращают питания, как это делают проходные рыбы из других систематических групп (например, лососевые) (Никольский, 1974, с. 240). Прекращение питания лососевых, вплоть до потери способности, ферментов кишечника лососевых (чавычи) расщеплять белки, интепретируется как способ уменьшения количества воды, заглатываемой рыбой с пищей, поскольку в это время осморегуляторной проблемой становится тенденция к «разбавлению» водой внутренних биологических жидкостей рыбы. Видимо, такой дополнительный способ осморегуляции «запрещен» для колюшки с ее небольшой плодовитостью и необходимостью отложить несколько кладок икры за короткий нерестовый сезон, а для этого и на нерестилищах ей необходимо усиленное питание.
Не менее интересным является вопрос о диапазоне соленостной толерантности и осморегуляции ранних стадий онтогенеза колюшковых. И здесь данные в основном были получены на трехиглой колюшке. Так, Хойтс (Heuts, 1946, 1947b) исследовал выживаемость икры в воде разной солености у проходной trachurus, нерестившейся в низовьях одной из рек Бельгии, и жилой leiurus, обитающей в верховьях этой реки; пространственная зона контакта между ними была ограничена небольшим участком реки. Хойтс обнаружил, что в эксперименте выживаемость икры leiurus х leiurus была максимальной в пресной и слабосолоноватой (до 6 ‰) воде, в то время как выживаемость икры trachurus х trachurus была максимальной при солености 17 ‰. Гибридная икра от скрещивания trachurus х leiurus имела оптимум при солености в зависимости от того, самка какой формы использовалась при скрещивании. Если самка была trachurus, то гибридная икра обнаруживала оптимум выживаемости, равный оптимуму икры от скрещивания trachurus х trachurus. Если самка была leiurus, то оптимум соответствовал оптимуму икры leiurus х leiurus. Как видим, здесь налицо материнский эффект. Хойтс (Heuts, 1947b) предполагает, что такая физиологическая характеристика гибридной икры является одним из факторов, лимитирующих поток генов между двумя популяциями.
Мак-Фейл (McPhail, 1969) исследовал солеустойчивость икры пресноводной формы leiurus (меланистической формы) в Британской Колумбии (Канада); По его данным, икра гибнет в морской воде соленостью 28.5 ‰ на стадии гаструляции; кроме того, взрослые особи leiurus также гибли в морской воде через 1—4 ч после перемещения их туда.
Поданным Линдсея (Lindsey, 1962а), икра колюшки морфы leiurus показывала низкую выживаемость в солоноватой воде свыше 16 ‰.
В то же время икра и проходной формы trachurus, и жилой leiurus из бассейна Белого моря проходит нормальное эмбриональное развитие и в морской и в пресной воде. Процент вылупления в морской (26—28 ‰) и пресной воде при температуре 11—16 °С во всех вариантах опытов был высоким и колебался между 91 и 98 %. Более того, икра обеих форм также успешно развивалась при режиме ежесуточной смены воды в лотке с морской на пресную (Соин, Зюганов, 1979; Зюганов, 1980).
Существенные различия между всеми вышеупомянутыми данными по солеустойчивости икры двух форм колюшки свидетельствуют о географической изменчивости по соленостной толерантности икры, а также, на мой взгляд, говорят о разной степени «древности» жилой leiurus в процессе ее отчленения от морской формы trachurus независимо в разных участках ареала. В частности, хорошая выживаемость икры leiurufe из различных озер бассейна Белого моря говорит об относительной «молодости» этих пресноводных популяций и о том, что в «генетической памяти» leiurus еще записан гипоосмотический тип осморегуляции. О диапазоне солеустойчивости сперматозоидов колюшковых до недавнего времени данных не было. Такие данные для трехиглой колюшки были получены недавно (Соин, Зюганов, 1979; Зюганов, Хлебович, 1979; Зюганов, 1980, 1981а, 19816, 19836). Оказалось, что сперматозоиды морской формы trachurus из бассейна Белого моря активируются в широком диапазоне солености от пресной воды до морской соленостью 50 ‰, в то время как спермии жилой формы leiurus из бассейна Белого моря имеют диапазон 0—16 ‰ (рис. 15). Различия эти носят генетический характер, поскольку даже выдерживание самцов leiurus в течение месяца в морской воде соленостью 26 ‰ не вызывало последующей активации спермиев в морской воде (Соин, Зюганов, 1979). Исследование функциональной основы различий в реагировании на соленость сперматозоидов двух форм колюшек показало, что из доминирующих в морской воде катионов натрия, кальция, магния, калия и анионов хлора только ион натрия в области высоких концентраций ингибирует активность спермиев leiurus (табл. 6). Опыты с АТФ, а также с игибиторами электроневозбудимых натриевых и хлорных каналов плазматической мембраны амилоридом и фуросемидом показали, что физиологические различия сперматозоидов определяются различиями в функционировании системы ионоселективных каналов (по-видимому, в первую очередь натриевых) (Зюганов, Хлебович, 1979). Причиной низкой солерезистентности спермиев leiurus сравнительно с trachurus является повышенная проницаемость мембран для ионов натрия. Очевидно, leiurus характеризуется повышенной, а морская форма trachurus пониженной плотностью ионоселективных натриевых каналов плазматической мембраны сперматозоидов (Зюганов, 19816). Проведенные позднее эксперименты позволили уточнить основу физиологических различий между двумя формами спермиев. Следствием повышенной плотности натриевых каналов плазматической мембраны у спермиев leiurus может быть угнетающее действие натрия, проникающего в большом количестве внутрь клетки, обусловленного его деполяризующим действием на мембрану или негативным косвенным влиянием на кальциевую проницаемость (спермии leiurus активировались в морской воде соленостью 26 ‰ с искусственно увеличенным содержанием в ней кальция в 5 раз) (Зюганов, 1983в).
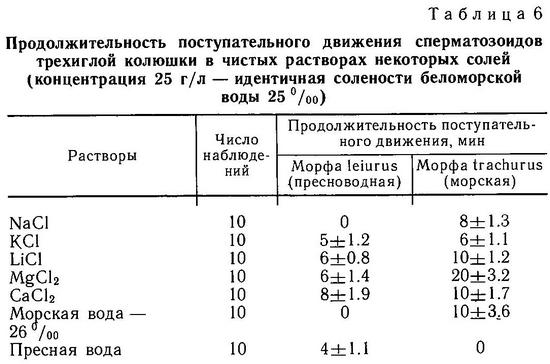
Широкий диапазон солеустойчивости обнаружили также сперматозоиды проходной формы trachurus из Балтийского, Черного и Японского морей (Зюганов, 1983в). К сожалению, в бассейнах этих морей не удалось найти жилой формы leiurus и исследовать диапазон солеустойчивости у этой формы.
Есть основания полагать, что физиологические различия спермиев двух форм детерминированы генетически. Так, сперматозоиды гибридов semiarmatus от скрещивания trachurus х leiurus обнаружили изменчивость: часть спермиев (примерно 30—50 %), активировалась в морской воде (т. е. вела себя как trachurus), а часть не активировалась (вела себя как leiurus). Судя по всему, гены, определяющие морфологические варианты трехиглой колюшки, тесно связаны с генами, определяющими солеустойчивость сперматозоидов (Зюганов, 19816, 1983в; Зюганов и др., 1987).
Приведенные выше данные Гутса (Gutz, 1970) о наличии у взрослых особей жилой формы leiurus лишь пассивного механизма осморегуляции, не эффективного в морской воде при низких температурах, а также наши данные об ингибировании морской водой (даже при высоких, порядка 15—20 °С, температурах) активного движения спермиев leiurus приводят к заключению о невозможности существования самовоспроизводящейся группировки leiurus в море и о неминуемом вымирании этой формы при резком осолонении пресноводного водоема. Недавно это заключение было подтверждено экспериментально. Интродукция 120 особей leiurus, взятых из пресного озера в солоноватый водоем с соленостью 17 ‰, не привела к успеху: все основатели погибли зимой, не дав потомства (Зюганов, 1985а).
Тем не менее Белл (Bell, 1979b) сообщил, что в морской лагуне (Южная Калифорния, США) с соленостью 32 ‰ он наблюдал нерест leiurus. Это было летом, после пересыхания пресного ручья, впадающего в лагуну, где постоянно обитала популяция leiurus, которую засуха вынудила «переселиться» в морской водоем. Возможно, что в южный частях ареала при высоких температурах колюшки leiurus не утратили способность к обитанию в соленой воде. Рауниш и соавт. (Raunich et al., 1972) отмечали, что в Италии (южный фланг ареала Gasterosteus aculeatus), где обитает лишь морфа leiurus, часть популяций представлена жилыми пресноводыми формами, другая часть жизненного цикла проводит в морских лагунах, и рыбы из этих «миграционных» популяций обладают гемоглобином крови, электрофоретически отличным от такового пресноводных популяций.
Таким образом, особенности популяционной структуры трехиглой колюшки (наличие морской проходной и жилой пресноводной группировок) делают ее чрезвычайно удобным объектом для исследования механизмов осмотической регуляции, а также механизмов коэволюции систем разных признаков. При сравнении осморегуляции проходной и жилой форм колюшки уже получено много интересных для физиологии результатов, и в будущем есть надежда получить ответы на многие вопросы о механизмах миграций и осморегуляции. Мелкие размеры и короткий жизненный цикл колюшек позволяют проведение с ними разнообразных экспериментальных работ.
Ряд хозяйственно ценных видов рыб (таких как кефали, сиги, лососи, корюшка и др., многие из которых являются или станут в ближайшем будущем объектом искусственного разведения) имеет в жизненном цикле много общего с колюшковыми, есть основания надеяться, что результаты экспериментальных исследований механизмов миграций, осморегуляции и диапазона соленостной толерантности колюшек помогут в изучении этих рыб.
Редкая способность морской формы трехиглой колюшки размножаться как в пресной, так и в морской воде высокой солености также заслуживает пристального внимания. Дело в том, что число видов животных, живущих и (что самое главное!) размножающихся с равным успехом в морских и пресных водах, очень невелико. Даже у проходных и эвригалинных организмов размножение и раннее развитие протекают всегда в более узком экологическом спектре, чем жизнь взрослых особей: либо в море, либо в пресной воде (Хлебович, 1974). В характере солеустойчивости половых клеток различныху видов животных наблюдается универсальность: у морских видов выживаемость и оплодотворяющая способность гамет резко сокращаются ниже соленостной границы 5—8 ‰ (разделяющей морскую и пресноводную фауны), у пресноводных и анадромных проходных видов — выше этой соленостной границы (Хлебович, 1974).
Это положение подтверждается имеющимися в литературе данными об активации и жизнеспособности сперматозоидов морских эвригалинных рыб. Например, спермии камбалы Limanda schrenki, бычка Gillichthys, дальневосточной сельди Clupea harengus pallasi, подвижные в морской воде широкого диапазона солености, ингибируются при 4—6 ‰ (Хлебович, 1974). Обратная картина наблюдается у рыб, размножающихся в пресной воде. Как видно из сводок Гинзбург (1968), Турдакова (1972), Хлебовича (1974), для всех изученных пресноводных рыб предельной для активации спермиев является соленость 7—15 ‰. На основании подобных данных складывается представление, что в физиологическом отношении спермии всех животных — морских, пресноводных и наземных — эквивалентны пойкилоосмотическим организмам (осмоконформерам) и лишены осморегуляторных механизмов (Хлебович, 1974). Другие авторы полагают, что спермии водных животных по характеру осморегуляции-принципиально не отличаются от всех других клеток, т. е. ведут себя как «натриевый насос» (Дорошев, 1967).
Способность морской формы трехиглой колюшки преодолевать этот соленостный барьер при размножении, а также способность ее спермиев активироваться одновременно и ниже, и выше барьера в 5—8 ‰ позволяют поставить вопрос: не имеется ли у сперматозоидов колюшки формы trachurus каких-то принципиально иных механизмов, способных поддерживать ионный гомеостаз в воде с резко различающейся соленостью?
Несомненно, разрешение этого вопроса имело бы большое значение для соответствующих разделов физиологии и мембранной биологии. Удобно то, что здесь имеется естественный контроль — спермии leiurus, ведущие себя как типичные «пресноводные» спермии. Возможно, спермии trachurus отличаются структурно от спермиев leiurus лишь несколькими мутациями ионной проницаемости (повышенной солерезистентности) плазматической мембраны. Такие мутации известны, например, у пресноводных инфузорий Paramecium aurelia, и они экспериментально индуцированы посредством мутагена нитрозогуанидина (Kung, 1971).
Учитывая неуклонное повышение солености ряда крупных внутренних водоемов СССР (Азовского, Аральского, Каспийского морей и других) из-за зарегулирования стока и связанное с этим сокращение численности многих стеногалинных хозяйственно ценных видов животных, индуцирование подобных мутаций у половых клеток пресноводных животных может иметь важное хозяйственное значение в будущем.
2.8. РАЗМНОЖЕНИЕ
Наряду с исследованиями морфологической изменчивости «защитных структур» (колючки, тазовый пояс, боковые костные пластины) колюшковых рыб, а также их эвригалинности изучение репродуктивного поведения колюшковых привлекает наибольшее внимание биологов. По авторитетному мнению Вуттона, репродуктивное поведение трехиглой колюшки привлекло внимание этологов больше, чем таковое любого другого вида рыб мировой фауны: «Экспериментальные исследования репродуктивного поведения сформировали один из краеугольных камней в развитии этологической теории и революционизировали науку о поведении животных» (Wootton, 1976, с. 104).
Территориальное, гнездостроительное поведение самца, а также его агрессивность к вторженцам и забота о потомстве успешно компенсируют относительно невысокую плодовитость самки даже при условии, что она нерестится несколько раз в сезон размножения.
На протяжении всего времени нереста поведение самца характеризуется устойчивой территориальностью (привязанностью к одному месту, которое самец сам выбирает и определяет границы своих «владений») и агрессивностью по отношению к любому вторженцу (кроме готовой к нересту конспецифичной самки во время фазы ухаживания). Репродуктивное поведение самца состоит из нескольких фаз, которые следуют за «прибытием» на нерестовые площади. В общей сложности выделяют три такие фазы (Van Iersel, 1953, 1958): 1) гнездостроительную — характеризуется выбором места для гнезда, началом территориального поведения и постройкой гнезда; 2) сексуальную (или фазу ухаживания) — во время нее самец активно ухаживает за самкой, что заканчивается оплодотворением; 3) родительскую (или фазу заботы о потомстве) — в этот период самец охраняет и вентилирует гнездо с кладкой икры, а затем заботится о вылупившейся молоди.
2.8.1. ГНЕЗДОСТРОИТЕЛЬНАЯ ФАЗА
Из всех родов колюшковых только Gasterosteus строит гнездо на грунте, остальные (Pungitius, Culaea, Apeltes, Spinachia) строят гнезда над грунтом среди водных растений. Исключением являются две североамериканские популяции Pungitius pungitius (McKenzie, Keenleyside, 1970; Griswold, Smith, 1972, 1973). Точное и сжатое описание постройки гнезда трехиглой колюшки дает Сабанеев (1982, с. 100—101): «За несколько дней до нереста самец трехиглой колюшки выбирает себе место на грунте и выкапывает ямку в нем. Вырыв ямку, самец набирает в рот мелких травинок или иного растительного материала и выстилает этим материалом дно ямки, закрепляя и склеивая слизью этот материал. Затем воздвигаются боковые стены гнезда, наконец свод. После этого он приводит свое гнездо в порядок, придает ему более правильную форму, вытаскивает лишнее, расширяет переднее отверстие, выглаживает края его и вместе с тем старательно отгоняет насекомых и других рыб. Готовое гнездо имеет форму шара или почти шара и очень красиво, но у трехиглой колюшки большая часть его зарыта в ил, поэтому оно незаметно; только иногда, и то в мелкой светлой воде, можно различить небольшие возвышения до 10 см в диаметре». Это, так сказать, описание типичного гнездостроения, которое несомненно подвержено географической и средовой изменчивости внутри каждой формы Gasterosteus aculeatus. Например, по данным Хагена (Hagen, 1967), в р. Литтл Кэмпбел (Британская Колумбия, Канада) жилая leiurus предпочитает для постройки гнезда стоячую воду, мелководье (глубина 20 см), илистый грунт и растительное окружение, a trachurus — течение, стрежень ручья, глубину 50 см и песчаный грунт. Это было выявлено Хагеном (Hagen, 1967) наблюдениями в природе и аквариумными экспериментами. В аквариуме самцы могут строить гнезда из растительного материала на голом стеклянном дне (личные наблюдениям автора) или даже без наличия растительного материала на песчаном дне из песка, при этом самцы успешно стимулировали самок к откладке икры в такие гнезда (А. В. Голубев, личн. сообщ.). Постройку гнезд из песка в природе наблюдал Врат (Vrat, 1949) в Калифорнии и Смирнов (1951) в бассейне Азовского моря. Обычно в природе гнезда строятся на мелководье менее 1 м глубиной. Вуттон (Wootton, 1972) описывает курьезный случай, когда в одной из рек Юго-Западной Англии он обнаружил одно гнездо leiurus внутри консервной банки, а другое внутри молочной бутылки!
Для нереста трехиглая колюшка выбирает наиболее мелководную зону водоемов. Гнезда расположены начиная с глубины 2—3 см и до 1.5 м, но основная масса гнезд располагается на глубине 25—50 см. Характерная особенность нерестовых биотопов — наличие укрытий (камни, коряги и г. д.). Например, на Белом и Черном морях нерестилища Gasterosteus aculeatus характеризовались именно такими условиями, а на Балтике и Охотоморском побережье о. Сахалин (в лагунах) нерест происходил на полностью открытых участках дна. Часто нерестилища были отделены от остальных частей водоема естественной преградой — грядой камней, мелководьем, густыми зарослями тростника (личные наблюдения автора).
Гомелюк (1978), исследовавший нерестилища в бассейне Белого, Балтийского и Черного морей, выделяет следующие их общие особенности: 1) мелководья с прогретой, относительно прозрачной водой; 2) наличие разного рода преград, отделяющих эти участки от остальных зон водоема; 3) относительно низкое содержание кислорода на нерестилищах; 4) пониженная плотность других рыб и хищных беспозвоночных (личинок стрекоз, жуков-плавунцов, гладышей, пиявок и других); 5) мягкие грунты; 6) наличие отмершей растительности (материал для постройки гнезд); 7) богатая кормовая база в виде планктона и бентоса.
При этом он выделяет три основных типа нерестилищ, различающихся между собой: а) эстуарий реки, впадающей в море, вода распреснена; б) литоральная зона моря с грядами камней и колебанием солености вследствие приливного цикла; в) прибрежная зона ручьев и озер. Отсюда ясно, что не все 7 особенностей характеризуют нерестилища колюшки, а наблюдается большое разнообразие сочетаний разных условий на нерестилищах. Соленость воды на нерестилищах, по данным Гомелюка (1978), может колебаться от пресной воды до 20 ‰, но не выше. Повышение солености до 22—24 ‰ в литоральной зоне зал. Левин Наволок (губа Чупа, Кандалакшский залив Белого моря) привело к прекращению существования нерестовой колонии. Этот автор, в частности, связывает уменьшение численности трехиглой колюшки Белого моря с сокращением площадей, пригодных для нереста, вследствие обмеления рек и пересыхания ручьев, впадающих в море, что приводит к возрастанию солености на нерестилищах. Его гипотеза о зарегулировании стока рек не подтверждена фактическими данными, и я сомневаюсь, чтобы именно пересыхание ручьев в течение 1972—1974 гг. (жаркие годы), как указывает В. Е. Гомелюк, явилось причиной устойчивого падения в течение 10 лет численности колюшки Белого моря.
Выбор мест для гнезд имеет важное значение, от него подчас зависит весь успех размножения. Если потребностям самок удовлетворяют лишь прогретость воды и наличие корма, то самцы более «разборчивы». Например, самцы предпочитают еще и наличие отмершей растительности — материал для гнездования; они склонны также располагать гнезда в укрытиях и т. д. Однако, как будет ясно из дальнейшего изложения, наблюдается большая изменчивость по этому признаку. Имеются экспериментальные данные о том, что на скорость постройки гнезда трехиглой колюшки положительно влияет наличие растительности (Schutz, Tschanz, 1971) и присутствие самок (Wunder, 1930; Reisman, 1968а), а наличие конспецифичных самцов имеет более сложное влияние: положительное в начале нереста и отрицательное в его разгаре (Van den Assem, 1967). Последний автор отмечает также, что высокую плотность посадки самцов колюшки в аквариуме можно использовать как методический прием для замедления скорости созревания рыб. Однако, по моим наблюдениям, в аквариумах это может привести к травмированию «психики» большинства самцов, вплоть до появления на теле у них сапролегнии и их гибели, поскольку среди самцов всегда находится один более агрессивный, доминантный самец, который «терроризирует» остальных укусами и толчками.
Есть доказательства гормональной регуляции гнездостроительного поведения. Кастрирование самца, уже почти построившего гнездо, вызывает прекращение гнездостроительной деятельности, но последующая инъекция ему тестостерона (гормона из группы андрогенов, продуцируемого семенниками) стимулирует его дальнейшую гнездостроительную активность. Даже кастрированные самки, инъецированные тестостероном, пытались строить гнезда, но не смогли их закончить (Wai, Hoar, 1963).
Весь процесс постройки гнезда состоит из 8 последовательных элементов, осуществление которых приводит к завершению постройки гнезда в среднем за период 5—6 ч (пределы колебания 4 ч—3 сут) (Van Iersel, 1953): 1) копание (digging) — самец в позе «голова вниз» берет кусок грунта со дна, отплывает в сторону и выплевывает его; 2) тестирование материала — повторные роющие всасывания и выплевывание материала изо рта; 3) ношение материала в гнездовую яму; 4) уплотнение материала толчками головы (pushing); 5) склеивание (glueing) — материал склеивается слизью, продуцируемой почками и выделяемой из мочеполового отверстия, самец поливает поверхность гнезда, придавливая его сверху телом; 6) сверление (boring) — самец высверливает вход в гнездо и тоннель внутри гнезда; 7) вентиляция гнезда (fanning) — при помощи грудных плавников самец гонит токи воды через гнездо (этот элемент, характерен больше всего для родительской фазы, но имеет место также и в гнездостроительной и сексуальной фазах); 8) проползание через гнездо (creeping through) — самец пробивает выход с задней стороны гнезда, проползая через ранее сделанный тоннель. Последний элемент означает конец гнездостроительной фазы и начало сексуальной фазы (Van Iersel, 1953). Диаметр шарообразного гнезда Gasterosteus aculeatus обычно не превышает 5—6 см (Leiner, 1929).
С начала гнездостроительной фазы наблюдается возрастание агрессивности самца. Он защищает свое гнездо от самок и самцов своего вида, других рыб и водных насекомых. Обычно самец атакует стремительным прямым броском, и если вторженец не обращается в бегство, самец кусает его или, схватив рыбу за хвостовой стебель, оттаскивает ее за пределы охраняемой территории (Van Iersel, 1953). Во время территориальных стычек с конспецифичными партнерами колючки не используются как оружие по своему прямому назначению (уколы), выпрямление колючек имеет сигнальное значение для конкурентов (Tinbergen, 1951). Колючки как защита используются только против хищников (Hoogland et al., 1957). Более подробно об агрессивном поведении самцов колюшковых будет сказано в разделе 2.8.3.
Гнездостроительное поведение Gasterosteus wheatlandi сходно с таковым Gasterosteus aculeatus (Reisman, 1968b; Mclnerney, 1969).
Самец Pungitius строит гнездо в отличие от Gasterosteus над грунтом среди растительности, чаще на расстоянии 10—15 см от грунта (хотя эта высота может колебаться от 2 до 20 см). Гнездо имеет сферическую форму, диаметр его 4—5 см. Как и у Gasterosteus aculeatus, гнездо имеет вход, выход и полный туннель, последний обычно имеет наклон, так что вход располагается ниже, чем выход (Leiner, 1931b; Morris, 1958) (рис. 17). Самец выбирает место для гнезда на мелководье, в стоячей, густо заросшей растительностью воде и начинает прикреплять строительный материал гнезда (обычно нити Spirogyra, Fontinalis, Nitella) на ветвях или на листьях водных укореняющихся растений. Поскольку гнезда строятся не на грунте, то и «репертуар» гнездостроительного поведения Pungitius отличается от Gasterosteus. Так, у Pungitius отсутствует элемент «копание грунта», который заменен элементом «расчистка места для гнезда среди растений». Кроме элемента «поверхностное склеивание» у Pungitius появляется дополнительный элемент «вставочное склеивание» (insertion glueing), при котором самец ловит ртом струю клея из клоаки (изгибаясь всем телом) и заталкивает эту «нить» клея внутрь гнезда. Вставочное склеивание появляется к концу гнездостроительной фазы и продолжается 1—2 дня после оплодотворения икры, его функция — цементирование внутренней поверхности гнезда, так как оно не скреплено грунтом снаружи, как у Gasterosteus. Кроме того, есть опасность выпадения икры из гнезда, и поэтому икра нуждается в дополнительном укреплении в гнезде. Все остальное элементы гнездостроительной фазы сходны с таковыми Gasterosteus (Morris, 1958).
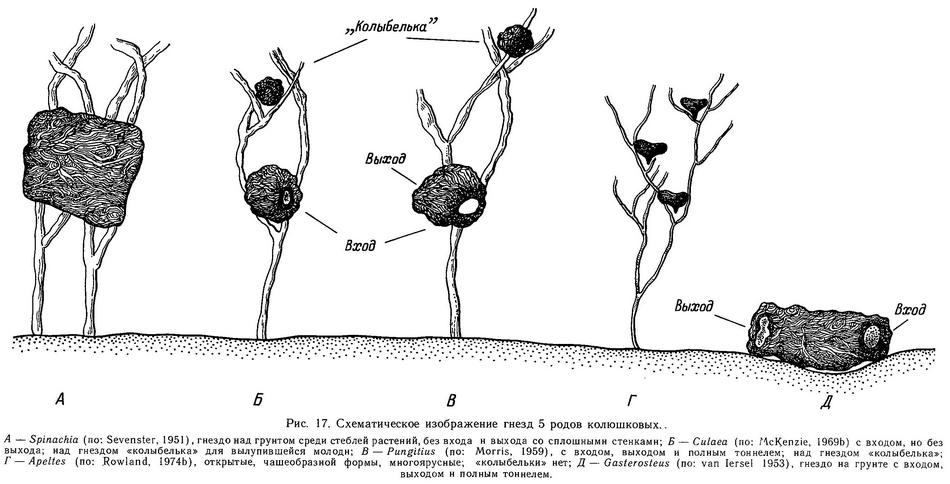
Описана популяция Pungitius pungitius в оз. Гурон (США), где нет укореняющихся растений в литоральной зоне (Gasterosteus aculeatus отсутствует) и самцы строят гнезда на грунте в расщелинах между камней. Кроме того, у гуронских самцов отсутствует элемент «поверхностное склеивание». Возможно, изменения в гнездостроительном поведении колюшек из оз. Гурон необратимы и генетически закреплены, так как в эксперименте при наличии выбора (когда самцам предлагались и укореняющиеся растения на песке, и каменный субстрат) они строили гнезда на грунте (McKenzie, Keenleyside, 1970). Самцы Pungitius pungitius из оз. Верхнее, пойманные в природе с илистого субстрата, где не было укореняющихся растений, а только слой водорослей (Nitella), также строили гнезда в аквариуме на грунте (Griswold, Smith, 1972, 1973).
Интересно, что интродукция 40 (20 самцов + 20 самок) основателей Pungitius pungitius из р. Сходня (Московская обл.), где самцы строят гнезда среди растений, в водоем, лишенный укореняющихся растений (карьер на побережье Белого моря), привела к тому, что самцы свободно перешли к постройке гнезд на грунте среди расщелин камней, как и в оз. Гурон. Обратное вселение самцов из карьера в водоем, имеющий растительность, привело к тому, что самцы снова стали строить гнезда среди растений. Это предполагает пластичность гнездостроительного поведения любой популяции Pungitius pungitius и приводит к заключению, что норма реакции по признаку «выбор субстрата для гнезда» весьма широка (Зюганов, 1986). Если нет привычного субстрата (растений), то в необычных условиях популяция перестраивается на «эксплуатацию» другого нерестового субстрата. Вуттон (Wootton, 1976) также полагает, что тип гнездостроительного поведения Pungitius — относительно пластичный признак, но приходит к выводу, что этот «тип» зависит от условий, в которых популяция эволюировала. Однако наши данные показывают, что это совсем не обязательно, и даже популяция, долгое время обитающая в «типичных» условиях, при попадании в необычные условия среды может изменить тип гнездостроительного поведения.
Гнездостроительное поведение самцов Culaea inconstans близко таковому Pungitius. Гнездо строится над грунтом среди растений, хотя в среднем оно ближе к грунту, чем у Pungitius, — на высоте 5—10 см. В отличие от Pungitius гнездо Culaea inconstans прикрепляется не к ветвям или листьям, а к главному стеблю или в развилке стебля (Reisman, Cade, 1967). Состоящее из нитей водорослей или иного растительного материала сферической формы гнездо Culaea inconstans имеет диаметр 1.5—3 см (Winn, 1960) — меньший, чем у Pungitius и Gasterosteus.
После выбора места для гнезда самец Culaea в отличие от Gasterosteus и Pungitius вначале откладывает на выбранное место клубок нитей клея, а уже затем приносится растительный материал и склеивается самцом. У Culaea, как и у Pungitius, имеется и поверхностное, и вставочное склеивание. В остальном все элементы гнездостроительного поведения Culaea сходны с Gasterosteus и Pungitius. У законченного гнезда Culaea нет полного туннеля и выхода из гнезда (Smith, 1970), в противоположность Gasterosteus и Pungitius. Лишь у Pungitius из оз. Гурон (США) некоторые гнезда не имели выхода, и в этом случае при нересте самка и самец покидали гнездо через вход (McKenzie, Keenleyside, 1970). Последнее отличие гнездостроительной фазы Culaea от двух других родов состоит в отсутствии элемента «проползание через гнездо», завершающего у Gasterosteus и Pungitius гнездостроительную фазу (Reisman, Cade, 1967).
Хотя большинство элементов гнездостроительной фазы Apeltes quadracus сходно с таковыми Gasterosteus, Pungitius, Culaea (выбор места для гнезда, тестирование, ношение, уплотнение и склеивание гнездового материала), Apeltes обладает уникальным «рисунком» гнездостроительного поведения. Вследствие того что гнездо Apeltes открытое и имеет чашевидную форму, у самца отсутствуют элементы «сверление гнезда» и «проползание через гнездо», а «вентиляция гнезда посредством движения грудных плавников» заменена элементом sucking — всасывание. Самец «втыкает» рыло в дырку в нижней части гнезда, серией глотательных движений втягивает воду в открытый рот и выталкивает воду через жаберные щели (Rowland, 1974; Hall, 1956, — цит. по: Wootton, 1976). Адаптивное значение замены вентиляции гнезда с помощью движений грудных плавников вентиляцией с помощью всасывательных движений рта состоит в том, что в открытом гнезде Apeltes икра выметывалась бы от сильных струй воды, нагнетаемых вибрацией грудных плавников (Hall, 1956,— цит. по: Wootton, 1976).
Самец Apeltes прикрепляет гнездо к стеблю или ветвям водных растений над грунтом на высоте 2—25 см. Гнездо очень маленькое и не превышает 0.5 см в диаметре. Интересная особенность репродуктивного поведения Apeltes, отличающая его от всех остальных родов колюшковых, состоит в том, что самец, не закончив выведения икры в одной кладке, может строить на том же стебле второе гнездо, третье и т. д., что в итоге приводит к многоярусному построению гнезд (Rowland, 1974). В отличие от Pungitius и Culaea Apeltes не строят «колыбельку» — сооружение из растительного материала (обычно над гнездом), где некоторое время проводит только что вылупившаяся молодь (Hall, 1956, — цит. по: Wootton, 1976). Элемент «склеивание» у Apeltes также уникален: самец, выпуская клей, совершает вращательные движения телом, причем осью вращения является воткнутая в центр гнезда брюшная колючка Apeltes (Rowland, 1974).
Гнездостроительное поведение самца Spinachia spinachia также уникально. После выбора места для гнезда среди морских зарослей водорослей Halydris или Fucus и расчистки места для гнезда самец начинает откладывать нити клея. Нити толщиной 0.1 мм кладутся сначала параллельно, затем перпендикулярно, так что из нитей клея для гнезда образуется некая «сеть»; лишь после этого самец приносит материал, который рвется им на части и всовывается в сетку клея. Затем элементы «склеивание» и «ношение материала» повторяются несколько раз. Продолжительность каждого периода «склеивания» — до 15 мин, что превышает аналогичный показатель любого другого рода колюшковых. Толчками рыла самец уплотняет сферическую массу материала.
Гнездо Spinachia полое внутри, но лишено отчетливого входа и выхода, так что при нересте самка сама протыкает рылом вход в гнездо. Самец не всегда входит в гнездо в том же направлении, что и самка, а может пересечь ее путь перпендикулярно. Сферической формы гнездо имеет диаметр 5—8 см, так что Spinachia строит самые крупные гнезда среди колюшковых (Leiner, 1934; Sevenster, 1951). В конце гнездостроительной фазы у самца присутствует элемент «фаннинг» (вентиляция с помощью грудных плавников») (Sevenster, 1951).
Таким образом, хотя в целом по большинству элементов гнездостроительного поведения наиболее сходны Gasterosteus, Pungitius, Culaea (Wootton, 1976), на основании более подробного сравнения гнездостроительного поведения самцов, архитектуры гнезда и его пространственного расположения у разных видов колюшковых роды Gasterosteus, Pungitius, Culaea, Apeltes, Spinachia можно объединять в группы по-разному. Например, из всех родов выделяется Gasterosteus, «ушедший» из растительной зоны и строящий гнезда на грунте. Вуттон (Wootton, 1976) полагает, что это следствие эффективных морфологических противохищнических адаптаций Gasterosteus aculeatus. Действительно, в отличие от других родов колюшковых, имеющих криптическую («маскирующую») брачную окраску (см. раздел 1.4), у Gasterosteus aculeatus отмечается демаскирующая брачная окраска (красное брюхо, голубые глаза) и наличие поведенческого элемента «boldness» (буквально: смелость, нахальство, дерзость), т. е. особи Gasterosteus aculeatus ближе всего могут подпускать к себе хищников, перед тем как обратиться в бегство, по сравнению с колюшками других родов (Hoogland et al., 1957). Gasterosteus также проявляют наибольший уровень агрессивности в репродуктивном поведении (Huntingford, 1977, 1981). С другой стороны, по признакам «вентиляция гнезда с помощью всасывания», «открытое гнездо», «многоярусность гнезд» выделяется Apeltes из всех остальных родов. По признаку «сплошное цельное полое гнездо без входа и выхода» выделяется Spinachia. Apeltes, Culaea, Spinachia объединяются по признаку «откладывание клея предшествует сбору растительного материала для гнезда», соответственно Gasterosteus и Pungitius объединяются по альтернативному варианту этого признака, а также по наличию только у них полного тоннеля в гнезде. По признакам «наличие колыбельки» и «наличие вставочного склеивания» объединяются Pungitius и Culaea. Таким образом, налицо мозаичность эволюции гнездостроительного поведения в разных родах колюшковых. Какие из этих группировок обусловлены сходством условий (сходством экологических ниш при нересте), а какие генетическим родством, остается загадкой. К сожалению, не проясняет вопроса и сравнение гнездостроения колюшек с их менее специализированными (Nelson, 1971а) ближайшими родственниками — представителями сем. Aulorhynchidae. Один из этих представителей — Aulorhynchus flavidus откладывает икру, охраняемую самцом, в сетку клея, продуцируемого самцом на морских растениях (Limbauch, 1962), что похоже на Spinachia, и делает многоярусные кладки (похоже на Apeltes), но другой представитель — Aulichthys japonicus откладывает икру в перибранхиальную полость асцидии Cynthia roretzi (Uchida, 1934), что не имеет никаких параллелей с колюшковыми.
Во время гнездостроительной фазы самки всех родов колюшковых не принимают никакого участия в строительстве гнезда и проводят время, откармливаясь на нерестовых площадях, неподалеку от территориальных самцов. Зрелая самка приближается к гнезду, если видит самца, выполняющего заключительные элементы гнездостроительной фазы: проползание через гнездо и вентиляцию гнезда (Tinbergen, 1951; Wootton, 1976).
2.8.2. СЕКСУАЛЬНАЯ ФАЗА
Лучше всего эта фаза изучена у Gasterosteus aculeatus, поэтому вначале будет более подробно описана фаза ухаживания у трехиглой колюшки и затем будут приведены отличия других родов колюшковых от Gasterosteus.
Тинберген (Tinbergen, 1953) полагает, что ухаживание имеет три важнейшие функции в размножении колюшки: 1) синхронизация половой активности самца и самки — первый «ухаживательный» элемент поведения самца, своеобразный «зигзаг»-танец демонстрирует самке начало половой фазы; 2) ориентирующая функция — совершая акты ухаживания, самец ведет самку к гнезду и показывает вход в него, что обеспечивает откладывание икры в должном месте; 3) функция репродуктивной изоляции — поскольку «репертуар» ухаживания у колюшек видоспецифичен. Действительно, ареалы разных родов и видов колюшковых пространственно в значительной мере перекрываются, перекрываются часто и их нерестовые биотопы. Тем не менее в природе никогда не обнаруживались межродовые гибриды, хотя в эксперименте их можно легко получить искусственным оплодотворением (Leiner, 1934, 1940; Kobayashi, 1962). Более подробная информация о межродовой и межвидовой репродуктивной изоляции дана ниже в этом разделе и в разделе 4.5.6. Севенстер (Sevenster, 1961) и Вилц (Wilz, 1972) предполагают, что еще одной функцией ухаживания является гомеостатическая, поскольку у самца трехиглой колюшки и при половой фазе имеется агрессивная тенденция в поведении даже по отношению к зрелой самке. Выполнение элементов ухаживания приводит самца в должное мотивационное состояние.
В принципе брачная игра половых партнеров состоит из 10 элементов: 5 элементов, выполняемых самцом, и 5 — выполняемых самкой. Временная организация ухаживания трактуется Тинбергеном (Tinbergen, 1951) как цепная реакция: каждый акт поведения одного партнера служит стимулом, побуждающим ответ другого партнера (рис. 18, 19).

Только после заключительного элемента гнездостроительной фазы «проползание через гнездо» самец может положительно реагировать на самку, до этого самка вызывает у него лишь агрессивный ответ (Sevenster, 1961). При появлении поблизости самки самец двигается к ней, исполняя «зигзаг»-танец — серия прыжков как бы к самке и от нее. Каждый скачок от самки символизирует желание вести самку к гнезду, а каждый скачок к самке — атаковать ее. «Зигзаг»-танец — чередование агрессивных и сексуальных тенденций (Sevenster, 1961). При танце рот самца открыт и колючки выпрямлены (Tinbergen, 1953). Зрелая самка на этот танец отвечает позой «головой вверх». Самец прямым движением плывет к гнезду, увлекая за собой самку. Самка следует за ним. Самец показывает вход в гнездо: ложась набок, он всовывает рыло в отверстие гнезда и двигается телом вперед-назад. Самка входит в гнездо. Самец «трясет», «тормошит» ее, быстро толкаясь рылом в бока тела и хвостовой стебель самки. Только после этого самка выметывает икру. Затем самец проникает в гнездо и осеменяет икру. Вслед за выметом икры самка немедленно изгоняется самцом с гнездового участка (Tinbergen, 1951).
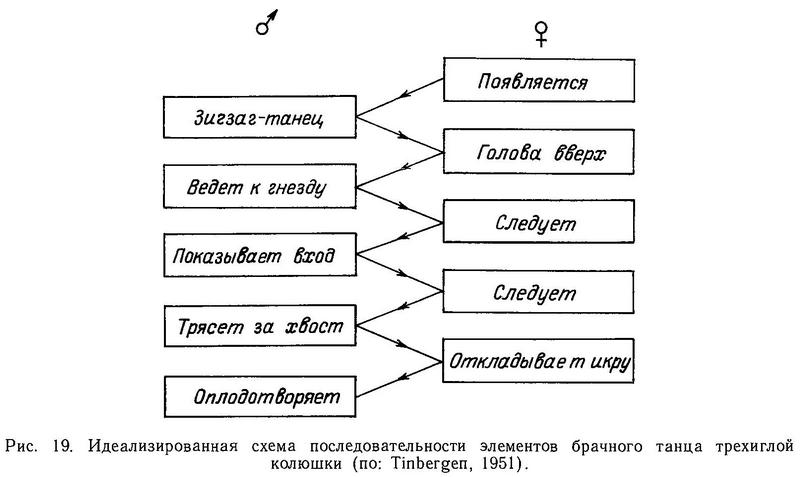
Это типичная, или идеализированная, схема брачного танца трехиглой колюшки, хотя в некоторых случаях ухаживание следует точно этой схеме (Tinbergeh, 1951). Иногда некоторые элементы ухаживания могут быть повторены дважды (Morris, 1958), но чаще имеет место «встраивание» дополнительного цикла бессмысленных, с функциональной точки зрения, элементов (Ter Pelkwijk, Tinbergen, 1936), характерное только для трехиглой колюшки.
После «зигзаг»-танца вместо выполнения элемента «ведение к гнезду» самец принимает позу «dorsal pricking» (буквально: спинное накалывание), подплывает снизу к самке, колючки его распрямлены, будто он хочет проколоть брюхо самки. В этой позе пара плавает по кругу (circling). Затем самец плывет к гнезду, но если самка следует за ним, он возобновляет «dorsal pricking» или прогоняет самку от гнезда, кусая ее. При возвращении в одиночестве к гнезду, самец начинает «сверлить» вход в гнездо, проползает через него, вентилирует его и откладывает на гнездо клей — т. е. выполняет типичные элементы «гнездостроительной» и «родительской» фаз, не совсем уместные в сексуальной фазе, поскольку эти элементы отпугивают самку. Только после завершения этого цикла самец возобновляет ухаживание за самкой, заново начиная «зигзаг»-танец (Ter Pelkwijk, Tinbergen, 1936).
Есть два объяснения функции этого дополнительного цикла. Так, Мак-Фарлэнд (McFarland, 1974) полагает, что «визиты» самца к гнезду и гнездостроительная активность во время фазы ухаживания служат лучшему сохранению гнезда в надлежащем виде для посещения его самкой. Однако отсутствие этого дополнительного цикла у других видов колюшковых (менее агрессивных, чем Gasterosteus aculeatus) делает предпочтительным другое объяснение. Вилц (Wilz, 1970а, 1970b, 1970с) считает, что гнездовая активность во время ухаживания помогает переключиться от относительно агрессивного состояния (необходимого для охраны территории) к относительно сексуальному состоянию (необходимому для успешного спаривания). Заметим, что обе гипотезы не взаимоисключающие. Понятно, что более агрессивный самец может охранять большую территорию и успешнее выведет кладку, чем менее агрессивный, но агрессивность и сексуальность взаимно ингибируемы у колюшек (Wilz, 1972), поэтому наличие дополнительного цикла (несколько затрудняющего и увеличивающего продолжительность спаривания) есть «плата» за высокий уровень агрессивности, эволюционно выработавшийся у Gasterosteus вследствие удачных морфологических противохищнических адаптаций. Физиологические эксперименты показали решающую роль гормональной регуляции брачного поведения. Так, кастрированные после гнездостроительной фазы самцы обнаружили постепенное падение уровня сексуальной активности, но если их обрабатывали тестостероном, сексуальное поведение полностью восстанавливалось, однако только при длинном световом дне, но не при коротком. Кастрированные, но инъецированные тестостероном самцы иногда строили гнезда (правда, без туннеля) и даже выполняли элементы «склеивание» и «вентиляция гнезда», но не обнаруживали элементов «зигзаг»-танец и «ведение к гнезду» при появлении нормальной зрелой самки (Wai, Hoar, 1963). Изменчивость структуры сексуального поведения как основы репродуктивной изоляции между разными формами Gasterosteus aculeatus будет рассмотрена в разделе 4.5.5.
Сексуальное поведение Gasterosteus wheatlandi в принципе сходно с Gasterosteus aculeatus (состоит из тех же элементов), но выполнение самих элементов иное, что неудивительно, поскольку оба вида симпатричны на Атлантическом побережье Сев. Америки и между ними неминуемо должна была выработаться прекопуляционная репродуктивная изоляция.
При выполнении «зигзаг»-танца самец Gasterosteus wheatlandi приближается к самке с головой, опущенной вниз, под углом к горизонтали примерно 30°, в то время как Gasterosteus aculeatus располагает тело горизонтально. Самка, правда, отвечает позой «голова вверх», аналогичной таковой у Gasterosteus aculeatus. Далее, при ведении к гнезду, самец сохраняет позицию «головой вниз», плывет не прямо и быстро, как Gasterosteus aculeatus, а медленно, близко к грунту и извилистым маршрутом, причем непрерывно «трепещет», брюшная поверхность у самца при этом вогнута. Самка, располагаясь ниже самца, следует за ним, сохраняя позу «головой вверх» и подталкивает его головой в брюхо, в то время как у Gasterosteus aculeatus самка плывет к гнезду позади самца, и тело ее находится в горизонтальном положении (Reisman, 1968b; Mclnerney, 1.969). У Gasterosteus wheatlandi отсутствуют элемент «dorsal pricking» и дополнительный цикл гнездостроительной активности во время ухаживания. Дальнейшие элементы спаривания у Gasterosteus aculeatus и Gasterosteus wheatlandi совпадают. Тем не менее и этих различий в элементах ухаживания достаточно для 100%-ной репродуктивной изоляции.
Несмотря на то что в тестах по предпочтению самцы и Gasterosteus aculeatus, и Gasterosteus wheatlandi равновероятно ухаживают за самками обоих видов, самки отвечают на ухаживания только конспецифичного самца. Так, самка Gasterosteus aculeatus не следует за самцом Gasterosteus wheatlandi, когда в начале акта «ведение к гнезду» он принимает позу «головой вниз», а самка Gasterosteus wheatlandi прекращает следовать за самцом Gasterosteus aculeatus, когда он быстро и прямо ведет ее к гнезду (Reisman, 1968b). Играют роль и различия в брачной окраске: вместо ярко-красного брюха самца Gasterosteus aculeatus у Gasterosteus wheatlandi зеленовато-желтый цвет тела с серией черных пятен позади оранжевых брюшных колючек (Mclnerney, 1969).
Сексуальная фаза Pungitius pungitius (как и у Gasterosteus) начинается только после завершения последнего элемента гнездостроительной фазы «проползание через гнездо». Сексуальное поведение Pungitius pungitius состоит из тех же элементов, что и у Gasterosteus aculeatus, но выполнение 3 (из 5) элементов иное. Так, при «зигзаг»-танце самец находится в позиции «головой вниз», что сходно с Gasterosteus wheatlandi более, чем с Gasterosteus aculeatus. В «зигзаг»-танце самец скачет вперед и одновременно вбок и вверх. Поза самки «головой вверх» аналогична таковой Gasterosteus aculeatus. Элемент самца «ведение к гнезду» опять же ближе таковому Gasterosteus wheatlandi — самец плывет медленно и по извилистой линии. Самка следует за ним в позе «головой вверх» (как и самка Gasterosteus wheatlandi), касаясь рылом брюха самца, причем угольно черное тело и выпрямленные ярко-белые брюшные колючки самца служат самке хорошим ориентиром в густых зарослях. Партнеры во время «ведения к гнезду» расположены ближе, чем у Gasterosteus aculeatus. На этом сходство с Gasterosteus wheatlandi заканчивается. При показе входа в гнездо самец помещает кончик рыла непосредственно над входом в гнездо, делает несколько глотательных движений и начинает вентиляцию гнезда грудными плавниками. Этот элемент по своей структуре не имеет ничего общего у Pungitius с Gasterosteus. Далее самка проникает в гнездо и самец «трясет» ее, как и у Gasterosteus. После вымета икры и покидания гнезда самкой самец проникает в гнездо и осеменяет икру, а затем прогоняет самку со своей территории (Leiner, 1931b; Morris, 1958). Самцы Pungitius значительно менее агрессивны, чем Gasterosteus aculeatus, у них отсутствуют также «dorsal pricking» и дополнительный цикл гнездовой активности во время фазы ухаживания (Wilz, 1971). В элементах ухаживания у Pungitius pungitius имеется межпопуляционная изменчивость. Так, у грунтогнездующих самцов в лишенном зарослевой зоны литорали оз. Гурон элемент «ведение к гнезду» выглядит как прямой бросок, т. е. аналогично таковому Gasterosteus aculeatus. Самка при этом следует за самцом не так близко, как у типичной Pungitius pungitius, в слабо выраженной позиции «голова вверх». У самцов не развивается угольно-черной брачной окраски, а на брюхе выражен лишь «серый лоскут». При показе входа в гнездо самке самец не вентилирует его, как типичный самец Pungitius pungitius (McKenzie, Keenleyside, 1970). Все это может привести к репродуктивной изоляции с остальными популяциями Pungitius.
Внутри рода Pungitius имеются и межвидовые различия в элементах ухаживания. Так, самцы Pungitius platygaster малой южной колюшки, чей образ жизни носит еще более скрытный, чем у Pungitius pungitius, зарослевый характер, отличаются от Pungitius pungitius менее броским рисунком «зигзаг»-танца и отсутствием характерных движений «твистинг», наблюдающихся у Pungitius pungitius при ведении самки к гнезду. («Твистинг» — резкие изгибания тела самца, стоящего на месте, побуждающие остановившуюся самку следовать за ним к гнезду). Нерест Pungitius platygaster носит более маскирующий, криптический характер, чем у Pungitius pungitius (у самок сохраняется камуфлирующая окраска, у самцов светлеет лишь задняя часть брюшных колючек, обращенная к самке во время ведения к гнезду). Нерест Pungitius platygaster имеет тенденцию к более быстрому завершению (самец подводит самку к гнезду в среднем за 10 с против 25 с у Pungitius pungitius) (Гомелюк, 1978). Впрочем, эти различия не означают, что между двумя видами выработалась репродуктивная изоляция: в эксперименте самки и Pungitius pungitius, и Pungitius platygaster равновероятно выбирали конспецифичных и «чужих» самцов; искусственно созданная в пруду гибридная популяция Pungitius pungitius х Pungitius platygaster существует в течение нескольких поколений, и гибриды плодовиты (Зюганов, Гомелюк, 1985). Видимо, дифференциация двух этих форм не дошла до видового уровня (подробнее этот вопрос будет рассмотрен в разделе 4.5.6).
На Дальнем Востоке, на островах Сахалин и Хоккайдо (Япония) симпатрично обитают 3 вида девятииглых колюшек рода Pungitius (Pungitius pungitius, Pungitius sinensis, Pungitius tymensis). Часто их нерестилища перекрываются; судя по редкости нахождения гибридов между ними в природе и легкости их гибридизации искусственным путем (вплоть до появления плодовитых гибридов — Kobayashi, 1957), между ними имеется строгая поведенческая репродуктивная изоляция в природе.
Фостер (Foster, 1977), используя тесты по предпочтению, в аквариумных условиях обнаружил, что 3 аллопатрические формы Pungitius pungitius (берингийская, миссисипская и европейская — Pungitius pungitius laevis) в значительной степени репродуктивно изолированы. Более подробно его данные будут обсуждены также в разделе 4.5.6.
Выше уже отмечалось, что, несмотря на возможность получения гибридов Gasterosteus aculeatus х Pungitius pungitius искусственным путем (Leiner, 1940, 1934; Kobayashi, 1962), в природе они не найдены (Wilz, 1970с), хотя оба вида живут буквально бок о бок во многих водоемах Европы, Восточной Азии и Сев. Америки, но предпочитают разные биотопы для нереста. В тестах по предпочтению самцы Gasterosteus aculeatus и Pungitius pungitius ухаживали за самками обоих видов равновероятно, но самки прерывали свое следование за самцом «чужого» вида на стадиях «ведение к гнезду» и «показ входа в гнездо» (Wilz, 1970с). К тому же гибриды первого поколения, полученные в лаборатории, имели повышенную смертность на ранних стадиях развития (Kobayashi, 1962), а выращенные до взрослого состояния были стерильны, и самцы не могли строить гнезда (Leiner, 1940).
Culaea inconstans. В отличие от Gasterosteus и Pungitius переход от гнездостроительной к сексуальной фазе у Culaea не маркирован «проползанием через» гнездо, так как у Culaea нет полного туннеля и выхода из гнезда. Сексуальное поведение самца Culaea, скорее, сходно с таковым Gasterosteus wheatlandi и Pungituis (хотя оно не менее агрессивно, чем у Gasterosteus), но содержат некоторые элементы, не характерные для Gasterosteus wheatlandi и Pungitius.
Так, при виде самки самец Culaea вместо «зигзаг»-танца медленно плывет к ней по прямой линии, выпрямив все колючки и быстро вибрируя грудными и хвостовыми плавниками. Находясь за 10—15 см на пути к ней, самец делает стремительный выпад и начинает «тузить» ее («pummeling»), нанося удары рылом в голову и бока тела самки. Самка в ответ оседает на дно. Второй элемент — «ведение к гнезду» — уникален для Culaea: самец медленно движется по извилистой линии, при этом хвост его опущен, и совершает латеральные биения; все колючки выпрямлены, рот открыт, спина выпукла. Самка следует за самцом, располагаясь несколько ниже его (как у Gasterosteus wheatlandi и Pungitius pungitius) . Показывая вход в гнездо, самец, подобно самцу Pungitius, помещает кончик рыла (рот открыт) над входом в гнездо и вентилирует гнездо грудными плавниками. После проникновения самки в гнездо самец «трясет» ее за бока, как и Gasterosteus, и Pungitius. Самка Culaea проводит намного больше времени в гнезде (7—9 мин), чем самка Gasterosteus и Pungitius (1—2 мин). Она покидает гнездо, взламывая заднюю стенку. Немедленно после этого самец проникает в гнездо и оплодотворяет икру (Reisman, Cade, 1967; McKenzie, 1969b). У Culaea нет элемента «dorsal pricking» (как у Gasterosteus), но есть дополнительный цикл «сверление» и «вентиляция гнезда», кроме того, наличие элемента «pummeling» (тужение) приближается Culaea к Gasterosteus по степени агрессивности (McKenzie, 1969b). Несомненно, характерное для Culaea приближение самца к самке, так же как «pummeling» и «ведение к гнезду», делает строгой репродуктивную изоляцию между Culaea и Pungitius pungitius, симпатричного с ней в Сев. Америке, несмотря на сходство их нерестовых биотопов и окраски самцов.
Apeltes quadracus. Переход от гнездостроительной к сексуальной фазе не отмечен «проползанием через гнездо» по причине своеобразной архитектуры гнезда, имеющей форму открытой чаши, так что сходство Apeltes и Culaea по этому элементу имеет, скорее, конвергентный характер. Хотя брачный танец Apeltes содержит все основные элементы, характерные для колюшковых в целом, разные элементы спаривания имеют сходство с соответствующими элементами разных родов колюшковых. Так, зрелая самка при вхождении на участок самца принимает позу «голова вверх», характерную для Gasterosteus, Pungitius, Culaea. Самец приближается к ней сходным с самцом Culaea образом и «тузит» ее. Как и у Culaea, самка после этого «тонет» на дно. Элемент «ведение к гнезду» уникален для Apeltes: самец выполняет «spiralling» спиральные или круговые движения телом, затем демонстрирует самке красные брюшные колючки и снова «тузит» ее. Так повторяется несколько раз на пути к гнезду. В итоге самка плывет за самцом только во время его пауз после завершения спирального танца. Самка, следуя за самцом, касается своим рылом брюха самца между брюшными колючками, как у Gasterosteus wheatlandi и Pungitius. Показ входа в гнездо также характерен только для Apeltes: самец «втыкает» рыло во вход гнезда и совершает несколько сильных ударов хвостом. Самка погружается в чашу гнезда брюхом, но голову держит выше, чем хвост. В это время самец принимает горизонтальное положение под прямым углом к телу самки и покусывает несколько раз самку за хвостовой стебель. Этот элемент резко отличается от «тормошений» («quivering») Gasterosteus, Pungitius и Culaea на соответствующей стадии ухаживания. После вымета икры самка покидает гнездо и самец осеменяет икру, прогоняя затем самку (Reisman, 1963; Rowland, 1974). У Apeltes нет элемента «dorsal pricking», но есть дополнительный цикл гнездовой активности во время сексуальной фазы (склеивание, вентиляция), если самка не следует за самцом (Rowland, 1974). Выше уже отмечалось, что Apeltes уникален тем, что может вступать снова в сексуальную фазу, не успев вывести еще первую кладку, и так до 3—4 раз, так что на одном растении формируются многоярусные гнезда (Rowland, 1974). Хотя на Атлантическом побережье Сев. Америки Apeltes симпатричен с Gasterosteus aculeatus, Gasterosteus wheatlandi, Pungitius pungitius и часто имеет с ними общие нерестилища, гибриды между Apeltes и этими видами не отмечены (Blow, Hagen, 1984). Несомненно, уникальные элементы сексуального поведения Apeltes — «ведение к гнезду» и «показ входа в гнездо» — надежно изолируют этот вид от скрещиваний с близкими видами колюшковых.
Spinachia spinachia. У этого вида отсутствует элемент, переходный к сексуальной фазе — «проползание через гнездо». Сходство с Culaea и Apeltes здесь несомненно конвергентное, так как гнездо Spinachia вообще лишено входа и выхода. У Spinachia самый простой репертуар ухаживания. Самец, завидев самку, приближается к ней без всякого танца и начинает покусывать ее за хвостовой стебель и плавники или толкать ее рылом. Если самка отвечает на эту «атаку» и поворачивается к нему, а не убегает, самец плывет к гнезду по прямой линии. Затем он просовывает рыло в гнездо и дергает рылом из стороны в сторону, как бы расчищая вход, что не характерно для остальных родов колюшковых. Когда самка проникает в гнездо, самец, располагаясь горизонтально и под прямым углом к самке, начинает покусывать ее хвостовой стебель, что сходно с Apeltes на эквивалентной стадии ухаживания. После вымета икры самка покидает гнездо, а самец проникает в гнездо (часто в направлении, перпендикулярном по отношению к тому пути, по которому проникла туда самка). Осеменив икру, самец агрессивно прогоняет самку с охраняемого участка (Sevenster, 1951). Примитивность репертуара ухаживания у Spinachia подчеркивается отсутствием брачной окраски у самки и самца, самец определяет зрелую самку по раздутому брюху (Leiner, 1934).
Ареал Spinachia spinachia перекрывается с ареалом Gasterosteus aculeatus в Балтийском и Северном морях, но нерестовые субстраты их не совпадают и гибриды не найдены в природе, хотя Лейнер (Lejner, 1934) получал их в лаборатории.
Как и при анализе гнездостроительной фазы репродуктивного поведения, на основании сравнения разных элементов брачного поведения можно говорить, о том, что 5 родов колюшковых группируются между собой по-разному. Например, по сходству в выполнении «зигзаг»-танца объединяются в одну группу Gasterosteus и Pungitius, в другую — Culaea и Apeltes, приближение самца Spinachia к самке уникально. По сходству в выполнении элемента «ведение к гнезду» объединяются Gasterosteus aculeatus и Spinachia, Gasterosteus wheatlandi и Pungitius. Выполнение этого элемента у Culaea и Apeltes у каждого по-своему уникально. По выполнению элемента «показ входа в гнездо» сходство обнаруживают Pungitius и Culaea, у всех остальных 3 родов этот элемент также по-своему уникален. Выполнение элемента «тормошение самки в гнезде» объединяет, с одной стороны, Gasterosteus, Pungitius и Culaea, а с другой — Apeltes и Spinachia. Проникновение самца в гнездо по иному пути, отличному от такового самки, отделяет Spinachia от всех других родов. Наличие только у Gasterosteus aculeatus элемента «dorsal pricking» и дополнительного цикла гнездовой активности во время сексуальной фазы также выделяет этот таксон из всех других колюшковых. Таким образом, как и в случае поведения в гнездостроительной фазе нереста, налицо мозаичность эволюции брачного поведения в разных родах колюшковых. Однако можно заметить, что по выполнению разных элементов сексуальной фазы чаще всего объединяются 3 рода — Gasterosteus, Pungitius и Culaea (что, впрочем, также имело место при анализе гнездостроительной фазы). Определенно можно сказать, что самым простым представляется брачное поведение Spinachia, структуру гнезда Spinachia можно также рассматривать как исходный тип, а гнезда остальных родов колюшковых — как его усложнение или модификации. Отсутствие брачной окраски Spinachia также свидетельствует о примитивности их репродуктивного поведения.
2.8.3. РОДИТЕЛЬСКАЯ ФАЗА
О том, насколько важную роль играет забота о потомстве у колюшковых, свидетельствует сравнение процента вылупления молоди из икры, выведенной в гнезде самцом и выращенной в искусственных и благоприятных (с точки зрения экспериментатора) условиях. Так, икра, полученная от самок Pungitius pungitius, оплодотворялась в чашках Петри сухим способом и помещалась в садках из мельничного газа в аквариумы с хорошей аэрацией (с помощью микрокомпрессоров). Для предотвращения поражения икры грибками вода обрабатывалась высококачественными импортными противогрибковыми препаратами, погибшие икринки ежедневно удалялись из кладок. Тем не менее процент вылупления не превышал 30—40 % (в лучшем случае 65 %). В той же воде (только не обработанной лекарствами, не аэрируемой и не проточной) в соседних аквариумах у самцов колюшек, выводивших икру от тех же самок в гнезде, процент вылупления был близок к 100 %! (личные аквариумные наблюдения автора).
Применение Эвайсом (Avise, 1976) для лабораторного выведения трехиглой колюшки из Калифорнии (США) еще более совершенной техники также давало число выведенных икринок, в лучшем случае равное 62—66 %, но, по его свидетельству, многие кладки полностью гибли от грибковых заболеваний даже в проточной воде. В природе в большинстве случаев гнездо, лишившееся родителя, обречено — это показали эксперименты в бассейне Белого, Черного и Балтийского морей, проведенные Гомелюком (1978). Кинард (Kynard, 1978) также отмечал, что в оз. Вапато (штат Вашингтон, США) в 1970 г. отмечались массовое покидание самцами Gasterosteus aculeatus своих гнезд и прекращение родительского цикла. Проведенные им эксперименты и наблюдения в природных условиях показали, что подавляющее большинство икры гибло в этом случае либо из-за выедания ее беспозвоночными (пиявки и другие) и рыбами, либо из-за ненормального развития. Рассмотрим поэтому подробнее поведение самца при выведении потомства.
Лучше всего события во время родительской фазы экспериментально изучены на трехиглой колюшке: Прежде всего после оплодотворения самец изменяет форму кладки икры в гнезде, которая обычно располагается у входа в гнездо в виде округлой массы икринок. Самец головой проталкивает икру глубже в гнездо и затем вжимает кладку в дно гнезда серией толчков и разглаживает ее, делая плоской. Затем он удлиняет гнездо и зауживает вход в него, добиваясь тем самым, чтобы следующая кладка икры не откладывалась прямо на предыдущую, а была смещена (черепицеобразно) по отношению к первой. Такое устройство обеспечивает более эффективную вентиляцию всех яиц, чем если бы все яйца откладывались бы одной округлой массой (Van Iersel, 1953). Все это время самец часто вентилирует гнездо («phanning») грудными плавниками. Все эти события происходят примерно в течение часа; в это время самец агрессивен и не ухаживает за самками, но через час он снова готов ухаживать за ними и в течение суток может «набрать» в гнездо до 6—7 кладок (Tinbergen, 1951; Van Iersel, 1953; А. В. Голубев, личн. сообщ.). После этого самец прекращает сексуальную активность и переключает все свое внимание на гнездо. Лишь после выведения, икры через 1—2 недели самец вступает снова в сексуальную фазу. Емко и красочно описывает родительское поведение самца колюшки Сабанеев (1982; с. 102): «Он остается при гнезде, удаляется от него лишь на небольшие расстояния и ревниво оберегает его от всяких врагов, то отгоняя их от этого места, то стараясь отвлечь от него внимание других, более опасных неприятелей, особенно крупных рыб, которые все весьма не прочь полакомиться икрой колюшки. Даже сами колюшки-самки истребляют свои собственные яйца. Кесслер рассказывает, как он безуспешно старался отогнать одного черного самца девятииглой колюшки: сначала последний при каждом движении палки отбегал от гнезда и снова возвращался к нему, но затем уже стал бросаться на палку, как бы огрызаться на нее подобно собаке. Эта охрана гнезда продолжается 10—14 дней, до тех пор пока его окончательно не покинут выклюнувшиеся рыбешки ... Но и то первые дни самец старательнр смотрит за молодью и не дает далеко уплывать от гнезда. Мало того, во время развития зародышей заботливый отец, чтобы воспрепятствовать засорению яиц, нарочно производит волнение воды и усиленно двигает своими грудными плавниками перед отверстием гнезда».
При вентиляции гнезда рыло самца находится на расстоянии 1—2 см от входа в гнездо, и ось тела самца совпадает с продольной осью гнезда (рис. 20). Токи воды создаются грудными плавниками, синхронно движется и хвостовой плавник (Van Iersel, 1953). Использование подкрашенной воды показало, что струи идут через тоннель гнезда и затем устремляются вверх через крышу гнезда, что обеспечивает эффективное удаление СО2 (Tinbergen, 1951). Это очень важно, так как часто нерестилища колюшек располагаются в стоячих водах на мелководье, где кислородные условия неблагоприятны и икра без вентиляции быстро бы плесневела. Для облегчения вентиляции, когда икра находится уже на поздних стадиях развития, самец делает отверстие в крыше и боковых стенах гнезда, перед выклевом предличинок самец полностью разбирает верхний свод гнезда (Wunder, 1930). Еще позже он начинает разрушать гнездо, вынося из гнездовой ямы растительный материал и оставляя в ямке только часть спутанного в клубок материала, где находится недавно вылупившаяся молодь (Wunder, 1930). На всем протяжении развития икры самец выбирает и съедает мертвые икринки.
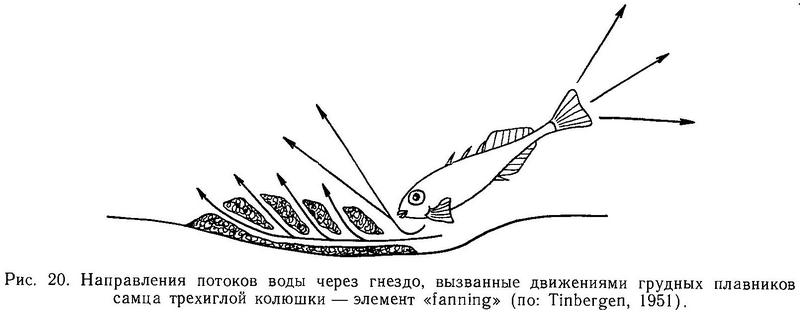
Самец еще около недели заботится о свободно плавающей молоди и пытается содержать молодь вместе у гнезда; уплывших в сторону предличинок он всасывает в рот и выплевывает в гнездовую яму (Van Iersel, 1953; личные наблюдения автора). Однако в «семейных» группах колюшек отсутствует система двусторонней сигнализации между родителями и потомством, и у молоди не происходит выработки оборонительных реакций путем опосредованного обучения самцом. Поэтому Мочек (1972, с. 47) приходит к выводу, что колюшковые относятся к рыбам, чьи семейные группы обладают невысокой степенью поведенческой объединенности в отличие от таких рыб, как например тиляпия (Tilapia mossambica), для которой характерно высокоразвитое семейное поведение.
Есть экспериментальные доказательства того, что самец может определять качество воды и увеличивать вентиляцию икры, если вода плохого качества. Так, Ван Ирзел (Van Iersel, 1953) искусственно обогатил воду в аквариуме СО2 и обеднил О2, на что самец резко увеличил продолжительность вентиляции. Изменения качества воды регистрируются рецепторами 9-го и 10-го черепно-мозговых нервов, окончания которых находятся в глотке (Segaar, 1966). Увеличение длины периода вентиляции гнезда самцом положительно влияет на скорость развития икры (Van Iersel, 1953).
Гормоны, продуцируемые семенниками, видимо, влияют на начало родительского цикла, поскольку кастрация самцов через 2 дня после начала «вентиляционной активности» приводила к прекращению родительской деятельности и удалению икры из гнезда самцом (Smith, Hoar, 1967). Когда же родительское поведение прочно устанавливается, оно становится независимым от гонадных гормонов: кастрирование самцов в середине родительского цикла не вызывает прекращения цикла — самцы и вентилируют гнезда, и агрессивны (Baggerman, 1968). Выше (в разделе 2.8.1) уже отмечалось, что с началом гнездостроительной фазы и далее наблюдается возрастание агрессивности самца, достигающей пика во время родительской фазы. Как ни странно, обычно больше всего «хлопот» территориальному самцу доставляют конспецифичные самки и самцы, очевидно вследствие высокой плотности нерестовых колоний. Обычно самец атакует вторженца стремительным броском и, если последний убегает, кусает его; укусам в основном подвергается область вокруг глаз и хвостовой стебель. В стычках самцы не пользуются колючками как оружием, выпрямление колючек имеет сигнальное значение (Tinbergen, 1951). Конфликт на Границе гнездовых участков между 2 самцами имеет свои «правила игры». Они начинают крутиться вокруг друг друга, спинные колючки и брюшная колючка, обращенная к сопернику, выпрямлены — это типичная поза угрозы. Другая поза угрозы — самец принимает позу «головой вниз» боком к противнику, при этом выпрямлены спинные колючки и брюшная, обращенная к противнику. В итоге один из соперников убегает. Из такой позы на самом деле невозможно совершить прямую атаку. Поза эта означает, что рыба находится в амбивалентном мотивационном состоянии с тенденцией к атаке и бегству (Tinbergen, 1951). Ван Ирзел (Van Iersel, 1953) полагает, что эрекция колючек сигнализирует о мотивационном состоянии самца: выпрямленные спинные колючки — сигнал высокой агрессивности, а выпрямленная брюшная — готовность к бегству. Вуттон (Wootton, 1976; с. 171) считает, что поскольку колючки в сущности являются модифицированными плавниками, то эрекция колючек может быть коррелирована с изменениями наружности плавников, когда рыба плывет, а не напрямую с изменениями факторов, контролирующих кусание или бегство. В работе, признанной этологами классической, Тинберген (Tinbergen, 1951) серией изящных опытов на самце трехиглой колюшки показал, что красная окраска является стимулом, вызывающим агрессию (рилизинг-фактором). Сначала территориальному самцу с помощью куска проволоки «подводили» мертвых колюшек, и он более энергично атаковал «красных» самцов, нежели незрелых, тускло окрашенных или самок. Мертвых, но искусственно окрашенных в красный цвет самок он также энергичнее атаковывал, чем живых бесцветных. Для предотвращения искажающего влияния запаха мертвые рыбы подводились к самцу помещенными в стеклянные пробирки — результаты были аналогичными. Затем самцу предлагались пластмассовые модели разной окраски, и больше всего атаковывались модели с «красным брюхом». Размер и форма модели не имели такого решающего значения на стимуляцию агрессии, как «красное брюхо». Тинберген (Tinbergen, 1953) приводит курьезный случай, когда территориальный самец в аквариуме регулярно «атаковал» проходящий почтовый поезд красного цвета, когда видел его из окна лаборатории: самец перемещался стремительным броском по аквариуму в сторону окна.
Размер самца, охраняющего гнездо, не влияет на его агрессивность, но если во время гнездостроительной фазы он одинаково атакует и самок и самцов, то после постройки гнезда самец энергичнее атакует окрашенных самцов, нежели самок и незрелых самцов (Wootton, 1976), причем самец «не боится» и более крупных рыб, чем он сам: так гнездующие самцы атаковывали гольянов, которые были крупнее на 4 см. Наиболее агрессивен самец в радиусе 30—40 см от гнезда, но во время родительской фазы территория наивысшей агрессии несколько сужается (до 25—30 см) (Back, 1971; Huntingford, 1974). Топография охраняемой территории также влияет на ее площадь — если камни, растения и т. п. затрудняют соседним территориальным самцам визуальное наблюдение друг за другом, это уменьшает территорию их участков (Wunder, 1930). Эксперименты и природные наблюдения показывают, что минимальная дистанция между гнездами 30—50 см и наименьшая площадь территории гнездующего самца 45х45 см (Black, Wootton, 1970), причем более агрессивный самец «содержит» большую территорию (Van Den Assem, 1967). В эксперименте на одной и той же площади можно добиться большей плотности нерестовой колонии самцов, если их разместить одновременно, нежели когда самцы выпускаются на эту площадь по очереди с 24-часовым интервалом (Van den Assem, 1967), так как самцы, первыми захватившие «место под солнцем», неохотно отдают ее новеньким. При одновременном выпуске самцов на субстрат вначале идут ожесточенные стычки за территорию, но когда «места» уже распределены, ожесточенность и количество стычек уменьшается в течение 2 дней, и самцы занимаются больше уже другими делами — строят гнезда, ухаживают за самкой и т. п. (Van den Assem, 1967). Иногда самец отвлекает самок от гнезда, принимаясь «копать» грунт в стороне от гнезда, как будто он ищет корм, что часто приводит к успеху (Гомелюк, 1978).
Понятно, что сама агрессивность самцов должна поддерживаться отбором, поскольку неагрессивный самец не может захватить участок, построить гнездо и в конечном счете не может участвовать в размножении и не оставит потомства. Есть положительные корреляции между агрессивностью самцов и «смелостью» по отношению к хищникам (Huntingford, 1977). Имеются экспериментальные доказательства того, что продукт гипофиза — гормон гонадотропин стимулирует высокий уровень агрессивности. Даже самцы, выдержанные в условиях короткого светового дня, когда гипофиз имеет низкую активность, но инъецированные гонадотропным гормоном млекопитающих (лютеинизирующим гормоном), увеличивали агрессивность (Hoar, 1962а). Другие гормоны гипофиза — тироидстимулирующий и фолликулстимулирующий — не меняли уровня агрессивности самцов при инъекции. Вместе с тем блокатор секреции гонадотропина — металлибур — при инъекции уменьшал агрессивность самцов (Carew, 1968, — цит. по: Wootton, 1976).
Территориальные самцы не напрасно наиболее ожесточенно преследуют именно конспецифичных самцов, так как у колюшек можно наблюдать удивительное явление «похищения» икры из гнезда другими самцами. Эта икра или съедается, или «усыновляется» похитителем. Впервые «налеты на гнезда» были описаны для Pungitius (Morris, 1952) и для Gasterosteus aculeatus Драпкиным (1954). Действия «налетчика» на чужой территории отличаются своего рода «продуманностью». Нарушив границу чужой территории, «налетчик» опускается на дно, выпрямляет спинные колючки и принимает камуфлирующую окраску. Крадучись, он приближается к чужому гнезду по дну скользящими движениями и делая паузы между скольжениями. Последние несколько сантиметров, оставшихся до гнезда, он преодолевает стремительным броском. Если его обнаруживает владелец гнезда, то он обращается в бегство после выпада хозяина, но если он успевает достичь гнезда, то хозяину уже трудно выгнать вторженца, и тут разворачиваются самые интересные события. Если в это время владелец занят ухаживанием за самкой, то дальнейшее поведение «налетчика» зависит от того, на какой стадии находится брачная игра. Если владелец показывает самке вход в гнездо, «налетчик» прерывает его ухаживание и начинает «сверлить» гнездо, но в случае, если самка уже откладывает икру, «налетчик» пытается оплодотворить икру до владельца, что ему иногда удается. В том случае, если «налетчик» пробрался к чужому гнезду до брачного танца хозяина, он крадет гнездовой материал для своего гнезда (если он его еще не построил). Если в гнезде хозяина уже есть икра, он крадет ее и съедает (в том случае, когда сам еще не построил гнездо) или помещает в свое гнездо и далее ухаживает за икрой. Интересно, что если во время предыдущего рейда «налетчику» удалось оплодотворить икру в чужом гнезде, то следующим рейдом он пытается украсть эту икру (Morris, 1952; Драпкин, 1954; Van Den Assem, 1967; Wootton, 1971).
Ван ден Ассем (Van Den Assem, 1967) полагает, что функцией «налетов» является перераспределение икры в нерестовой колонии: похищает икру тот, кто не добился успеха в ухаживании за самкой; похищение икры приводит в итоге к синхронизации репродуктивного цикла самцов. Вуттон (Wootton, 1971) считает, что каждый самец на нерестилище будет иметь больший успех в выведении потомства, если все самцы на территории нерестилища будут включены в родительскую активность, чему способствует похищение икры. Драпкин (1954) полагает, что в конечном счете похищение и усыновление икры способствует сохранению численности вида, но Драпкин не объясняет, по каким причинам. Гомелюк (1978) полагает, что, поскольку во время нереста всегда имеется убыль самцов, охраняющих свои гнезда, усыновление гарантирует выведение икры чужим самцом, даже если «отец» погиб по каким-то причинам. Мак-Инерней (Mclnerney, 1969) отмечает, что «усыновление» свойственно всем колюшковым.
Gasterosteus wheatlandi обнаруживает сходный цикл родительского поведения Gasterosteus aculeatus, хотя уровень «вентиляционной активности» у самца несколько ниже (Mclnerney, 1969).
Родительская фаза Pungitius pungitius сходна в общих чертах с Gasterosteus. Самец охраняет гнездовую территорию, преследует и кусает вторженцев. Главная поза угрозы — головой вниз, тело боком повернуто к противнику, брюшная колючка выпрямлена. У Pungitius в отличие от Gasterosteus эрекция брюшных колючек коррелирует с тенденцией к атаке (Morris, 1958). Потерпевший поражение в схватке самец принимает позу «хвост вниз» и теряет черную окраску (Barraud, 1955). После оплодотворения икры самец проталкивает икру глубже в гнездо. Затем в течение 1—2 ч самец занимается вентиляцией икры, после чего он готов принять в гнездо следующую кладку икры. Во время родительского цикла вентиляция икры становится главным компонентом родительской активности и достигает пика перед вылуплением. Тем не менее Pungitius проводит меньше времени, занимаясь вентиляцией, чем Gasterosteus. Вуттон (Wootton, 1976, с. 283) полагает, что это связано с тем, что гнездо Pungitius находится не на субстрате и окружено живой фотосинтезирующей тканью растений, т. е. в более благоприятном кислородном режиме. Вместе с тем он сам же (Wootton, 1976, с. 284) приводит два веских довода против этого объяснения: 1) у грунтогнездующих Pungitius pungitius оз. Гурон (McKenzie, Keenleyside, 1970) количество времени, затрачиваемого на вентиляцию, все равно меньше, чем у Gasterosteus, 2) у грунтогнездующих Gasterosteus wheatlandi количество времени, затрачиваемого на вентиляцию, сравнимо с таковым Pungitius pungitius (Mclnerney, 1969). Добавим к этому, что Apeltes, гнездующая на растениях (так что ее икра находится в условиях благоприятного газового режима), почти не отличается по этому показателю от Gasterosteus aculeatus (Mclnerney, 1969; Rowland, 1974). В итоге Вуттон приходит к обоснованному, на мой взгляд, выводу, что причины надо искать в таких факторах, как скорость метаболизма икры, размер кладки, количество яиц в гнезде и эффективность вентиляции гнезда. Несмотря на меньшее количество времени, затрачиваемое на вентиляцию икры, молодь Pungitius pungitius вылупляется на 6—7-й день после оплодотворения при 16 °С и на 4—5-й день при 19 °С, так что срок инкубации икры у Pungitius pungitius короче, чем Gasterosteus aculeatus (Morris, 1958).
Кроме вентилирования самец во время родительской фазы удаляет мертвые икринки и возвращает обратно выпавшие из гнезда на грунт (Morris, 1958). Главное отличие родительского цикла Pungitius от Gasterosteus состоит в том, что Pungitius после вылупления молоди строит над гнездом «колыбельку» (специальную ловушку для молоди), куда помещает вылупившихся предличинок. «Колыбелька» строится из растительного материала, часто используется материал из гнезда. Через 3—4 дня после вылупления молодь всплывает на поверхность для заполнения воздухом плавательного пузыря и постепенно рассеивается среди растений, так что самцу становится все труднее хватать личинок ртом и выплевывать в «колыбельку». Через 1—2 дня самец «теряет» родительское поведение и готов к следующему нересту (Morris, 1958). Во время родительской фазы сексуальное поведение у Pungitius прекращается, а агрессивное усиливается, как и у Gasterosteus, причем фактором, вызывающим агрессию — «рилизинг-фактором» у Pungitius является черный цвет, так же, как у Gasterosteus — красный (Morris, 1958). «Налеты на гнезда» у Pungitius так же имеют место, как и у Gasterosteus, и впервые были описаны Моррисом (Morris, 1952) именно у Pungitius pungitius.
Culaea inconstans по родительской фазе самца весьма сходна с Pungitius pungitius. После оплодотворения самец в течение часа усиленно вентилирует гнездо, а затем занимается гнездостроительной деятельностью — заделывает выход из гнезда, проломленный в задней стенке самкой (поскольку самец изначально не делает выхода из гнезда). Кроме того, самец увеличивает гнездо, чтобы принять другую кладку икры (McKenzie, 1974). Вентиляция у Culaea подобна таковой у Gasterosteus и Pungitius, но по времени вентиляции Culaea сходна больше с Pungitius. Молодь вылупляется через 5—9 дней (в зависимости от температуры). Самец помещает молодь в «колыбельку», построенную, как у Pungitius, выше гнезда. Через 2—3 дня молодь расплывается, и самец заканчивает родительскую фазу. Налеты на гнезда и воровство яиц у Culaea также имеют место (McKenzie, 1974).
Площадь гнездовой территории самца Culaea (250—1600 см2) сравнима с таковой Gasterosteus и Pungitius (Reisman, Cade, 1967). Во время родительской фазы агрессивность самца возрастает (McKenzie, 1969а). Позы угрозы самца Culaea сходны с таковыми Gasterosteus и Pungitius, но в отличие от них Culaea еще может принимать специфическую «сигмоидную» позу, когда самец сгибает хвост по направлению к голове, искривляя таким ооразом бок тела (McKenzie, 1969а).
Родительская фаза Apeltes по наличию новых элементов родительского поведения, а также по необычной временной и пространственной организации типичных для колюшковых элементов родительского поведения резко отличается от всех других родов колюшек.
После оплодотворения икры самец Apeltes вентилирует гнездо, содержащее икру, а после этого начинает строить новое гнездо, расположенное выше первого на том же растении. Во второе гнездо откладывает икру уже другая самка при следующем нересте. Постройка нового гнезда после каждого нереста повторяется несколько раз, так что самец строит ярусами гнезда, расположенные друг над другом. Вместо вентиляции гнезда «фаннинг» — посредством движений грудных плавников — самец Apeltes вентилирует гнездо посредством всасывания («сакинг»), когда он всасывает воду в рот глотательными движениями и выталкивает через жаберные щели. Самец глотает воду через дырки в гнезде, так что его рот имеет близкий контакт с икрой. Грудные и хвостовой плавники вибрируют при этом, но грудные плавники отведены назад под углом в 45° по отношению к поверхности тела и не участвуют в создании сильных токов воды. Как уже отмечалось выше, «сакинг» обеспечивает снятие опасности вымывания икры из открытого гнезда, что наблюдалось бы при «фаннинге» (Reisman, 1963; Rowland, 1974).
Если еще через 1—2 дня после оплодотвирения у самца наблюдается низкий уровень «сакинг», то затем неуклонно увеличивается как количество актов вентиляции, так и количество времени, затраченного на каждый акт. Даже вентилируя гнездо, самец остается готовым к ухаживанию за зрелыми самками и оплодотворяет все новые кладки, что резко отличает Apeltes от других колюшковых, у которых исчезает сексуальное поведение с началом родительского цикла. Пик вентиляционной активности (5 мин на каждые полчаса) наступает на 6-й день после 1-го оплодотворения и в дальнейшем не увеличивается. В результате особой временной организации нереста у Apeltes в его комплексе гнезд икра находится на разных стадиях развития и самец больше всего вентилирует икру, находящуюся на более поздних стадиях. Молодь вылупляется на 8—9-й день оплодотворения при 18 °С. Как у Gasterosteus, Pungitius и Culaea, пик вентиляционной активности у Apeltes наступает непосредственно перед вылуплением, а затем быстро падает.
После вылупления молоди самец удаляет из гнезда пустые оболочки икринок, однако он не строит «колыбельку» и равнодушно относится к молоди (не ухаживает, но и не нападает на нее). Кроме нескольких гнезд, расположенных ярусами на одном растении, самец может начать строить такой же комплекс на соседнем растении, оплодотворять икру и ухаживать за ней там, при этом он следит уже за двумя комплексами гнезд, уделяя больше всего внимания икре, находящейся на поздних стадиях развития. После первого оплодотворения самец способен еще в течение 2—3 недель ухаживать за самками и нереститься с ними. Самцы же других колюшковых пока не выведут кладку икры в одном гнезде, не начинают строить новое и теряют сексуальный интерес к самкам. В отличие от других колюшковых Apeltes не ухаживает за молодью, которая «прыжками» уплывает из гнезда, и находится в малоподвижном состоянии на субстрате. Через 2 дня после выклева личинки глотают воздух с поверхности и рассеиваются (Reisman, 1963; Rowland, 1974). Особенности временной и пространственной организации нереста связаны с малым размером гнезда у Apeltes. Во время родительской фазы самец агрессивен и позы угрозы аналогичны другим колюшковым (Rowland, 1974а).
Родительская фаза Spinachia сходна в принципе с таковой Gasterosteus. Пик вентиляционной активности «фаннинг» достигается, как и у всех колюшковых, перед выклевом, длина каждого акта 5—6 мин на каждые полчаса. При 16 °С вылупление происходит на 18-й день после оплодотворения (Leiner, 1934). На 2—3 день после выклева молодь рассеивается от гнезда (Sevenster, 1951). Самец охраняет гнездовую территорию, причем при атаке на вторженца самец простым прямым броском достигает его и кусает в хвостовой стебель. Атакуемый вторженец спасается бегством, выпрямив брюшные и спинные колючки (Sevenster, 1951). Таким образом, в отличие от других колюшковых «правила игры» при стычках у Spinachia наиболее простые.
Исходя из вышеизложенного и на основании анализа родительского поведения всех 5 родов колюшковых можно выделить Apeltes, который отличается присутствием элементов, не встречающихся у других родов: вентиляция с помощью глотания, отсутствие заботы о выклюнувшейся молоди, способность к сексуальному поведению у самца во время родительского цикла, многоярусность гнезд. Остальные 4 рода более или менее сходны между собой, однако наибольшее сходство обнаруживают Culaea и Pungitius (наличие «колыбельки»), а наиболее просто родительский цикл, видимо, устроен у Spinachia.
В целом движения, с помощью которых колюшки вентилируют свои гнезда, достраивают их и поливают клеем, очищают и переворачивают икру, сходны у различных видов, исключая вентиляцию глотанием у Apeltes, и отличаются лишь количественно и в мелких деталях. Заметим, что вентиляция икры с помощью грудных плавников не является уникальной для Gasterosteidae — этот способ конвергентно развился у самых разных таксонов рыб: пинагора (Cyclopterus lumrus), лжепескаря (Pseudogobio rivularis), ряда представителей семейства морских собачек Blenniidae и других (Мочек, 1972).
Общей закономерностью для всех колюшек является постепенное увеличение вентиляционной активности по мере развития икры (Morris, 1958; McKenzie,. 1974; Rowland, 1974), хотя общее количество времени, затрачиваемого на вентилирование, различно у разных видов. По уменьшению вентиляционной активности виды располагаются в следующем порядке: Gasterosteus aculeatus — Apeltes quadracus — Pungitius pungitius — Gasterosteus wheatlandi — Spinachia spinachia — Culaea inconstans. Видно, что грунтогнездующие и негрунтогнездующие виды расположены здесь не последовательно, а, скорее, мозаично, поэтому здесь нет четкой связи между уровнем вентиляции и более неблагоприятным газовым режимом у дна. Можно согласиться с мнением Вуттона (Wootton, 1976, с. 234), что причины межвидовых различий в уровне вентиляции связаны с комплексом факторов, таких как скорость метаболизма икры, размер кладки, количество яиц в гнезде, эффективность вентиляции и т. д.
Имеющиеся в настоящее время данные не позволяют однозначно выделить вид, наиболее прогрессивный по признаку «родительское поведение», или эффективность заботы о потомстве. Оригинальный способ вентиляции кладок у Apeltes сочетается с более примитивным, по мнению Роулэнда (Rowland, 1974), строением гнезда, а также отсутствием заботы о вылупившихся личинках, что связано, видимо (из-за наличия нескольких неодновременно отложенных кладок), с растянутостью выклева иногда до 8 сут и необходимостью для самца все внимание уделять икре.
Наличие «колыбельки» у Pungitius и Culaea может и не отражать их родство, а являться специализацией, связанной с условиями, в которых протекает нерест, — зарослями водорослей, в которых могли бы потеряться выклюнувшиеся из икры беспомощные личинки (Morris, 1958; Reisman, Cade, 1967). У Apeltes, хотя и нерестующей в сходных условиях, этот признак (постройка «колыбельки») не возникает из-за особой временной организации нереста, a Spinachia, также нерестящаяся в сходных условиях, не имеет «колыбельки», видимо, вследствие примитивности репродуктивного поведения. Gasterosteus не имеет «колыбельки» вследствие перехода к грунтогнездованию на открытых площадях — ей просто ее негде строить.
Хотя большинство видов колюшковых проявляет активную заботу о молоди и образует «семейные» группы, эти группы отличаются примитивными чертами — в них отсутствует сигнализация между родителем и потомством и не имеет места обучение в отличие от многих рыб тропической морской прибрежной фауны. Тем не менее колюшковые являются одним из немногих таксонов рыб северных широт, которому присуща активная забота о потомстве (Мочек, 1972).
Именно представители этого семейства (единственного среди рыб) строят истинные гнезда, напоминающие птичьи.
Во время периода размножения самцы колюшек приносят определенные жертвы (повышенный риск быть съеденным хищниками, ограниченные возможности прокормить себя, уменьшение возможности оплодотворить больше самок, значительные энергетические траты на защиту территории, ритуальное ухаживание за самкой, ухаживание за потомством, поддержание в порядке гнезда, вентиляция и т. п.). Самцы большинства других видов северных широт таких жертв, как правило, не несут. Однако эти жертвы более чем компенсируются, во-первых, высокой оплодотворяемостью икры вследствие ограниченного пространства гнезда, во-вторых, исключением напрасной траты гамет из-за отсутствия возможностей к гибридизации с другими видами, в-третьих, защищенностью икры и молоди от хищников и грибковых заболеваний в самый уязвимый период развития. Высокая численность и широкая распространенность большинства видов колюшковых подтвержает успех такой репродуктивной стратегии.
3. ГЕОГРАФИЧЕСКОЕ РАСПРОСТРАНЕНИЕ И ИСТОРИЯ ФАУНЫ
Все представители семейства колюшковых обитают в прибрежных морских и пресных водах северного полушария: в бассейнах Атлантического, Северного Ледовитого и Тихого океанов. В бассейнах Атлантического и Тихого океанов распространение колюшковых амфибореальное — они обитают в северных частях этих океанов и не спускаются южнее 32° с. ш. Самыми обширными ареалами обладают 2 -вида: Gasterosteus aculeatus и Pungitius pungitius, которые распространены и в восточном, и в западном полушарии в бассейнах всех трех океанов. Трудно сказать, ареал какого их этих видов больше по площади: если Pungitius pungitius явно держит первенство по распространенности в пресных водах, то Gasterosteus aculeatus доминирует в морских водах (рис. 21, 22). Ареалы всех других видов значительно меньше (рис. 23).
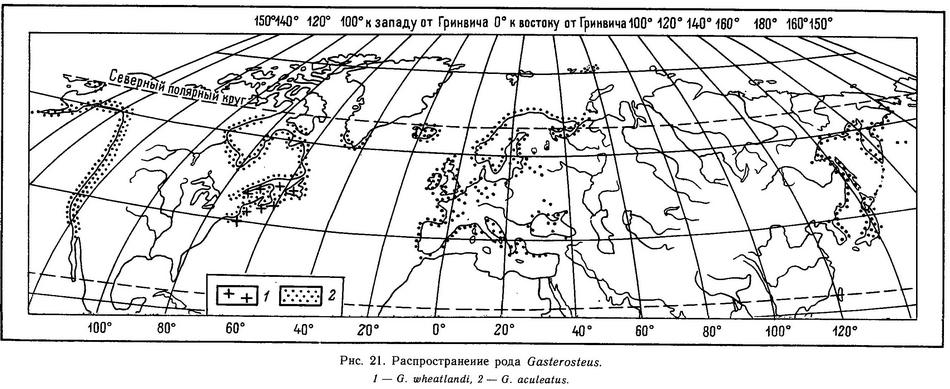
Gasterosteus aculeatus имеет разорванный ареал в северной части Атлантического и Тихого океанов: в Европе от Белого моря, Новой Земли (70° с. ш.) и Кольского полуострова до Черного моря, у берегов Гренландии, Исландии; в Сев. Америке от Гудзонова залива до Нью-Йорка и, возможно, Чезапикского залива и мыса Гаттерас (Берг, 1949); южная граница по Атлантическому побережью Америки недостаточно хорошо определена (Bell, 1984). По Тихоокеанскому побережью Сев. Америки — от Аляски до Южной Калифорнии (южная граница морской формы 37° с. ш., а пресноводной 32° с. ш.) (Miller, Hubbs, 1969). По побережью Северного Ледовитого океана Gasterosteus aculeatus отсутствует как в Сев. Америке, так и в Азии. В Восточной Азии трехиглая колюшка распространена от Берингова пролива на юг до Фузана (Корея) 36° 6' с. ш. (Берг, 1949) и по побережью Японии на юг до о. Киушу (близ г. Нагасаки 32°44' с. ш.) (Amaoka, Haruta, 1972). Между североазиатскими и североамериканскими популяциями нет разрыва, они связаны цепью популяций Алеутских и Командорских островов, простирающихся от Аляски до Камчатки. Таким образом, ареал Gasterosteus aculeatus состоит их трех крупных блоков, не связанных между собой: европейского, атлантического американского и тихоокеанского азиатско-американского. В целом ареал Gasterosteus aculeatus ограничен широтами 32—70° с. ш. Нахождение Gasterosteus aculeatus в Африке (близ г. Алжир) (Bertin, 1925) оспорено Хойтсом (Heuts, 1956), который не нашел следов этой популяции спустя 30 лет. Трудность описания ареала Gasterosteus aculeatus вызвана сложной популяционной структурой этого таксона — наличием морской и пресноводной форм и множества изолированных пресноводных популяций. Морская форма держится, как правило, в прибрежной части морей и океанов, хотя, по наблюдениям Расса (цит. по: Берг, 1949, с. 976), в Баренцевом море она встречалась в открытой части на севере до 72°41' с. ш. В пресных водах трехиглая колюшка встречается в слаботекущих реках и ручьях, в озерах, прудах, но отсутствует в быстротекущих водоемах и горных озерах. Жилая форма и в Европе, и в Америке встречается южнее, чем морская (Betrin, 1925; Miller, Hubbs, 1969). Например, в Европе к югу от пролива Ла-Манш морская форма trachurus отсутствует, а жилая leiurus встречается в пресных и солоноватых водах. В Европе в глубь континента самое дальнее проникновение leiurus отмечено, по Рейну, на расстояние до 700 км. На юг leiurus продвигается до Южной Испании, юга о. Сардиния и в Италии до Неаполя. В Сицилии отсутствует, но обитает по восточному побережью Адриатического моря (Bertin, 1925). В южной части ареала пресноводной формы часто встречаются популяции, вообще лишенные костных пластинок и киля на хвостовом стебле (голые). Бертэн (Bertin, 1925) называет эту форму hologymna. Параллельно такая же форма возникает в Америке, в Южной Калифорнии (Miller, Hubbs, 1969). Жилая форма в бассейне Средиземного моря обладает повышенной солеустойчивостью вне сезона размножения (Raunich et al., 1972), поэтому она могла распространяться по бассейну моря путем морских миграций вдоль побережья. Морской формы в бассейнах Средиземного и Мраморного морей нет, она появляется лишь в бассейнах Черного и Азовского морей, причем популяции трехиглой колюшки этих морей пространственно изолированы от балтийских популяций. В Каспийском море, Волге и Аральском море трехиглой колюшки нет.
По поводу расселения трехиглой колюшки в Европе и современного распределения морф колюшки выдвигались разные гипотезы. Так, Бертэн (Bertin, 1925) полагал, что все европейские популяции, обитающие от Норвегии до Италии, генетически однородны, а все изменения числа боковых пластин рассматривал как результат прямого воздействия солености и температуры: leiurus развивается в пресной воде и при высоких температурах, trachurus — в соленой воде и при низких температурах и semiarmatus — в промежуточных условиях. Таким образом, распространение разных форм он представлял как постепенный переход от чистой популяции trachurus в Северной Европе (Скандинавия) к популяциям, semiarmatus в Средней Европе и leiurus в Южной (Bertin, 1925). Ошибочность, этой гипотезы доказана: все три морфы детерминированы разными генотипами (Heuts, 1947а; Münzing, 1959; Hagen, 1967; Hagen, Gilbertson, 1973; Paepke, 1982; Зюганов, 1983г).
Мюнцинг (Münzing, 1959, 1963, 1972) считает, что современное распространение колюшки с ее тремя формами является результатом послеледникового (в плейстоцене) расселения, гибридизации и селекции этих форм в пределах морских и пресноводных условий.
Важнейшими факторами среды, влияющими на расселение форм колюшки, по его мнению, является температура и соленость.
Нужно сказать, что изложенные гипотезы Мюнцинга базируются лишь на данных современного распространения форм колюшки и истории ледниковых и послеледниковых геологических событий в четвертичный период. Ископаемыми отпечатками Gasterosteus aculeatus Мюнцинг не располагал, поэтому очевиден предположительный характер истории фауны, изложенный Мюнцингом.
Однако позже ископаемые отпечатки Gasterosteus aculeatus были обнаружены в позднемиоценовых отложениях (10-миллионолетней давности) в районе Лос-Анжелеса (Тихоокеанское побережье США, штат Калифорния) (Bell, 1973, 1974, 1977). Интересно, что отпечатки leiurus сохранились в пресноводных отложениях, а отпечатки trachurus — в морских, причем миоценовая trachurus морфологически ничем не отличается от современной (Bell, 1977). Поскольку ископаемая trachurus найдена значительно южнее, чем южная граница ареала современной trachurus, которой соответствует современная средняя февральская температура поверхности воды в море 12.4 °С, Белл (Bell, 1977) указывает, что в позднем миоцене температура воды в районе Лос-Анжелеса была 10 °С и ниже, что не противоречит более южному распространению trachurus в то время. Опираясь на палеотемпературные данные Канайя и Койзуми (Kanaja, Koizumi, 1966, — цит. по: Bell, 1976), установивших, что в плейстоцене произошло по крайней мере 20 крупных колебаний температурного минимума в западной Пацифике, Белл (Bell, 1976) выдвигает гипотезу о пульсации ареала морской trachurus, во время которой пресноводные ручьевые популяции leiurus независимо отщеплялись от «единой примитивной монофилетической линии trachurus» (Bell, 1977, с. 279). Каждый раз отступление trachurus на север влекло за собой изоляцию ручьевых популяций колюшки, которые превращались в leiurus, а последующий контакт с морской trachurus, с похолоданием вновь устремляющейся на юг, закреплял репродуктивную изоляцию.
Таким образом, Белл (Bell, 1976) постулирует полифилетическое происхождение leiurus, имеющее место в разное время в разных местах ареала. Консервативность и генетическое единство trachurus Белл объясняет стабильными условиями в море, а морфологическое разнообразие leiurus — разнообразием условий пресноводных водоемов, влиянием изоляции, дрейфа генов и разными режимами отбора в разных водоемах. С точки зрения Белла (Bell, 1984), представления Мюнцинга (Münzing, 1963) о trachurus и leiurus как о двух филетических линиях, которые независимо существовали, а затем в результате «ледниковых событий» образовали гибридную зону в одном месте, неубедительны. По мнению Белла (Bell, 1984), не может быть и речи о leiurus как об одной филетической линии, представители которой потом мигрировали по ареалу, образовывали зоны контакта с trachurus и т. д.; leiurus имеют полифилетическое происхождение. Не гибридизация между trachurus и leiurus, а отбор, вернее различия в направлениях и давлениях отбора в разных частях ареала привели к современному разнообразию колюшковых (Bell, 1984).
Gasterosteus wheatlandi — чернопятнистая колюшка — распространена по Атлантическому побережью Канады и США от о. Ньюфаундленда, зал. Св. Лаврентия на юг до г. Нью-Йорк (Sargent et al., 1984). Это морской вид, обитающий в прибрежных соленых водах. Размножается в солоноватых прибрежных водах, в эстуариях рек и на литорали. Подавляющее число популяций представлено морфой leiurus, хотя встречаются фенотипы, соответствующие semiarmatus и trachurus, и эта комбинация (редуцированный костный панцирь и морское распространение) необычна для рода Gasterosteus. Gasterosteus wheatlandi на всем своем ареале симпатричен с Gasterosteus aculeatus, у них даже одни и те же нерестилища. Неясно, произошел ли Gasterosteus wheatlandi от морской формы trachurus Gasterosteus aculeatus и затем имела место редукция костных пластин или же Gasterosteus wheatlandi — дериват формы leiurus трехиглой колюшки, которая адаптировалась к жизни в морской воде. Время и обстоятельства ответвления Gasterosteus wheatlandi от Gasterosteus aculeatus неизвестны (Wootton, 1976; Sargent et al., 1984).
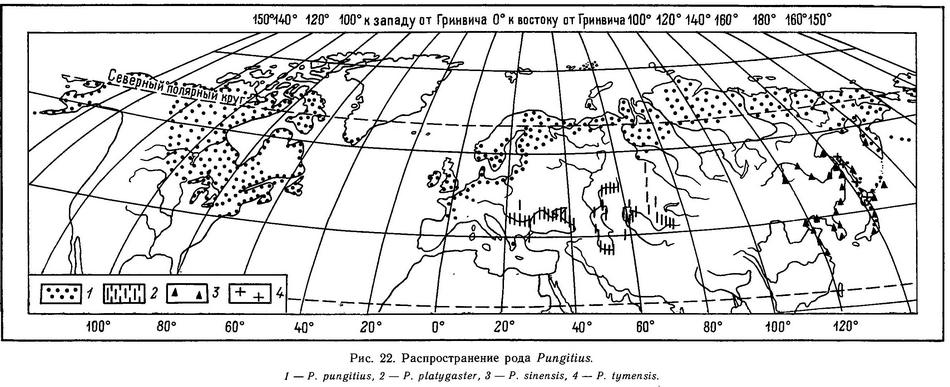
Pungitius pungitius (морфа leiurus с килем) как уже отмечалось, по масштабу ареала соперничает с Gasterosteus aculeatus. Pungitius pungitius более пресноводный вид и более северный. Это циркумполярный вид, распространенный по всему арктическому побережью Евразии и Сев. Америки. В Европе распространен до Южной Франции (бассейны рек Лауры и Роны) и в бассейнах Северного, Балтийского, Норвежского, Баренцева, Белого морей, Англии, Ирландии. В Исландии отсутствует (Берг, 1949; Münzing, 1969) (рис. 22). В Ирландии, Северо-Западной Англии и Южной Франции — подвид Pungitius pungitius laevis (морфа hologymna — голая и без киля) (Münzing, 1969). В Азии по Сибирскому побережью Северного Ледовитого океана, Чукотка, Камчатка, материковое побережье Охотского моря на юг до устья р. Амур. Есть на островах Шантарских, Курильских, Сахалине (СССР), Хоккайдо, Хонсю до южной оконечности (Япония) (Берг, 1949). В Сев. Америке Pungitius pungitius почти не встречается на Тихоокеанском побережье (кроме Алеутских островов, п-ова Аляска и о. Кадьяк); к востоку от Аляски — в р. Маккензи, Медвежьем и Большом Невольничьем озерах. Далее на восток девятииглая колюшка распространена по берегам Гудзонова залива, Баффиновых островов и по Атлантическому побережью на юг до штата Нью-Джерси (южнее Нью-Йорка). В континентальной части Сев. Америки она распространена в Великих Озерах (кроме оз. Эри), в канадских провинциях Манитоба, Квебек, Онтарио, Виннипег, Альберта, Саскачеван, а также в верховьях р. Миссисипи (штат Индиана, США) (McPhail, 1963). Найдена в южной части Гренландии (McPhail, Lindsey, 1970) (рис. 22).
Pungitius sinensis (морфа trachurus) сменяет Pungitius pungitius к югу от устья Амура (на Дальнем Востоке) и далее распространена до устья р. Янцзы по материку. На островах Сахалин, Курильской гряде, Хоккайдо и Хонсю симпатрична с Pungitius pungitius (Берг, 1949).
Pungitius tymensis (морфа hologymna с килем) имеет ограниченный ареал — обитает только на островах Сахалин (СССР) и Хоккайдо (Япония) (Берг, 1949).
Pungitius platygaster (морфы trachurus без киля и leiurus) обитает в бассейнах Черного, Азовского, Каспийского и Аральского морей, а также в реках Чу, Сары-Су, Нура (Казахстан) (Берг, 1949). Изолирована географически от Pungitius pungitius.
В последнее десятилетие ареалы Pungitius pungitius и Pungitius platygaster оказались нарушенными в результате деятельности человека. Так, Pungitius pungitius попала в р. Сходня (приток р. Ока, Московская обл.), а Pungitius platygaster из р. Нура попала в р. Ишим и поднялась на север до р. Иртыш (приток р. Обь), где в районе Тобольска возможен ее контакт с Pungitius pungitius (Зюганов, 1984а).
Описывая эволюцию и расселение рода Pungitius, Мюнцинг (Münzing, 1969) решающую роль отводит плейстоценовым оледенениям. Исходным предком всех форм он признает полностью вооруженный брюшными и спинными колючками, пластинами и килем морской эвригалинный тип. В плейстоцене в нескольких рефугиумах (свободных от ледников убежищах) ответвились новые виды и подвиды. Ведущую роль в формообразовании играла редукция костного вооружения в пресных водах. Предки современных Pungitius platygaster (гипотетические популяции Pungitius, покрытые щитками) проникли во время Рисского оледенения с севера в Каспий (возможно, через р. Урал?), а оттуда в Черное и Аральское моря. В Южной Европе был другой рефугиум, в котором возник подвид Pungitius pungitius laevis, полностью утерявший пластины и киль. У форм в восточоазиатском рефугиуме редукция пластин и киля была выражена слабее, судя по тому, что на Дальнем Востоке широко распространена Pungitius sinensis, покрытая пластинами и имеющая киль, больше всего похожая на гипотетического предка рода Pungitius (Munzing, 1969).
Из схемы Мюнцинга неясно, однако, из какого рефугиума распространилась Pungitius pungitius, имеющая самый обширный циркумполярный ареал. Эта форма не может быть предком всех прочих, поскольку у нее уже редуцированы пластины на теле. Мак-Фейл (McPhail, 1963) считает, что современная Pungitius pungitius на Североамериканском континенте могла распространиться из берингийского рефугиума (в районе Аляски). Возможно, она могла распространиться оттуда и на запад по Азии. В своих построениях Мюнцинг (Münzing, 1969) опять-таки не ссылался на палеонтологические данные. Хотя еще в 1934 г. в западносибирских пресноводных верхнетретичных (неогеновых) отложениях Штылько обнаружил отпечатки рыб, очень похожих на современных Pungitius pungitius и лишенных боковых пластин (он их назвал Gasterosteops) (Штылько , 1934). Плиоценовые находки Штылько в районе р. Ишим, притока Иртыша (бассейн р. Обь), противоречат схеме Мюнцинга, поскольку, как известно, плиоцен предшествует плейстоцену. Если уже в плиоцене в Сибири обитали предки Pungitius, лишенные боковых костных пластин, то маловероятно, что к плейстоцену они вторично стали «опластиненными» и под давлением наступающего ледника отступили в Каспий. Район, где Штылько обнаружил отпечатки, находится как раз на путях гипотетической миграции в Каспий предков Pungitius platygaster.
Вуттон (Wootton, 1976) сообщает, что в верхнетретичных отложениях Китая найдены ископаемые остатки Pungitius, ссылаясь на работу Лиу Хсиен-Тьинга и Ванг Ньен Чунга (Liu Hsien-T'ing, Wang Nien-Chung, 1974, — цит. по: Wootton, 1976), однако, к сожалению, этой работой я не располагаю.
В Сев. Америке четко различаются две формы Pungitius pungitius, имеющие морфологические различия подвидового ранга. Берингийская форма имеет до 5 пластин на теле, больше спинных колючек и меньше жаберных тычинок, чем миссисипская форма, у которой отсутствуют пластины на теле; обе формы мономорфны по наличию киля (McPhail, 1963). Первая форма имеет прибрежное распространение от Аляски до Атлантического побережья, вторая распространена более континентально: Великие Озера (США), оз. Виннипег, бассейн р. Маккензи (Канада). Мак-Фейл (McPhail, 1963) полагает, что берингийская форма распространилась из берингийского рефугиума на восток, а миссисипская — на северо-запад и северо-восток после отступления ледника в плейстоцене (Висконсинское оледенение). Хотя период изоляции между двумя формами был недостаточным для видообразования, и эти формы способны к гибридизации. Мак-Фейл (McPhail, 1963) считает, что морфологические различия между ними имеют генетическую основу. Но, воздерживаясь от придания им таксономического подвидового статуса, Фостер (Foster, 1977) экспериментально показал, что между ними есть почти полная поведенческая репродуктивная изоляция.
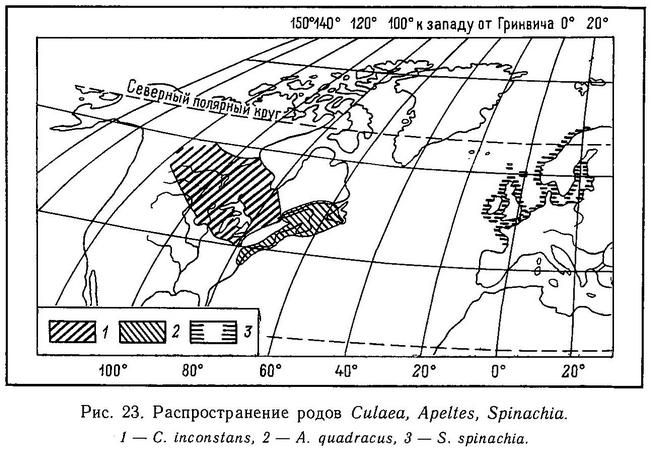
Culaea inconstans распространена в пресных континентальных водоемах Сев. Америки, ее ареал почти полностью перекрывается с распространением Pungitius pungitius, с севера и юга он ограничен широтами 60—40° с. ш., с запада — Скалистыми горами, с востока р. Св. Лаврентия (Nelson, 1969; Scott, Crossman, 1973). Мак-Фейл и Линдсей (McPhail, Lindsey, 1970) полагают, что Висконсинское оледенение в плейстоцене этот вид пережил в рефугиуме в верховьях Миссисипи (рис. 23).
Apeltes quadracus — морской вид, распространен по Атлантическому побережью Сев. Америки от побережья канадской провинции Квебек и о. Ньюфаундленд на севере до штата Вирджинии (США) на юге, 36—50° с. ш. (Blow, Hagen, 1984). Среди всех родов колюшковых (за исключением Gasterosteus aculeatus) у нее самый южный ареал. Он перекрывается частично с ареалами Gasterosteus aculeatus, Gasterosteus wheatlandi, Pungitius pungitius. В ряде мест Apeltes проникает по рекам вверх на расстояние до 20 км (на о. Ньюфаундленд, в штате Пенсильвания, США, — Laim, Scott, 1966; Dadswell, 1972).
Spinachia spinachia — морской вид, обитает в морях, омывающих Европу с запада. Распространен от севера Норвегии (71° с. ш.) до Бискайского залива на юге (45° с. ш.) (Bertin, 1925). Встречается в прибрежных водах вокруг Англии, Ирландии, Шетлейдских, Оркнейских, Фарерских островов, но отсутствует у Исландии. В Балтийском море по всему побережью, кроме кутовых частей Ботнического и Финского заливов (Wootton, 1976). Выдержвает понижение солености до 5 ‰ (Bertin, 1925).
Изложенные данные по распространению колюшковых и гипотезы по их расселению, к сожалению, не позволяют однозначно решить вопрос о центре происхождения семейства из-за того, что семейство насчитывает небольшое число видов (7—9 в зависимости от точки зрения систематиков), и из-за скудности ископаемых остатков его представителей. Кроме того, мозаичность эволюции разных систем признаков колюшковых: анатомических, морфологических, репродуктивного поведения, экологических, кариологических, количество ДНК (этот вопрос подробнее будет обсужден в разделе 4.2), не позволяет однозначно выявить наиболее примитивный вид, похожий на прародителя семейства. Это также затрудняет решение вопроса о центре происхождения семейства.
Apeltes и Culaea — эндемики Сев. Америки, Spinachia — Западной Европы, в то время как Gasterosteus и Pungitius обитают и в Евразии, и в Сев. Америке. В Сев. Америке обитают 4 рода, включая 5 видов (Gasterosteus aculeatus, Gasterosteus wheatlandi, Apeltes quadracus, Culaea inconstans, Pungitius pungitius), в Европе 3 рода, включая 4 вида (Spinachia spinachia, Gasterosteus aculeatus, Pungitius pungitius, Pungitius platygaster), и в Восточной Азии (на Тихоокеанском побережье) 2 рода, включая 4 вида (Gasterosteus aculeatus, Pungitius pungitius, Pungitius tymensis, Pungitius sinensis). Нетрудно видеть, что первенство по родовому и видовому разнообразию из всех трех континентов держит Сев. Америка.
Если же сравнивать бассейны Тихого и Атлантического океанов по видовому и родовому разнообразию колюшковых, то Атлантика (5 родов и 7 видов) явно превосходит Пацифику (2 рода и 4 вида). Преобладание североатлантических видов колюшек над северотихоокеанскими как будто указывает на атлантическое происхождение колюшек. Однако наличие в Тихом океане эндемичных представителей наиболее близкородственного к колюшкам из всех костистых рыб сем. Aulorhynchidae порождает сомнение в достоверности такого заключения. Это семейство включает всего 2 морских вида: Aulorhynchus flavidus (распространен от Аляски до Калифорнии) и Aulichthys japonicus (в морях около Кореи и Японии) (Clemens, Wilby, 1961). Морфологически они внешне сходны со Spinachia, а анатомическое сходство между Aulorhynchidae и Gasterosteidae простирается до деталей в анатомии скелета, причем по костям черепа между двумя семействами есть сходство по ряду особенностей, не встречающихся у других костистых рыб (Banister, 1967, — цит. по: Wootton, 1976). Анатомические различия между двумя семействами предполагают, что Aulorhynchidae менее специализированы, чем колюшки, и представляют собой эволюционную линию, меньше дивергировавшую, чем колюшки, от базового ствола костистых рыб (Nelson, 1971а; Wootton, 1976). Кроме того, некоторые особенности репродуктивного поведения Aulorhynchus flavidus (Limbauch, 1962) напоминают таковые Spinachia и Apeltes (см. раздел 2.8.1). Репродуктивное поведение Aulorhynchus можно рассматривать как примитивную форму более «продвинутого» поведения Gasterosteidae. Все это позволяет считать, что исходный предковый вид, давший начало сем. Gasterosteidae, мог обитать в Северной Пацифике. Кроме того, большинство ископаемых отпечатков колюшковых было обнаружено в бассейне Северной Пацифики, и они оказались намного древнее отпечатков, найденных в других местах (Штылько, 1934; Liu Hsien-T'ing, Wang Nien-Chung, 1974, — цит. no: Wootton, 1976; Bell, 1977; Сычевская, Гречина, 1981; Rawlinson, Bell, 1982). Удивительно только, что Spinachia — более всего похожий на предковый вид (морфологически, анатомически, экологически и с точки зрения репродуктивного поведения), обитает не в Пацифике, а в Европе, и трудно представить его тихоокеанское происхождение от Aulorhynchidae. Таким образом, на данном этапе мы не можем выбрать наиболее предпочтительный центр происхождения семейства.
Более ясным представляется вопрос о морском или пресноводном происхождении колюшковых. Эвригалинность колюшек, способность к нересту в морской воде большинства родов колюшек, находки самых древних ископаемых именно в морских отложениях, обитание наиболее примитивного рода Spinachia и ближайших родственников колюшковых — Aulorhynchidae в море приводят к мнению о первично морском происхождении семейства. Однако находки ископаемых отпечатков возраста 5—10 млн лет в пресноводных отложениях вдали от моря указывают на то, что освоение пресных вод интенсивно шло уже в миоцене и плиоцене и в Азии, и в Америке. Кроме того, находки отпечатков Gasterosteus в миоцене и Pungitius в плиоцене указывают, что разные роды колюшковых сформировались достаточно давно.
4. СИСТЕМА И ФИЛОГЕНИЯ
4.1. КРАТКИЙ ИСТОРИЧЕСКИЙ ОЧЕРК СИСТЕМЫ СЕМЕЙСТВА
Бертэн (Bertin, 1925) установил, что впервые сем. Gasterosteidae было выделено как самостоятельная группа Бонапартом в 1831 г., который объединил рыб, имеющих свободные и мобильные колючки и костный наружный скелет — боковые пластины (Bonapart, 1831). Он поместил это семейство в отряд Acanthopterygii (ныне Perciformes, — Берг, 1940). В настоящее время сем. Gasterosteidae входит в отряд Gasterosteiformes, надотряд костистые рыбы Teleostei, подкласс Teleostomi, класс Pisces (Никольский, 1971). До признания самостоятельности сем. Gasterosteidae колюшковых помещали в разные семейства отряда Scombriformes: Линней (Linnaeus, 1758) — в сем. Carangidae, Кювье (Cuvier, 1817) — в сем. Scombridae и Свэйнсон (Swainson, 1839) — в сем. Zeidae (цит. по: Bertin, 1925; с. 10).
Линней (Linnaeus, 1758), впервые употребивший термин Gasterosteus, в этот род включал помимо трехиглой колюшки также и девятииглых (ныне Pungitius), и пятнадцатииглых (ныне Spinachia). Кроме того, в род Gasterosteus помимо настоящих колюшек Линней включал рыб, обладающих спинными колючками перед спинным плавником, — Lichia и Naucrates, которые сейчас входят в сем. Carangidae (ставриды) (Никольский, 1971). Североамериканских колюшек, ныне входящих в роды Culaea (Kirtland, 1840) и Apeltes, сначала также описали как Culaea inconstans и Gasterosteus apeltes (Bertin, 1925; Nelson, 1969), так что в XIX в. сложилась такая ситуация, что почти все колюшковые входили в один род — Gasterosteus (Jordan, Starks, 1903; Jordan, Evermann, 1927).
Впервые Флеминг (Fleming, 1828) выделил в самостоятельный род Spinachia пятнадцатииглых (или морских) колюшек. Затем Гилл (Gill, 1861) выделил в самостоятельные роды трехиглых (Gasterosteus), девятииглых (Pungitius) и четырехиглых (Apeltes) колюшек. Наконец, Джордэн (Jordan, 1876) выделил в самостоятельный род Eucalia ручьевых колюшек. Таким образом, к концу прошлого века было выделено 5 родов колюшек (Bertin, 1925): Spinachia Fleming, 1828, Gasterosteus (Linne) Gill, 1861, Apeltes Gill, 1861, Pygosteus Gill, 1861, Eucalia Jordan, 1876.
В середине XX в. изменились родовые наименования двух последних в этом списке родов. Так, Витлей (Whitley, 1950) обнаружил, что наименование Eucalia преоккупировано американской бабочкой-нимфалидой (применено в 1861 г. как младший синоним родового названия бабочки Hypolimnas), и предложил наименование Culaea. Это наименование утвердилось в североамериканской систематической литературе (Nelson, 1969). Берг (1949) и Линдсей (Lindsey, 1962b) обнаружили, что родовое наименование Pungitius (Coste, 1848) имеет приоритет перед Pygosteus (Gill, 1861). Это наименование утвердилось в зоологической литературе (Берг, 1949; Wootton, 1976).
С тех пор родовые наименования всех 5 родов остались неизменными.
Еще в конце прошлого века предполагалось, что сем. Gasterosteidae является дериватом сем. Aulorhynchidae, которое является более примитивным (Gill, 1863). Гилл (Gill, 1885) считал, что переходным таксоном между этими двумя семействами является Spinachia. Лейнер (Leiner, 1934) рассматривал Apeltes как наиболее примитивный род колюшковых, но считал Apeltes и Spinachia наиболее близкими между собой, a Gasterosteus, Pungitius и Culaea — дериватами. Однако другие систематики считали 3 последних рода наиболее близкородственными между собой таксонами (Jordan, Gilbert, 1883). Гилл (Gill, 1885) делит семейство на 3 подсемейства: Apeltinae (Apeltes), Spinachinae (Spinachia), Gasterosteinae (Gasterosteus, Pygosteus, Eucalia), что отражает точку зрения Джордэна и Гилберта (Jordan, Gilbert, 1883). Бертэн (Bertin, 1925) делит семейство на 2 подсемейства: Gasterosteinae, идентичное по структуре выделенному Гиллом (Gill, 1885), и Apeltinae, куда входят Apeltes и Spinachia. Филогенетические отношения между родами колюшек подробнее будут рассмотрены в разделе 4.2, а филогенетические отношения семейства с соседними группами — в разделе 4.4.
История описания и классификации видов внутри каждого рода колюшковых была не менее сложной. Например, для рода Gasterosteus сложилась такая ситуация, что к началу XX в. было описано 42 вида (табл. 7). Это произошло вследствие обнаружения высокой изменчивости трехиглой колюшки, необъятности ее ареала и господствующего в то время типологического подхода в систематике. Многие виды были описаны всего по нескольким экземплярам. Бертэну (Bertin, 1925) в результате тщательного анализа географической и экотипической изменчивости морфологии колюшки, а также всестороннего исследования биологии удалось показать, что все эти «виды» связаны многочисленными переходными формами. Часть изменчивости находится под прямым контролем внешней среды или является возрастной и половой. «Даже если рассматривать колюшек из одной популяции, одного поколения и из одной кладки икры — среди них невозможно найти 2 идентичные особи с разных точек зрения», — писал Бертэн (Bertin, 1925, с. 152).

Он свел все 42 вида в 1 (Gasterosteus aculeatus), выделил 6 признаков, имеющих альтернативные варианты (всего 17 вариантов), и определил, что различные комбинации этих вариантов в итоге дают 300 возможных фенотипов (правда, некоторые сочетания «запрещены», например trachura—apoda, — В. 3.).
Признаки, выделенные Бертэном, следующие.
Список видов рода Gasterosteus, синонимизированных Бертэном (Bertin, 1925) в Gasterosteus aculeatus
1. Степень вооружения боков пластинами: пластины идут от головы до хвостового плавника (trachura), пластины только спереди и на хвостовом стебле (semiarmata), то же, но хвост голый (gymnura = leiura), пластин и киля совсем нет (hologymna), тело голое, но киль есть (carinata).
2. Число колючек в D: 3 — teraculeata, 4 — tetracantha, 2 — biarmata.
3. Форма тела рыбы: высокая (brevis), удлиненная (gracilis).
4. Длина колючек в D: короткие — brachycentra, длинные — dolichocentra.
5. Длина колючек в V: короткие — brachypoda, длинные — dolichopoda, нет колючек — apoda.
6. Зазубренность колючек: гладкие — leiocentra, зазубренные — trachicentra.
Например, фенотип какой-либо колюшки можно охарактеризовать: gymnura — teraculeata — brevis — dolichocentra — dolychopoda — leiocentra.
Все эти фенотипы не имеют приуроченности к определенным географическим районам. В дальнейшем систематики согласились, что все разнообразие форм можно рассматривать как выражение изменчивости одного политипического и полиморфного таксономического вида Gasterosteus aculeatus-complex, и после работы Бертэна (Bertin, 1925) описание таксономических видов в роде Gasterosteus в целом прекратилось. Была, правда, недавно сделана одна такая попытка Хагеном (Hagen, 1967), который обнаружил в ручьях Британской Колумбии (Канада) репродуктивную изоляцию двух морфологически отличимых парапатрических форм: морской (trachurus) и жилой (leiurus). Морскую он назвал Gasterosteus trachurus, а жилую Gasterosteus aculeatus. Его классификацию не приняли, и Хаген в дальнейшем сам отказался от этой таксономической классификации (Hagen, McPhail, 1970). Тем не менее эта работа Хагена, а также последующие работы его и соавторов выявили интереснейшую эволюционную ситуацию, когда в одних местах формы ведут себя «как виды», а в других те же формы могут широко гибридизировать, вдлоть до слияния (Bell, 1984). Более подробно проблема вида в роде Gasterosteus будет рассмотрена в разделе 4.5.6.
В списке 42 видов трехиглых колюшек, которые Бертэн (Bertin, 1925) свел в 1 вид, под номером 27 (табл. 7) фигурировал Gasterosteus wheatlandi Putnam, 1866. Недавними исследованиями американских ихтиологов была доказана полная самостоятельность этого вида (Reisman, 1968b; Mclnerney, 1969).
Таким образом, сейчас в роде Gasterosteus признается 2 таксономических вида: Gasterosteus aculeatus species-complex и Gasterosteus wheatlandi (Wootton, 1976; Bell, 1984).
В роде Pungitius к началу XX в. также было описано 19 видов (табл. 8), которые Бертэн (Bertin, 1925) свел в 1 — Pygosteus pungitius. Мюнцинг (Münzing, 1969), хотя формально признал существование 2 видов: Pungitius pungitius и Pungitius platygaster, до окончательного выяснения вопроса поддержал такое объединение, однако Берг (1949) с этим не согласился. Берг (1949, с. 965) выделяет 4 вида: Pungitius pungitius (с двумя подвидами Pungitius pungitius pungitius и Pungitius pungitius sinensis), Pungitius tymensis, Pungitius laevis, Pungitius platygaster (с двумя подвидами Pungitius platygaster platygaster и Pungitius platygaster aralensis). С сохранением видовой самостоятельности Pungitius pungitius и Pungitius platygaster согласились в дальнейшем европейские (Wootton, 1976; Gross, 1979) и американские (Bell, 1984) исследователи, которые, однако не признали видового статуса Pungitius laevis и Pungitius tymensis, но вслед за Бергом (1949) признают подвидовой статус Pungitius pungitius sinensis (Wootton, 1976; Bell, 1984). Однако японские исследователи (Kobayashi, 1957; Tanaka, 1982, и мн. др.) считают pungitius, sinensis и tymensis самостоятельными видами на Дальнем Востоке. Таким образом, таксономическая ситуация в роде Pungitius до сих пор остается запутанной. Подробнее проблема вида в роде Pungitius будет обсуждена в разделе 4.5.6.
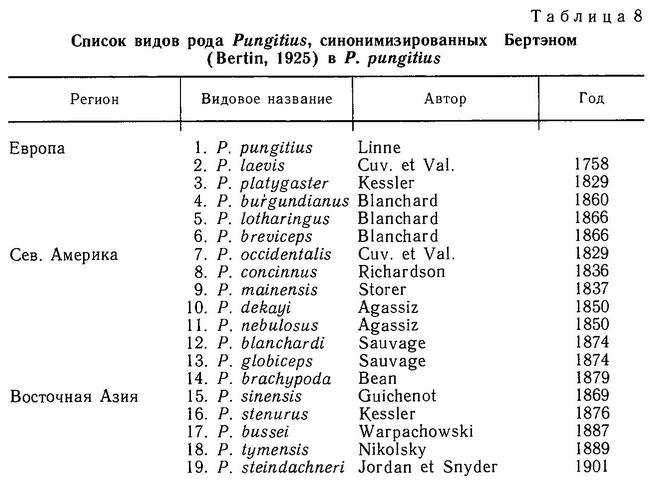
В роде Culaea (= Eucalia) с 1840 по 1876 г. было описано 4 вида (Eucalia inconstans, Eucalia pygmaeus, Eucalia micropus, Eucalia kayaga) на основании изменчивости по числу лучей в плавниках, колючек, формы тазового пояса и формы тела. В дальнейшем были найдены многочисленные промежуточные формы между этими видами (Eigenmann, 1886; Wagner, 1910; Bertin, 1925). На основании этого Бертэн (Bertin, 1925) свел их в 1 вид Eucalia inconstans Kirtland. Последующие исследователи колюшек рода Culaea согласились с оправданностью выделения, только 1 вида (Nelson, 1969).
В роде Apeltes в прошлом веке были описаны 3 вида (Apeltes qudracus, Apeltes apeltes, Apeltes millepunctatus). Эйнгенман (Eingenmann, 1886) свел их в 1 — Apeltes quadracus, с чем охотно согласился Бертэн (Bertin, 1925), также изучавший изменчивость Apeltes. В дальнейшем классификация Apeltes не менялась.
Из-за слабо выраженной изменчивости Spinachia оказался единственным родом колюшковых, где первоначально не было описано несколько видов. С самого начала Линней (Linnaeus, 1758) описал его как один вид Gasterosteus spinachia, что так и осталось до наших дней (Spinachia spinachia).
Таким образом, с прошлого века до выхода работы Бертэна (Bertin, 1925) объем сем. Gasterosteidae сократился с 69 видов до 5, но потом несколько возрос, до 7 (Wootton, 1976) или 9 (Берг, 1949) видов. Однако все исследователи сем. колюшковых согласны, что группа включает в себя 5 родов, 3 из которых монотипны (Culaea, Apeltes и Spinachia), а 2 рода Gasterosteus и Pungitius могут включать в себя несколько видов и форм, систематика которых запутана и является предметом споров.
4.2. ПРИНЦИПЫ КЛАССИФИКАЦИИ РОДОВ ВНУТРИ СЕМЕЙСТВА
Дифференцировка родов внутри сем. Gasterosteidae не вызывает каких- либо затруднений из-за их резкого морфологического обособления друг от друга. В принципе все 5 родов отличаются друг от друга по числу спинных колючек, что и отражено в родовых названиях: Gasterosteus — трехиглые колюшки, Pungitius — девятииглые, Culaea — ручьевая, или пятииглая, колюшка, Apeltes — четырехиглая, Spinachia — морская, или пятнадцатииглая (изменчивость по числу спинных колючек внутри каждого рода описана в разделе 1.6). Кроме различий по числу спинных колючек все роды хорошо отличаются друг от друга по другим морфологическим и анатомическим признакам, а также по экологии, числу хромосом, репродуктивному поведению. Нельсон (Nelson, 1971а) дает наиболее подробный диагноз родов (табл. 9).

Гораздо более сложной проблемой является установление эволюционных взаимоотношений между родами. Для построения эволюционного древа необходимо выявить, какой род является наиболее примитивным и какие роды, ближе всего стоят друг к другу. Ископаемые остатки Gasterosteidae скудны, и поэтому приходится сравнивать ныне живущие роды. Но при таком сравнении возникает извечная проблема, с которой сталкиваются исследователи, восстанавливающие филогенез какой-нибудь группы: отражает ли сходство признаков, сравниваемых таксонов генетическое родство, или оно является результатом конвергенции, так как сходные биологические проблемы нередко решаются организмами сходными путями.
Межродовые взаимоотношения внутри сем. Gasterosteidae изучались многими авторами (Bertin, 1925; Leiner, 1934; Reisman, 1963; Banister, 1967; Chen, Reisman, 1970; Nelson, 1971a; Mural, 1973; Hall, 1956, — цит. по: Wootton, 1976; Wootton, 1976) на базе морфологических, анатомических, кариологических и физиологических, экологических и этологических признаков.
Базируясь на данных этих авторов, мы попытались в табличной форме показать, как группируются роды колюшковых при сравнении по разным признакам (табл. 10—13).

Анализ 10 морфологических признаков (табл. 10) показывает, что роды объединяются в разнообразных комбинациях, но чаще группируются Gasterosteus и Culaea (в 6 случаях из 10), Gasterosteus и Pungitius (5 из 10), Pungitius и Culaea (5 из 10). Самый морфологически обособленный от всех других род — Spinachia, он отличается вытянутым прогонистым телом и тонким хвостовым стеблем, трубковидным ртом, гораздо большим числом спинных колючек, позвонков и боковых костных пластинок, чем у других колюшковых. Хвостовой стебель Spinachia заключен полностью в костный панцирь из слившихся боковых и медиальных костных пластинок, А- и D-плавники маленькие и треугольные, брюшные плавники сильно сдвинуты назад относительно грудных по сравнению с другими родами. Вуттон (Wootton, 1976, с. 321) в своей сводке отмечает, что «морфологические признаки колюшек образуют мозаичную картину, и невозможно разобраться, где более примитивный и менее специализированный род». Однако мне представляется достаточно очевидным, что Spinachia более всего похожа на примитивный предковый вид. Перечисленный выше морфологические особенности Spinachia резко отличают ее от других колюшковых и напоминают морфологию Aulorhynchidae, описанную Нельсоном (Nelson, 1971а), и морфологию Syngnatidae (Никольский, 1971). Кроме того, достаточно очевидно морфологическое сходство Gasterosteus, Pungitius и Culaea, a Apeltes по разным признакам по-разному группируется со всеми 4 родами колюшковых и действительно имеет «мозаичный» набор особенностей разных признаков.

Рассмотрение 10 анатомических признаков (табл. 11) также позволяет видеть, что наиболее часто группируются между собой Gasterosteus, Pungitius и Culaea: или попарно (С—Р — 8, С—G — 7 и Р—G — 6 раз) или все 3 рода вместе (6 раз). В данном случае не рассматривались признаки плечевого пояса, поскольку он состоит из 6 элементов (см. табл. 11) и по каждому из них роды группируются по-разному, так что трудно наметить общие тенденции в группировании родов по грудному скелету. Нельсон (Nelson, 1971а), специально изучавший в сравнительном плане строение плечевого пояса колюшковых, вскрыл большое разнообразие элементов, его составляющих. В общем плечевой пояс сходен у Pungitius и Gasterosteus, но в частности Spinachia и Pungitius имеют сходное строение эктокоракоида и скапула, Apeltes и Culaea имеют сходный клейтрум, а также два последних рода (и в меньшей степени Pungitius) имеют следы отверстия в коракоиде, отсутствующие у Gasterosteus и Spinachia (отверстие коракоида хорошо развито у Aulorhynchidae). Тем не менее Нельсон (Nelson, 1971а) заключает, что по плечевому поясу остается неясной картина примитивных и «продвинутых» признаков. Он считает, что по признаку «следы отверстия в эктокоракоиде» можно поместить Apeltes, Culaea и Pungitius между Aulorhynchidae и Gasterosteus + Spinachia. К тому же форма эктокоракоида Apeltes и Culaea также ближе всего к Aulorhynchidae.
По числу мягких лучей в брюшном плавнике (2 луча) Spinachia и Apeltes являются промежуточными между Aulorhynchidae (у которых большее число лучей — 4) и остальными колюшковыми (у которых меньшее число — 1). По строению тазового пояса Нельсон (Nelson, 1971а) выявил наибольшее сходство между Gasterosteus, Pungitius и Culaea и делает вывод об их общем происхождении. В то же время тазовые пояса Spinachia и Apeltes отличаются от трех вышеуказанных родов и сильно различаются между собой. Сходство в форме и расположении передних и задних отростков брюшной пластины Spinachia и Aulorhynchidae вовсе не означает, по мнению Нельсона, их общего происхождения. Тем не менее на основании анализа плечевого и тазового поясов Gasterosteidae и Aulorhynchidae Нельсон (Nelson, 1971а) приходит к выводу, что Spinachia ближе всего находится к предку колюшковых, хотя имеет много различий с Aulorhynchidae, чтобы считаться эволюционно промежуточным таксоном между Gasterosteidae и Aulorhynchidae. Эти два семейства, по его мнению, имеют общее происхождение.
На основании анализа костей черепа, челюстей и гиоидной дуги Банистер (Banister, 1967,— цит. по: Wootton, 1976), Кампф (Kampf, 1962) и Мурал (Mural, 1973) пришли к выводу о близком сходстве между собой Gasterosteus, Pungitius, Culaea и обособлении от этой группы Apeltes и Spinachia при резких различиях двух последних между собой. Например, многие особенности скелета головного отдела Spinachia связаны с ее сильно вытянутым рылом. Так, передний край орбиты глаза Spinachia расположен далеко позади челюстного сочленения, очень удлинен задний отросток птеригоидной кости, гиомандибуляре (задний элемент челюстного сочленения, связывающий ее с нейрокраниумом) образует острый угол с осью тела, что связано с удлинением головы, кость симплектик также вытянута (Mural, 1973). У Apeltes самое сильно развитое среди всех родов сочленение между гиомандибуляре и метаптеригоидом — двумя элементами челюстного сочленения, что связано с особенностями вентиляции гнезда Apeltes — путем всасывания (Banister, 1967, — цит. по: Wootton, 1967).
Рассматривая морфолого-анатомические признаки в целом, можно предположить наибольшую примитивность Spinachia, тесное родство Gasterosteus, Pungitius, Culaea и обособленность Apeltes, обладающего «смесью» консервативных (= примитивных) и «продвинутых» (= специализированных) признаков.
Ниже приведено попарное сравнение сходства 5 родов по 17 элементам репродуктивного поведения (исходные данные взяты из табл. 12, обозначения родов в табл. 10).
Анализ 17 этологических признаков (гнездостроение, ухаживание за самкой и забота о потомстве) показывает, что роды объединяются в разнообразных комбинациях, но наибольшее сходство наблюдается между Pungitius и Culaea (сходство по 14 элементам из 17), на втором месте по сходству пары Gasterosteus — Pungitius и Culaea — Spinachia (в обеих парах сходства по 9 элементам из 17), наименьшее сходство обнаруживают пары Gasterosteus — Apeltes (2 из 17) и Pungitius — Apeltes (4 из 17).

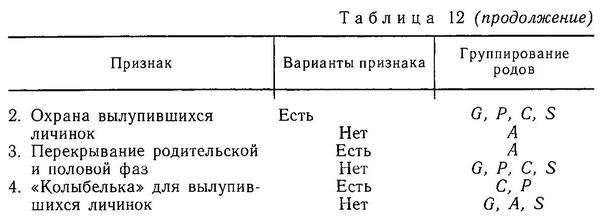
В принципе характер репродуктивного поведения сравнивался у всех родов ранее в разделе 2.8, но в контексте эволюционных взаимоотношений между родами и установления наиболее примитивных и «продвинутых» родов по репродуктивному поведению можно попытаться сделать некоторые заключения. По архитектуре гнездо Spinachia (полый шар без входа и выхода) можно рассматривать как исходное, а гнезда остальных колюшек как модификации этого первоначального типа: усложненные модификации — гнездо Culaea (с входом), еще более сложные гнезда Gasterosteus и Pungitius (с входом, выходом и тоннелем). Упрощенная модификация — открытое чашеобразное гнездо Apeltes (у этого рода, возможно, усложнение гнезда идет по другому пути — многоярусности гнезд). Безусловно, прогрессивным актом в гнездостроении является переход Gasterosteus к гнездованию на грунте — этим было обеспечено освоение новой зоны водоемов: выход в открытую часть водоема и уход от растительной зоны. Если учесть, что не в каждом водоеме на литорали есть зона укореняющихся растений, то становится ясным, что Gasterosteus могли осваивать новые типы водоемов.
О прогрессивных или примитивных элементах в брачном ритуале трудно говорить, поскольку ухаживание имеет основной функцией репродуктивную изоляцию (а также синхронизацию половой активности самца и самки и ориентирующую функцию). Все же можно, видимо, считать наиболее простым и неспециализированным характер ухаживания у Spinachia (простое и агрессивное приближение по прямой линии самца к самке, отсутствие брачной окраски), хотя самец Spinachia стимулирует самку к вымету икры щипанием хвоста аналогично Apeltes (имеющего в целом сложное ритуальное поведение). Самцы 3 других родов делают это иначе — тормошением. Ухаживание у всех родов (кроме Spinachia) имеет сложный рисунок и отличается межродовым разнообразием. Среди них невозможно выделить более «прогрессивные» и «примитивные» роды. Отметим только, что при ведении самки к гнезду самцы Pungitius и Gasterosteus выполняют «зигзаг-танец» и «прыжки», a Apeltes и Culaea на этой фазе «тузят» самок, кроме того, самец Apeltes еще и выполняет элемент «спираллинг». Gasterosteus уникален тем, что в сексуальную фазу самца «вписываются» дополнительный цикл гнездовой активности и особый элемент «дорсал прикинг».
Родительское поведение, видимо, наиболее «продвинуто» у Pungitius и Culaea: самцы строят «люльку» для вылупившейся молоди и выполняют элемент «вставочное склеивание гнезда» во время его «ремонта», но, возможно, сходство здесь конвергентное из-за сходной «нерестовой ниши» — растительной зоны в литорали пресноводных водоемов. Apeltes не ухаживает за выклюнувшейся молодью (примитивный признак, на первый взгляд), но, возможно, это является следствием уникальной временной организации нереста — совмещения родительской и сексуальной фаз, охраны многих гнезд и разновременности вылупления икры. Кроме того, у Apeltes имеется уникальный элемент вентиляции икры — «всасывание» (все другие колюшки вентилируют гнездо движением плавников). Таким образом, у Apeltes наблюдается удивительная смесь примитивных и «продвинутых» признаков родительского поведения.
В целом можно сказать, что Gasterosteus, Pungitius и Culaea имеют наиболее сложный и высокоорганизованный характер гнездостроения, ухаживания и родительского поведения. Неудивительно, что 3 этих рода имеют самое широкое распространение в северном полушарии. Spinachia имеет наименее сложный «репертуар», a Apeltes обнаруживает мозаичную смесь примитивных и прогрессивных признаков. Причем 2 последних рода обнаруживают сходство с размножением Aulorhynchus flavidus (Aulorhynchidae). Самец Aulorhynchus откладывает сетевидные пучки клея на растения (как Spinachia), куда помещает икру, но кладки икры расположены на растении ярусами (Limbauch, 1962), как у Apeltes. Создается впечатление, что усложнение репродуктивного поведения от Aulorhynchus могло пойти по двум линиям: к Apeltes и к Spinachia.
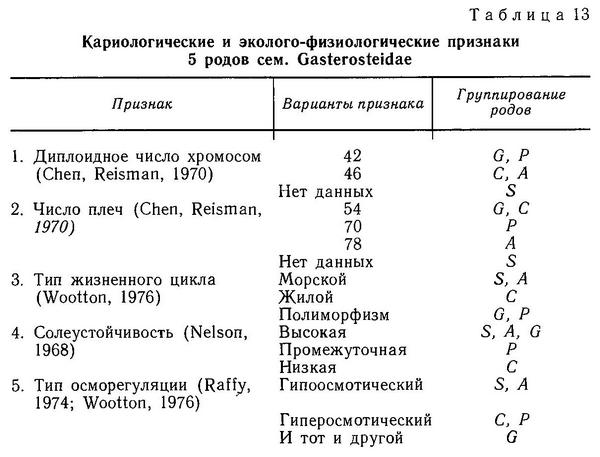
На базе кариологического анализа всех родов колюшковых (не исследован Spinachia) Чен и Рейсман (Chen, Reisman, 1970) делят их на две группы: 2n = 46 (Apeltes и Culaea) и 2n = 42 (Gasterosteus и Pungitius) (табл. 14). Одинаковое местонахождение в кариотипах пары крупных субметацентрических хромосом указывает на монофилетическое происхождение всех родов. Роды с кариотипом 42 хромосомы рассматриваются авторами как более прогрессивные. Кроме того, Culaea занимает промежуточное положение (рис. 24) между линией Gasterosteus—Pungitius и линией Apeltes, поскольку этот род имеет наибольшее число хромосом, но в то же время наименьшее число плеч (табл. 14) Авторы дают гипотетическую филогенетическую схему и приходят к выводу о наибольшей филогенетической близости Gasterosteus, Pungitius, Culaea, рассматривая Apeltes как более «модифицированную» (чем Culaea) боковую ветвь от общего предка колюшковых (Chen, Reisman, 1970, с. 329), в то время, как Culaea — есть «консервативное производное» от того же предка.
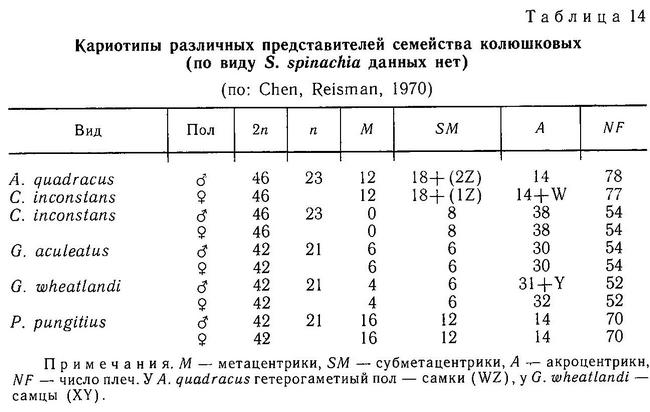
Хайнегарднер (Hinegardner, 1968) и Хайнегарднер и Розен (Hinegardner, Rosen, 1972) получили обширные данные (на 275 видах) по количественному содержанию ДНК у костистых рыб. Уровень гаплоидного содержания ДНК колебался от 4.4 до 0.4 пг (10—12 г) у всех видов. Авторы нашли общую тенденцию к уменьшению количества ДНК у более «продвинутых» и специализированных видов внутри каждого семейства. Интересно, что у колюшковых оказался очень маленький «размер генома» 0.67—0.7 пг, только 6 % изученных видов имели еще меньшее количество ДНК. Количество ДНК у Gasterosteus (0.7) и Culaea (0.67) почти одинаково, а у Apeltes значительно меньше (0.57). Это означает, что среди этих 3 изученных родов Apeltes наиболее продвинут и специализирован. Данные по ДНК противоречат анатомо-морфологическим и физиологическим данным.

Нельсон (Nelson, 1968b) обнаружил, что среди всех родов самую низшую солеустойчивость имеет Culaea (см. раздел 2.7). Если верно морское происхождение Gasterosteidae (а это, по-видимому, так), то Culaea можно рассматривать как наиболее специализированный род, что противоречит, например, кариологическим и биохимическим данным.
Для установления филогенетических отношений в семействе еще не применялись, за исключением работы Пенчака (Penczak, 1961), современные биохимические методы: иммунология, электрофорез, анализ аминокислотных последовательностей белков, гибридизации ДНК и т. д. Хотя, возможно, и они не прояснят ситуацию, поскольку и новые системы признаков также могли быть подвержены разнотемповости эволюции и всё в итоге даст мозаичную картину. В целом же все систематики, изучавшие в последние десятилетия это семейство, согласны, что колюшковые — естественная монофилетическая группа с общим предком, где каждый род отчетливо отделен от других. Spinachia наиболее близок к Aulorhynchidae. Gasterosteus, Pungitius и Culaea представляют монофилетическую группу уже внутри семейства, хотя и взаимоотношения этих родов неясны. Apeltes не является близкородственной к любому из других родов. Ни один из ныне живущих родов нельзя считать предковым. Филогенетические схемы разных авторов приведены на рис. 25, и в целом схемы Вуттона (Wootton, 1976) и Чена и Рейсмана (Chen, Reisman, 1970) мне представляются наиболее правдоподобными (в сущности обе они одинаковы и отличаются только тем, что в последней (рис. 24) не анализируются Spinachia и Aulorhynchidae).
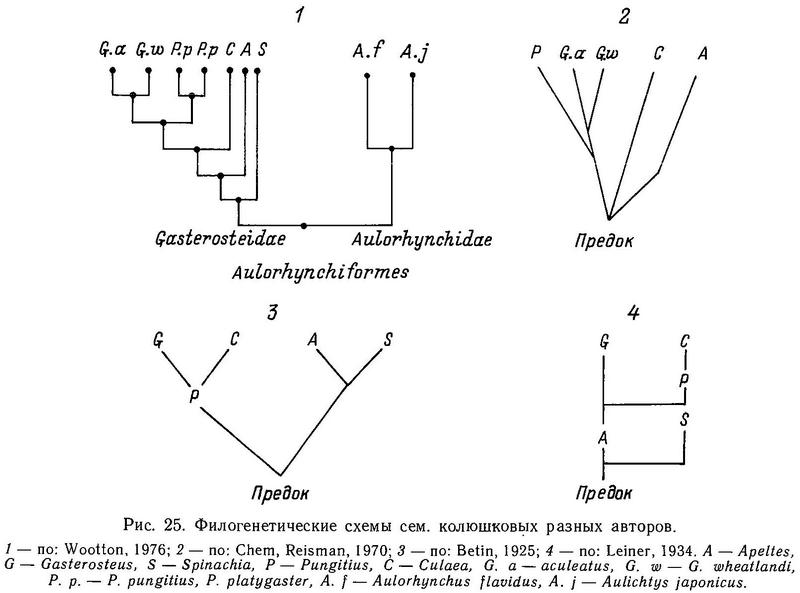
4.3. ПАЛЕОНТОЛОГИЧЕСКИЕ ДАННЫЕ
В связи с небольшим количеством находок ископаемых остатков Gasterosteidae история семейства остается до сих пор малоизвестной. Удивительно, что до сих пор были описаны только ископаемые родов Gasterosteus и Pungitius, самых продвинутых и, очевидно, молодых родов. Белл (Bell, 1984), один из специалистов по палеонтологии колюшковых, утверждает, что «ископаемые остатки Gasterosteus и Pungitius полностью неинформативны в отношении филогении» (с. 436). Все ископаемые датируются миоценом, плиоценом и плейстоценом и найдены в морских и пресноводных отложениях Западной Сибири, Северного Китая, Аляски, Калифорнии, Невады (США) и не обнаружены в хорошо изученной пресноводной палеоихтиофауне Европы. В целом можно сказать, что миоценово-плиоценовые ископаемые колюшек приурочены к бассейну Тихого океана и в меньшей степени Северного Ледовитого океана.
Род Gasterosteus. Впервые ископаемые остатки Gasterosteus были обнаружены в плиоценовых пресноводных отложениях штата Невада (США) Хэй (Hay, 1907) и Джорданом (Jordan, 1907, 1908). Джордан (Jordan, 1908) назвал ископаемый вид Gasterosteus doryssus. По его мнению, Gasterosteus doryssus отличается от Gasterosteus williamsoni (по терминологии Миллера и Хаббса — Miller, Hubbs, 1969 — Gasterosteus aculeatus williamsoni) более удлиненным телом и более длинными колючками. Мурал (Mural, 1973), изучивший голотип Gasterosteus doryssus, отмечал, что у древней колюшки отсутствуют боковые пластины, имеются 3 спинные колючки, нормально развитый тазовый пояс и несколько меньшее число лучей в спинном плавнике в сравнении с Gasterosteus aculeatus, что может быть связано с условиями захоронения. Таким образом, этот ископаемый вид почти не имеет отличий от Gasterosteus aculeatus.
Мурал (Mural, 1973) описал новый ископаемый вид из пресноводных плиоценовых отложений Невады — Gasterosteus apodus, отличающийся редукцией костных пластин, первой спинной колючки и тазового пояса. Однако у многих североамериканских популяций современной Gasterosteus aculeatus наблюдается редукция спинных и брюшных колючек, тазового пояса и боковых пластин (Bell, 1984), так что в этом смысле Gasterosteus apodus не выходит за рамки изменчивости Gasterosteus aculeatus. Дэвид (David, 1945, — цит. по: Bell, 1973) описал из среднеплиоценовых пресноводных отложений Калифорнии (США) ископаемый вид Pungitius haynesi, который Белл (Bell, 1973) переисследовал и отнес к Gasterosteus aculeatus на основании наличия расщепленной гипуральной пластины — важного диагностического признака Gasterosteus. У этого ископаемого отсутствуют костные пластины, частично редуцирован тазовый пояс и нет первой спинной колючки. У всех вышеописанных пресноводных плиоценовых колюшек, а также у описанной Беллом (Bell, 1973) плейстоценовой пресноводной колюшки отсутствовали боковые костные пластины или их число было сильно редуцировано, т. е. они принадлежали к морфам leiurus и hologymna. Однако в Восточной Канаде (Онтарио) Мак-Алистер с соавт. (McAlister et al., 1981) в плейстоценовых пресноводных отложениях обнаружили trachurus, и сейчас там в пресноводных водах доминирует trachurus.
В 1977 г. Белл описал из морских позднемиоценовых отложений (возраст 10 млн лет) Южной Калифорнии ископаемую Gasterosteus aculeatus (форма trachurus) (Bell, 1977). Она ничем не отличалась от современной морской формы trachurus трехиглой колюшки кроме взаимного расположения начала спинного и анального плавников. Если у современной Gasterosteus aculeatus спинной плавник сдвинут несколько вперед по сравнению с анальным, то у позднемиоценовой Gasterosteus aculeatus спинной плавник располагается точно над анальным (так же, как у современной Pungitius и Culaea) (Nelson, 1971). Белл (Bell, 1977) предположил, что миоценовая Gasterosteus aculeatus менее дивергировала от Pungitius и Culaea, но тут же сам себя опроверг, отметив, что у более примитивных родов Spinachia и Apeltes спинной плавник сдвинут вперед, так что изменение расположения D-плавника вряд ли отражает филогенетические отношения.
Белл и Хаглунд (Bell, Haglund, 1982) исследовали позднемиоценовую Truckee — формацию в штате Невада, содержащую остатки Gasterosteus doryssus в интервале 150 тыс. лет. Они обнаружили, что за интервал в 36 тыс. лет частота особей с 1 спинной колючкой падает с 69 до 21%., а доля «бесколючковых» особей за это время увеличивается с 29 до 79 %. Авторы рассчитали увеличение частоты бесколючковых особей — 0.137 х 10-3 в год при объеме выборки в несколько сотен особей (n = 450).
Ископаемые среднемиоценовые колюшки были недавно найдены на Дальнем Востоке (СССР) (Сычевская, Гречина, 1981). Один вид — Gasterosteus abnormis — был описан по 2 отпечаткам в среднемиоценовых морских отложениях Западного Сахалина (возраст их, очевидно, 16 млн лет — В. З.). Он имеет фенотип trachurus (38 пластин, что превышает верхний предел колебаний у современных trachurus — 35) и отличается от современных Gasterosteus aculeatus расположением, спинных колючек, передние 2 из которых у него сильно сближены, хотя Миллер и Хаббс (Miller, Hubbs, 1969) отмечали то же самое для калифорнийских современных колюшек Gasterosteus aculeatus williamsoni. Задний отросток брюшной пластины тазового пояса у Gasterosteus abnormis сильно укорочен, но редукции тазового пояса и брюшной колючки нет.
Другой вид — Gasterosteus orientalis был описан по 5 отпечаткам из среднемиоценовых пресноводных отложений бассейна р. Ковавля (Камчатка) и имел фенотип semiarmatus (10+8 боковых пластин). У него 4 спинные колючки, удлиненное рыло и 3 мягких луча в брюшном плавнике (Сычевская, Гречина, 1981). Линдсей (Lindsey, 1962) показал, что воздействие повышенной температуры в онтогенезе трехиглой колюшки может индуцировать фенотипы с 4 колючками; кроме того, Гросс (Gross, 1978), нашел, что в некоторых современных пресноводных популяциях Западной Европы встречаемость особей с 4 колючками достигает 17 %.
Из всех признаков этих 2 новых видов безусловно самый серьезный — наличие 3 мягких лучей в брюшном плавнике, все остальные особенности вполне «вписываются» в пределы колебаний признаков современных Gasterosteus aculeatus. 3 мягких луча в брюшном плавнике не встречаются ни у одного из современных родов Gasterosteidae (только 0—2 луча), но отмечено у неогеновой Pungitius, что дало основание Штылько (1934) выделить палеоколюшку в новый род Gasterosteops, но было поставлено под сомнение Бергом (1940). У близких родственников колюшек — представителей сем. Aulorhynchidae — 4 луча в этом плавнике (Nelson, 1971а), поэтому 3-лучевую Gasterosteus orientalis поданному признаку можно рассматривать как переходную между Aulorhynchidae и Gasterosteidae, однако серьезное филогенетическое значение это вряд ли имеет. В целом можно заключить, что все ископаемые находки Gasterosteus приурочены к азиатскому и североамериканскому побережьям Северной Пацифики — морские находки имеют возраст примерно 10—16 млн лет и представлены фенотипом trachurus, а пресноводные находки — 3—8 млн лет и представлены фенотипами hologymna и leiurus. Эти факты предполагают связь возникновения Gasterosteus именно с этим районом (вспомним, что Aulorhynchidae обитает также в этой части Тихого океана). Однако такое заключение вряд ли следует рассматривать как «истину в последней инстанции», и, возможно, более тщательные поиски ископаемых Gasterosteus в других районах увенчаются успехом и перевернут наши представления о центре возникновения рода.
Род Pungitius. Известны всего 3 находки Pungitius: из Западной Сибири (Штылько, 1934), северного Китая (Liu, Wang, 1974, — цит. по: Rawlinson, Bell, 1982) и Аляски (США) (Rawlinson, Bell, 1982).
Штылько (1934) по 7 отпечаткам описал новый род Gasterosteops из пресноводных плиоценовых отложений Западной Сибири (среднее течение Иртыша и Ишима). По всем меристическим признакам, размерам и пропорциям тела он не отличается от Pungitius pungitius, кроме 2 признаков: перед спинным плавником у Gasterosteops hexacanthus 5—6 колючек и в брюшном плавнике кроме колючки имеются 3 мягких луча. Тело голое, без щитков, и анальный плавник начинается под началом спинного так же, как у современной Pungitius. По числу спинных колючек Штылько (1934, с. 61) был склонен рассматривать род Gasterosteops как переходный между Pungitius и Culaea (= Eucalia), однако отмечал, что плохая сохранность отпечатков недостаточна для сравнения Gasterosteops с этими 2 родами. Нужно сказать, что число колючек у Gasterosteops вполне «вписывается» в размах колебаний числа колючек у современной Pungitius. Так, Уре (Ure, 1962, — цит. по: Nelson, 1971а) описал из Ирландии Pungitius pungitius с меньшим числом колючек, чем модальное 8—10, вплоть до того, что ему попадались колюшки с 1 колючкой. Берг (1940, с. 288) полагал, что Gasterosteops вряд ли отделим от Pungitius, так как «у Pungitius иногда бывает 6 спинных колючек и 2 брюшных неколючих луча». Плиоценовых Pungitius обнаружили в Северном Китае Лиу и Ванг (Liu, Wang, 1974, — цит. по: Rawlinson, Bell, 1982), однако этой работой я, к сожалению, не располагаю.
Ролинсон и Белл (Rawlinson, Bell, 1982) описали ископаемую Pungitius из плиоценовых прибрежно-морских отложений п-ова Кенаи (Аляска, США). Возраст ее определен авторами радиоуглеродным методом довольно точно — 7.2—6.9 млн. лет. Судя по отпечатку, рыба имела 9 спинных колючек, 15—20 боковых пластин, а в брюшном плавнике 1 колючку и 1 мягкий луч, ничем не отличаясь от современных Pungitius, по остальным признакам она была также схожа с Pungitius, кроме строения тазового пояса: восходящая дуга брюшной пластины пояса направлена не вверх (как у современных колюшек) , а вниз, что, впрочем, может быть связано, по мнению авторов, с условиями захоронения. Крупные размеры рыбы — стандартная длина тела 72.5 мм, а также наличие боковых пластин, длинные брюшные и спинные колючки позволяют авторам делать вывод, что палеоколюшки находились под прессом хищников. Запутанная внутривидовая таксономия, изменчивость Pungitius и неполное сохранение отпечатка не дают оснований для определения до вида этого ископаемого экземпляра (Rawlinson, Bell, 1982).
Вопреки скептическому отношению Белла (Bell, 1984) к возможностям получения ценной (с точки зрения филогенеза) информации из скудных палеоданных по колюшковым, можно заключить, что эти данные помогли пролить свет на некоторые неясные моменты в картине исторического развития и направления эволюции в группе. Например, стало ясно, что род Gasterosteus сформировался в основном уже в среднем миоцене и исходным для него была прибрежно-морская форма trachurus с анадромным циклом, приуроченная к Североамериканскому и Азиатскому побережьям Северной Пацифики. Дифференциация Gasterosteus на анадромную trachurus и пресноводную leiurus — hologymna произошла уже в нижнем плиоцене, а не в плейстоцене, как это считал Мюнцинг (Münzing, 1959, 1963). Все находки неогеновых Gasterosteus не выходят за рамки современного его ареала, так что ареал в основном сформировался уже 10 млн. лет назад.
Плиоценовые находки Pungitius указывают на разделение родов уже в неогене, по крайней мере не позднее 7 млн лет тому назад. Все находки ископаемых Pungitius также не выходят за рамки современного ареала рода. Интересно, что находка плиоценового ископаемого экземпляра Pungitius на Аляске (Rawlinson, Bell, 1982) подтвердила более ранние представления Мюнцинга (Münzing, 1969) о предке Pungitius как о «морском типе», полностью «околюченном и опластиненном», однако плиоценовая находка Pungitius в Западной Сибири опровергла представления Мюнцинга о происхождении понтокаспийско-аральского вида Pungitius platygaster. Он полагал, что предками современных Pungitius platygaster были Pungitius, покрытые щитками, и они во время Рисского оледенения (плейстоцен) проникли с севера в Каспий. Находки Pungitius в Западной Сибири показали, что намного раньше плейстоцена, уже в плиоцене, в том районе, где должны были обитать гипотетические предки Pungitius, покрытые щитками, обитали лишенные щитков Pungitius. Это заставляет предполагать более раннее обособление Pungitius platygaster, вопреки мнению Мюнцинга.
Неогеновые находки Gasterosteus и Pungitius позволяют сделать заключение о направлении эволюции по крайней мере по трем признакам: числу лучей в брюшном плавнике, числу спинных колючек и боковых пластин. По всем трем признакам несомненно шла редукция, причем, если в неогене колюшки имели 3 луча в брюшном плавнике, то в наше время ни один вид колюшковых не обладает этой особенностью, а по остальным двум признакам редукция имела место в ряде неогеновых популяций, а в некоторых — нет; имеет она место и в ряде современных популяций.
4.4. ФИЛОГЕНЕТИЧЕСКИЕ ОТНОШЕНИЯ СЕМЕЙСТВА С ДРУГИМИ ТАКСОНАМИ
Морфология, анатомия и репродуктивное поведение Gasterosteidae (Nelson, 1971а; Wootton, 1976) свидетельствуют о весьма обособленном положении группы среди других костистых, однако наиболее вероятными родственниками Gasterosteidae считаются Aulorhynchidae (Gill, 1863; Берг, 1940; Nelson, 1971а; Fraser, 1972; Wootton, 1976). Как следует из обзора Бертэна (Bertin, 1925), раньше делались попытки сближать колюшковых с самыми разными группами: Scombriformes (Scombridae, Carangidae), Scorpeniformes (Scorpenidae, Cottidae, Triglidae, Agonidae), Mugilliformes (Mugilidae, Aterinidae), Hemibranches (Aulostomidae, Fistulariidae, Centriscidae), Lophobranches (Solenostomidae, Syngnatidae) и даже с ганоидами (Holostei).
Семейство Aulorhynchidae состоит из 2 родов, содержащих по 1 виду: Aulorhynchus flavidus Gill, Aulichthys japonicus Brevoort (Clemens, Wilby, 1961). Как уже отмечалось выше, первый вид распространен в Пацифике от Аляски до Калифорнии, а второй в Японском море. По форме тела оба напоминают Spinachia — прогонистое тело, длинное трубковидное рыло и тонкий киль (рис. 26). Перед спинным плавником у обоих видов 24—26 коротких изолированных спинных колючек, спинной и анальные плавники имеют треугольную форму и содержат 9—10 лучей, перед анальным плавником колючка. Брюшной плавник содержит колючку и 4 мягких луча (на 2 луча больше, чем у Gasterosteus). Хвостовой плавник в отличие от колюшковых имеет вильчатую форму. Aulorhynchidae, как и колюшки, лишены чешуи и имеют 52—57 боковых костных пластин, налегающих, как у многих колюшек, одна на другую. У Aulichthys каждая пластина имеет маленькую, направленную назад колючку, а у Aulorhynchus передние пластины от 3-й до 6-й имеют уникальный крыловидный задний край. У обоих видов есть ряды пластин по спинной и брюшной поверхности тела, но они не сливаются с боковыми пластинами на хвостовом стебле, как у Spinachia (Nelson, 1971а). Таким образом, по морфологии сходство между Gasterosteidae и Aulorhynchidae велико. Наличие полного ряда боковых пластин и нескольких мягких лучей в брюшном плавнике можно считать примитивным состоянием признака в группе Gasterosteidae — Aulorhynchidae.
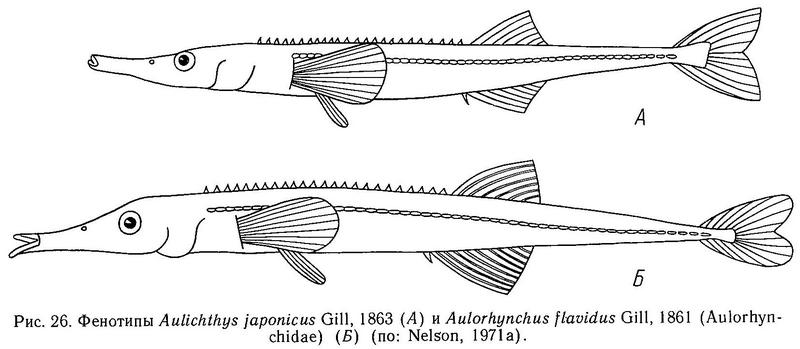
Банистер (Banister, 1967, — цит. по: Wootton, 1976) отмечал, что сходство между обоими семействами простирается до деталей в анатомии скелета, которые в то же время не характерны для костистых рыб в целом: трехлучевой птеригоид, направленный вентрально выступ фронтале, контактирующий с дорсальным выступом парасфеноида, отсутствие супраэтмоида и челюстных лигаментов, хотя челюсть выпячивающаяся. Нельсон (Nelson, 1971а) отмечает большое сходство в строении плечевого и тазового пояса обоих семейств, однако приводит некоторые существенные различия: у Aulorhynchidae отверстие в коракоиде есть, вентральный отдел клейтрума загибается назад, передний отросток тазового пояса намного длиннее, чем задний. У Gasterosteidae отверстия в коракоиде нет, вентральный отдел клейтрума не загибается назад, передний отросток тазового пояса намного короче, чем задний (исключая Spinachia, где они равны по длине).
Берг (1940, с. 288) указывает, что главное отличие Aulorhynchidae от колюшек — слияние ребер с боковыми костными пластинами у Aulorhynchidae. Нельсон (Nelson, 1971а) нашел, что у всех Gasterosteidae есть и эпиплевральные, и плевральные ребра, но у Aulichtis есть только плевральные ребра, в то время как Aulorhynchus не имеет ребер вообще — боковые пластинки в передней части тела у этого вида имеют внутренние поперечные отростки, которые контактируют с поперечными отростками позвонков, так что это лишь внешне похоже на наличие ребер.
Проанализировав анатомические, морфологические и поведенческие различия между двумя семействами, Вуттон (Wootton, 1976, с. 333) выдвинул две альтернативные гипотезы о филогенетических связях между ними. Первая гипотеза утверждает, что Aulorhynchidae менее специализированы, чем колюшки, и представляют собой эволюционную линию, меньше дивергировавшую от «основного ствола костистых рыб, чем колюшковые». Гипотеза базируется на более простом репродуктивном поведении Aulorhynchidae, их обитании в чисто морских условиях, большем числе лучей в брюшном плавнике, наличии полной серии инфраорбитальных костей в черепе (у колюшек эта серия не полная), присутствии птеросфеноидной кости (у колюшек ее нет), наличии боковой линии на голове (у колюшек отсутствует) и на различиях по ряду других признаков. Эта гипотеза означает, что линию, которая расщепилась на Gasterosteidae и Aulorhynchidae, составляли длиннорылые формы. Современное узкое распространение Aulorhynchidae и длиннорыловой колюшки Spinachia указывает на отсутствие успеха примитивных длиннорыловых форм по сравнению с эволюционно продвинутыми широко распространенными короткорыловыми колюшками, такими как Gasterosteus, Pungitius, Culaea. Эволюция; короткорыловых форм в пределах Gasterosteidae имела место, когда они отщепились от Aulorhynchidae.
Вторая (альтернативная) гипотеза утверждает, что предковая линия обоих семейств содержала короткорыловые формы, но она обладала эволюционным потенциалом отщеплять длиннорыловые формы, проявившиеся независимо у Aulorhynchidae и Spinachia. По этой гипотезе, ограниченное распространение последних является критерием их специализации, а широкое распространение Gasterosteus и Pungitius имело место вследствие их меньшей специализированности и большей «адаптабильности». Однако Вуттон (Wootton, 1976) склоняется больше к первой гипотезе. В целом, заключает он, нет сомнений, что оба семейства произошли от общего предка.
В отношении филогенетических связей двух этих семейств с другими группами костистых рыб нет единой точки зрения. Отечественные систематики помещают оба эти семейства вместе с сем. Indostomidae в отряд Gasterosteiformes, состоящий только из 3 семейств (Берг, 1940, с. 288; Никольский, 1971). Однако, по мнению Никольского (1971, с. 400), положение Indostomidae в системе еще неясно. Единственный представитель его — Indostomus paradoxus Prashad et Mukeriji, описанный из пресноводного оз. Индавги в верхней Бирме (Prashad, Mukeriji, 1929), имеет ряд признаков, связывающих его с Gasterosteidae — Aulorhynchidae: ряд свободных колючек перед спинным плавником, брюшные плавники (с 4 лучами) недалеко за грудными, в спинном и анальном плавниках по 6 лучей, форма тела и рыла. С другой стороны, с Syngnathiformes этот вид сближает отсутствие колючки в брюшном плавнике, наружный скелет в виде 22 костных колец, покрывающих тело, рот, окаймленный premaxillaria и maxillaria (Берг, 1940). Прашад и Мукерьи (Prashad, Mukeriji, 1929), впервые описавшие эту рыбу, поместили ее рядом с сем. Solenostomidae и сем. Syngnathidae отряда Solenichthyes и считали, что предок Indostomus был морской рыбой, проникшей в озеро при затоплении его морскими водами Бенгальского залива в раннем третичном периоде (неогене). Однако Болин (Bolin, 1936) считал, что Indostomus более близок к Aulorhynchidae и Aulostomidae, чем к Syngnathidae и Solenostomidae, и поместил Indostomidae в Gasterosteiformes. Гринвуд с соавт. (Greenwood et al., 1966) помещают Indostomidae вместе с Aulorhynchidae — Gasterosteidae в подотряд Gasterosteidei отряда Gasterosteiformes. Вместе с тем Банистер (Banister, 1967, — цит. по: Wootton, 1976) на основании детального изучения анатомии Indostomus показал, что он отличается от Gasterosteidae — Aulorhynchidae отсутствием следующих особенностей скелета: восходящего отростка премаксилла, носовых костей, сошника, трехлучевой птеригоидной кости, автопалатине, инфраорбитальной серии костей, теменной кости, ребер, брюшного костного щита, отдельного ряда боковых пластин, малым числом (20) позвонков и другими (всего 15 особенностей). От Syngnathidae и Solenostomidae Indostomus отличается отсутствием сложного сочленения 3-го и 4-го позвонков, шовного контакта между базиокципитале и автоптеротик, разделения между экто- и эндоптеригоидом и других особенностей скелета (всего 7). Таким образом, Банистер пришел к выводу о чисто внешнем сходстве Indostomus, с одной стороны, с Gasterosteidae и Aulorhynchidae и с другой — с Syngnathidae и Solenostomidae и выводит его из Gasterosteiformes в отдельный отряд Indostomiformes, предлагая поместить его в надотряд Paracanthopterygii рядом с отрядом Gobiesociformes. Однако Фрейзер (Fraser, 1972) отметил, что все причины, на которые опирался Banister для удаления Indostomidae из Gasterosteiformes, — это негативные признаки, признаки-утраты, поэтому, с его точки зрения, такое удаление выглядит не совсем убедительным.
По поводу объема отряда Gasterosteiformes также нет единого мнения. Нельсон (Nelson, 1976) включает в него лишь 2 семейства: Gasterosteidae и Aulorhynchidae. Берг (1940) и Никольский (1971) включает в него 3 семейства (Gasterosteidae, Aulorhynchidae, Indostomidae), а другие авторы — намного больше (Ida, 1976). Гринвуд с соавт. (Greenwood et al., 1966) дают следующий объем отряда Gasterosteiformes.

Таким образом, авторы объединяют колюшковых в качестве подотряда в один отряд с пучкожаберными (Syngnathoidei), которых Никольский (1971) выводит в отдельный отряд Syngnathiformes.
Петч (Petch, 1978) дает следующую структуру отряда Gasterosteiformes.

Петч (Petch, 1978) также склонен ввести Indostomidae обратно в Gasterosteiformes.
Интересно, что если Нельсон (Nelson, 1976) не рассматривает Hypoptychidae в качестве даже отдаленного родственника Gasterosteiformes, то Петч (Petch, 1978) вводит их в отряд и помещает близко к семействам Gasterosteidae и Aulorhynchidae. Ида (Ida, 1976) на основании сходства остеологии, образа жизни и размножения между Hypoptychidae, с одной стороны, и Aulorhynchidae — Gasterosteidae — с другой, переместил это семейство из подотряда Ammoditoidei отряда Perciformes в подотряд Gasterosteidei отряда Gasterosteiformes.
Нельсон (Nelson, 1976) помещает отряд Gasterosteiformes в надотряд Acanthopterygii (куда входит 15 отрядов и более 7 тыс. видов) и дивизион Euteleostei. По его мнению, взаимоотношения в этом надотряде не вполне ясны. Однако ближе всего к Gasterosteiformes он помещается Syngnathiformes, Zeiformes.
Таким образом, в большинстве классификаций костистых рыб семейства Gasterosteidae и Aulorhynchidae помещают близко к Aulostomidae, Fistulariidae, Centriscidae, Macrorhamphosidae, Solenostomidae, Syngnathidae. Все эти семейства включают рыб часто с удлиненными рылом и боками тела, защищенными костным панцирем; рыбы эти морские и обитатели тропиков Пацифики и Атлантики.
Ригэн (Regan, 1911) присоединил Gasterosteidei в качестве подотряда к отряду Scleroparei (другие члены этого отряда были Scorpaenoidei и Cottoidei) и считал, что колюшкообразные генетически связаны с окунеобразными, в частности костнощекими. Свиннертон (Swinnerton, 1902) связывал колюшек с Beloniformes (сарганообразными). Интересно, что единого мнения по поводу филогенетических связей и систематики колюшек не было как в начале века, так и в наше время. В 1929 г. известный американский ихтиолог Хаббс писал: «... систематическая интерпретация колюшек долгое время была и до сих пор остается одной из наиболее запутанных проблем в ихтиологии» (Hubbs, 1929). В 1971 г. Никольский отмечал: «Генетические связи колюшкообразных еще окончательно не выяснены» (1971, с. 400). В том же году один из авторитетов в области систематики этой группы, Нельсон, констатировал: «Доказательства эволюции колюшковых несметны; вопросы, которые осаждают нас, чтобы реконструировать способы и пути ее, — необъятны» (Nelson, 1971, с. 440). И наконец, Вуттон, внесший большой вклад в понимание эволюции колюшковых, в 1976 г. заключил: «Очевидно, что реконструкция филогении колюшковых до сих пор остается мучительной головоломкой» (Wootton, 1976, с. 345).
4.5. ГЕНЕТИКА И ЭВОЛЮЦИЯ
Колюшковые рыбы оказались чрезвычайно удачным объектом для исследований в области эволюционной и популяционной биологии. Вопросы морфологии, систематики и эволюции колюшковых особенно заинтересовали исследователей с тех пор, как у Gasterosteus и Pungitius был обнаружен полиморфизм по числу костных щитков в пресноводных и солоноватоводных популяциях Евразии и Сев. Америки (Bertin, 1925). Происхождение и взаимоотношения комплекса форм в пределах этих двух родов дискутируются в эволюционной литературе уже много десятков лет (Hubbs, 1929; Münzing, 1959, 1969; Bell, 1976, 1984; Wootton, 1976; Зюганов, 19836, и др.). Особое внимание эволюционных биологов привлекла морфологическая, физиологическая и поведенческая изменчивость Gasterosteus aculeatus, а именно происхождение этой изменчивости, факторы, способствующие ее сохранению, и селективные преимущества, вытекающие из нее. Gasterosteus aculeatus хорошо удовлетворяет требованиям, предъявляемым при изучении эволюции разных признаков; основные морфологические признаки, обнаруживающие заметную изменчивость, — цветовой полиморфизм, жаберные тычинки, разнообразные структуры «наружного скелета» и «вооружения». Одним из преимуществ трехиглой колюшки как объекта для эволюционных исследований Белл (Bell, 1984) называл даже распространение колюшки в районах, где живут эволюционные биологи, а также возможность собирать выборки круглый год, легкость сбора материала и транспортировки.
Колюшковые рыбы населяют весьма разнообразные биотопы (пресные — солоноватые — морские, пелагиаль—литоральную зону, заросли — каменистые участки и т. д.), так что одна и та же популяция может подвергаться различным давлениям и направлениям отбора, что также делает колюшковых ценными для популяционных исследований. Короткоцикловость, малые размеры, неприхотливость колюшек делают возможными экспериментальные аквариумные исследования.
Первый вопрос, на который необходимо получить ответ при эволюционногенетическом исследовании, — является ли наблюдаемая фенотипическая изменчивость простым отражением гетерогенности окружающей среды (паратипическая изменчивость) или продуктом, подлежащим генетической изменчивости. Ответам на этот вопрос посвящен следующий раздел.
4. 5.1. ГЕНЕТИКА РАЗНЫХ ПРИЗНАКОВ
Полиморфизм по числу костных щитков трехиглой колюшки. Этот полиморфизм составляет одну из главных тем эволюционной генетики колюшки. Генетика полиморфизма изучалась многими авторами (Münzing, 1959; Lindsey, 1962а; Hagen, 1967, 1973; Hagen, Gilbertson, 1973; Avise, 1976; Paepke, 1982; Зюганов, 1983г).
Терминология морф (=морфотипов, =фенотипов) колюшек по числу боковых костных пластин дана в разделе 1.7. Необходимо напомнить, что термин «морфа» используется здесь и далее для обозначения фенотипического варианта (trachurus, semiarmatus, leiurus и т. д.) безотносительно к его популяционному или таксономическому статусу.
Генетическому анализу были подвергнуты лишь 4 основных фенотипа: trachurus, semiarmatus, leiurus, hologymna.
Мюнцинг (Münzing, 1959) на основании гибридологического анализа колюшек из полиморфной популяции р. Эльбы установил, что фенотипы определяются 1 локусом с 2 аллелями. Доминантная и рецессивная гомозиготы относятся к trachurus (АА) и leiurus (аа), а гетерозигота (Аа) к semiarmatus при неполном доминировании. Изменчивость по числу пластин внутри каждой морфы контролируется множеством мелких генов-модификаторов. Хаген и Гильбертсон (Hagen, Gilbertson, 1973) на популяциях колюшек из водоемов штата Вашингтон показали, что наследование числа пластин на теле определяется 2 локусами с 2 аллелями каждый («major genes»), причем кроме этого имеется много полигенов, поскольку внутри каждой морфы (trachurus, semiarmatus, leiurus) есть изменчивость по числу пластин на теле. В среднем коэффициент наследуемости пластин leiurus h2=0.84 при 20 °С и h2=0.50 при 16 °С. По Хагену и Гильбертсону (Hagen, Gilbertson, 1973), имеется всего 9 генотипов, контролирующих 3 фенотипа колюшки. Если в генотипе 3 и больше доминантных аллеля, то это complete=trachurus, 2 — partial=semiarmatus, 1 или 0 — low=leiurus (рис. 27). На основании типичного дигибридного характера расщепления морф в F1 и F2 авторы полагают, что локусы А и В аутосомные и несцепленные, взаимодействие их аддитивное.

Эвайс (Avise, 1976), который работал с «необычной» диморфной популяцией колюшек из Калифорнии «Фриант», где встречаются только фенотипы complete и low, установил, что complete в F1 полностью доминирует над low. Результаты его внутрипопуляционных скрещиваний хорошо описываются моногенной моделью с полным доминированием, если принять, что генотипы complete — АА и Аа, а генотип low — аа. Однако когда в скрещиваниях использовались родители фенотипов complete и low из других аллопатричных популяций: complete (Фриант) х low (Напа) или complete (Наварро) х low (Фриант), то в F1 помимо этих 2 фенотипов выщеплялись partial (=semiarmatus).
Похоже, что в разных популяциях колюшки наследование боковых пластин определяется по-разному: в р. Эльба — моногенно, с неполным доминированием, в Калифорнии — моногенно, с полным доминированием, а в штате Вашингтон — дигенно. Однако на основании анализа расщеплений, полученных упомянутыми выше авторами, была предложена новая модель наследования боковых пластин на теле, удовлетворительно объясняющая подавляющее большинство противоречивых, на первый взгляд, результатов скрещиваний, проведенных разными авторами (Зюганов, 1980). Я предположил, что отношения между аллелями А и а основного морфогенного локуса регулируются неаллельным, несцепленным локусом С (модификатором доминирования). Двойная доза рецессивного аллеля сс переводит доминирование А из неполного в полное, в то время как СС и Сс не влияют на доминирование А. В этой модели взаимоотношения между неаллельными генами А и С — эпистатические (рис. 28).

Полагаем, что в популяциях типа «Фриант» фиксирован аллель с и доминирование complete будет обязательно полным, а в других популяциях, где есть фенотипы complete, partial, low, такой фиксации не произошло и расщепления в скрещиваниях будут носить дигибридный характер, как это и получилось в некоторых скрещиваниях Мюнцинга (Münzing, 1959), Хагена и Гильбертсона (Hagen, Gilbertson, 1973) и межпопуляционных скрещиваниях Эвайса (Avise, 1976). Наша модель подтвердилась после проведенных скрещиваний 3 морф trachurus, leiurus и semiarmatus в аквариумах и водоемах бассейна Белого моря, карьерах, затопленных грунтовыми водами, где не было никаких рыб до экспериментов. В этих водоемах была проведена серия специальных скрещиваний (индивидуальных и групповых) и получено потомство F2 (табл. 15—17) (Зюганов, 1983г). Позже было получено F3, проведены анализирующие скрещивания, и сейчас в 2 карьерах имеются 2 диморфные популяции, подобные «необычной» популяции «Фриант», с генотипами trachurus ААсс и ААсс и leiurus аасс. Таким образом, сейчас мы располагаем линиями колюшек фенотипа leiurus, полностью гомозиготными по обоим локусам а и с. Эти линии аасс можно использовать для анализирующих скрещиваний с любыми фенотипами из любых участков ареала Gasterosteus aculeatus (Зюганов, 19856).

Росс (Ross, 1973) провел ряд скрещиваний между leiurus (3b) и hologymna. (4b) (по его терминологии, microcephalus и williamsoni). Leiurus обнаруживает частичное доминирование над hologymna, у которой костные пластины вообще отсутствуют. Хаген и Гильбертсон (Hagen, Gilbertson, 1973) при скрещивании «leiurus with a keel» (3а) (из мономорфной популяции «Квинаулт») саму на себя обнаружил, что в F1 нет расщепления во всех 4 экспериментах (n=182) (они относят «leiurus with a keel» к фенотипу partial). Фенотип partial, полученный от скрещивания complete х low, при скрещивании самого на себя всегда расщепляется в F2 на фенотипы complete, partial, low.
Мы полагаем, что киль является независимым признаком и детерминируется простой моногенной системой: КК и Кк — есть киль, кк — нет киля. В большинстве популяций ген «К» тесно сцеплен с геном «А», контролирующим пластины на теле, а ген «к» сцеплен с геном «а». Поэтому всегда фенотип trachurus имеет киль (найден всего 1 экз. trachurus без киля). Поэтому также всегда фенотип semiarmatus (= partial), который гетерозиготен и по гену «А», и по гену «К», расщепляется при скрещивании самого на себя на complete, partial, low. Однако в некоторых популяциях, мономорфных по фенотипу «leiurus with a keel» — «Изник» (Münzing, 1962) или «Квинаулт» (Hagen, Gilbertson, 1973), по нашему мнению, закрепился результат кроссинговера. Ген «а» оказался сцепленным с геном «К», поэтому колюшки такого фенотипа могут образовывать мономорфные популяции и не расщепляются при скрещивании сам на себя. Подтверждением гомозиготности «чистых» популяций partial служит факт их низкой изменчивости по числу пластин, обнаруженный Кинардом и Карри (Kynard, Curry, 1976) и Коадом и Повером (Coad, Power, 1974). В то же время в полиморфных популяциях partial всегда характеризуется большей изменчивостью вследствие несбалансированного генного комплекса, там, где partial является продуктом скрещивания leiurus и trachurus (Münzing, 1959; Зюганов, 1980; Paepke, 1982).
Схема наследования, предложенная нами, относится только к пластинам на теле, безотносительно к признаку «киль», и она также не учитывает существования фенотипа hologymna, поскольку мы не имели в распоряжении особей этого фенотипа в скрещиваниях.
Подводя итоги описаниям результатов скрещиваний морф Gasterosteus acculeatus, можно резюмировать, что схема наследования признака «боковые пластинки на теле» явно олигогенная. То же можно сказать о признаке «киль». Об олигогенности свидетельствует менделевский характер расщепления. Фенотип trachurus доминантен или полудоминантен, а фенотип leiurus — рецессивен, поскольку скрещивания leiurus х leiurus обычно никогда не дают расщепления (Münzing, 1959; Hagen, Gilbertson, 1973; Avise, 1976; Paepke, 1982; Зюганов, 1983г).
Изменчивость по числу пластин внутри каждой морфы контролируется полигенами и частично зависит от условий развития рыб. Так, Линдсей (Lindsey, 1962а) показал, что у потомства от скрещивания leiurus х leiurus низкие температуры выращивания икры вызывают незначительное уменьшение числа боковых пластин, а изменение солености не дает никаких эффектов.
Хэй (Hay, 1974; цит. по: Wootton, 1976) провел интересную работу по генетике Gasterosteus aculeatus. Во первых, он считает,что критерием отделения semiarmatus от leiurus является не наличие киля у первой (и с этим я полностью согласен — В. З.), а отсутствие особой боковой пластинки у последней. Если наиболее переднюю пластинку обозначать «А», а последующие «В», «С» и т. д., то у leiurus всегда отсутствует пластинка «I», которая неизменно присутствует у semiarmatus, безотносительно к тому, есть у нее киль или нет. Хэй показал, что обладание этой пластинкой «I» находится под генетическим контролем. Скрещивания между рыбами, имеющими пластинку «I», дают расщепление на потомство с «I»-пластинкой (semiarmatus) и без «I»-пластинки (leiurus). Скрещивания внутри leiurus никогда не дают рыб с «I»-пластинкой. К сожалению, я не располагаю этой работой Хэя, и не совсем явно, то ли «I»-пластинка — просто 9-я по счету (в соответствии с английским алфавитом), то ли она обладает какой-то особой формой у американских semiarmatus.
Рот (Roth, 1920) и Игараши (Igarashi, 1964) обнаружили, что во время развития trachurus проходит стадия leiurus и semiarmatus, т. е. у trachurus имеются два центра закладки пластин — первыми появляются пластины в грудном отделе и затем на хвостовом стебле, пластины на теле и киле в онтогенезе нарастают друг на друга. Игараши (Igarashi, 1964) предполагает, что leiurus и semiarmatus произошли от наиболее примитивного состояния признака — trachurus путем неотенизации. Белл (Bell, 1981) нашел сходную корреляцию между числом «грудных» и «килевых» пластин у неполовозрелых trachurus и у взрослых semiarmatus и также предположил возникновение leiurus и semiarmatus от trachurus путем педоморфоза (неотении). Он считает, что различия по числу пластин между leiurus и trachurus существуют благодаря разной скорости нарастания (увеличения числа) пластин, по отношению к размеру тела. Таким образом, локусы, детерминирующие морфы, контролируют собственно скорость нарастания пластин.
В разделе 1.3 уже упоминалась работа Пенчака (Penczak, 1961а) по регенерации пластин у колюшки, им было экспериментально выявлено, что полное удаление большого числа пластин приводило к их одновременной регенерации через 100—150 дней, а удаление только частей пластин приводило к еще более быстрой регенерации.
Генетика морф в роде Pungitius. Генетическому анализу были подвергнуты 4 фенотипа: trachurus (=Pungitius sinensis (=1а)), trachurus без киля (Pungitius platygaster (=lb)), leiurus with a keel (=Pungitius pungitius (=3a)), hologymna with a keel (=Pungitius tymensis (=4a)). Все проведенные скрещивания, к сожалению, ограничены F1, поэтому полную модель наследования, адекватно отражающую генетический контроль признака «боковые пластинки», построить затруднительно. На основании расщеплений в F1 можно лишь судить (примерно) о количестве генов и доминантно-рецессивных отношениях фенотипов.
В скрещивании фенотипов «trachurus без киля (Pungitius platygaster) х «leiurus with a keel» (Pungitius pungitius) в F1 были получены следующие (рис. 29) расщепления (табл. 18) (Зюганов, 19846).

Ни один из типов расщеплений в этих скрещиваниях в роде Pungitius не соответствует расщеплениям при аналогичном скрещивании trachurus х leiurus в роде Gasterosteus и не описывается моделями наследования, разработанными для Gasterosteus aculeatus (табл. 20) (Зюганов, 1984б). Так, в расщеплении типа 1 присутствует только фенотип hologymna (табл. 19) (нет пластин на теле) с пенетрантностью 100 %, что говорит о полном доминировании и даже, «сверхдоминировании» малого числа пластин над большим. У Gasterosteus в аналогичном скрещивании trachurus х leiurus (имеется в виду только признак «пластины на теле») фенотип hologymna никогда не выщеплялся, хотя скрещиваний подобного типа проведено несколько десятков разными авторами и в разных участках ареала, что исключает случайность. Ращепление типа 2 также показывает рецессивность фенотипа trachurus (=lb) у Pungitius. Расщепление типа 3 у Pungitius наиболее близко к расщеплению типа 6 у Gasterosteus (табл. 20), но все же у Pungitius в этом расщеплении присутствует фенотип hologymna с частотой 1/4, а у Gasterosteus этого нет. Можно полагать, что у Pungitius в отличие от Gasterosteus кроме основного гена «А» и модификатора «с» есть еще 1 или 2 гена, участвующих в детерминации признака «боковые пластины на теле».

Кобаяши (Kobayashi, 1957) провел скрещивания Pungitius sinensis (=trachurus) х Pungitius pungitius (=leiurus) в Японии и получил в F1 большое число промежуточных вариантов, которые он разбил на 12 видов (рис. 30) с плавным переходом от trachurus к hologymna. Создается впечатление, судя по характеру расщеплений в F1, что у японских колюшек рода Pungitius характер детерминации этого признака не олигогенный, а полигенный, учитывая непрерывный характер изменчивости гибридов. Такие же результаты были получены им при скрещивании Pungitius sinensis (=trachurus) х Pungitius tymensis (=hologymna).
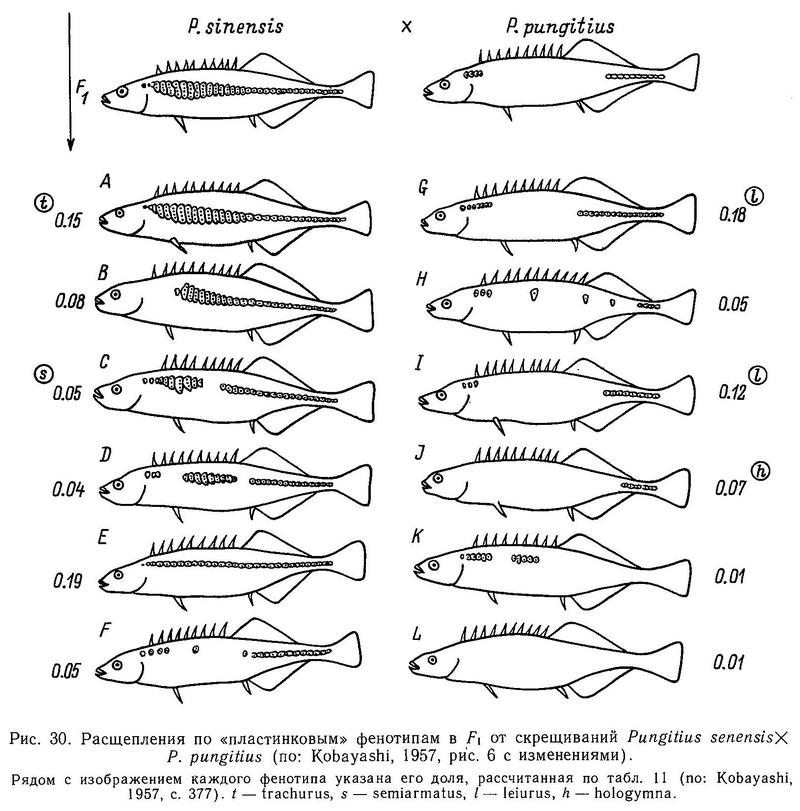
Судя по данным Кобаяши (Kobayashi, 1957) и нашим данным (Зюганов, 19846), киль у Pungitius — доминантный признак. Есть полное соответствие между расщеплениями по признаку «киль» у Gasterosteus и Pungitius; киль, в обоих родах — доминантный признак. Различия между 2 родами в наследовании киля выявляются лишь по экспрессивности. Так, у Gasterosteus у гибридов F1 от скрещивания «киль» х «отсутствие киля» киль в среднем на 30 % уменьшается по числу пластин, т. е. по протяженности, но гребневидность его остается отчетливо выраженной. В то же время у гибридов Pungitius pungitius х Pungitius platygaster в аналогичных скрещиваниях число пластин увеличивается в среднем на 50 %, а гребневидность почти исчезает, киль делается уплощенным (Зюганов, 19846).
Межрбдовые скрещивания (реципрокное скрещивание вызывало гибель потомства на ранних стадиях развития) самка Gasterosteus aculeatus (=trachurus) х самец Pungitius pungitius (=leiurus), проведенные Лейнером (Leiner, 1934), показали доминирование (неполное) фенотипа trachurus, не было гибридов с голыми боками, как Pungitius pungitius, но число пластин у них никогда не достигало 33, как у Gasterosteus aculeatus.
Монотипные роды Spinachia, Apeltes, Culaea не обнаруживают полиморфизма по числу костных пластин и являются мономорфными (Spinachia — фенотип trachurus с килем, Apeltes — hologymna, Gulaea — trachurus без киля), поэтому генетический анализ этого признака у них не производился (рис. 31).
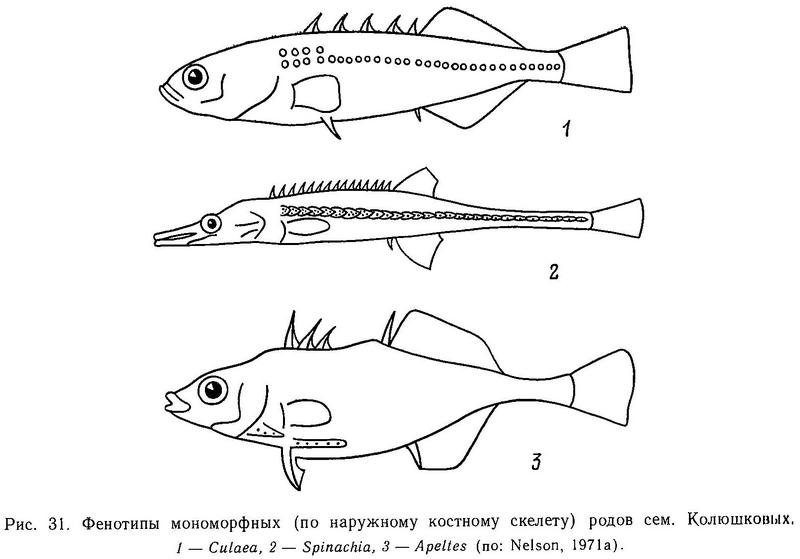
Жаберные тычинки. Число жаберных тычинок на 1-й жаберной дужке коррелировано с расстоянием между тычинками и является индикатором размера и вида корма в пищевом рационе трехиглой колюшки (Larson, 1976). Число жаберных тычинок является у колюшковых таксономическим признаком. Хаген (Hagen, 1973) установил, что коэффициент наследуемости жаберных тычинок трехиглой колюшки оз. Вапато (штат Вашингтон) равен 0.58. Хаген и Гельбертсон (Hagen, Gilbertson, 1972) установили, что на Тихоокеанском побережье Сев. Америки у озерных популяций трехиглой колюшки число жаберных тычинок (19—22) больше, чем у ручьевых (14—17).
Позвонки. Линдсей (Lindsey, 1962а) обнаружил, что увеличение температуры выращивания икры трехиглой колюшки сначала уменьшает, а затем увеличивает число позвонков, так что зависимость числа «vt» от температуры принимает V-образную форму.
Скрещивания малопозвонковой (М=30.2) Pungitius platygaster и многопозвонковой (М=33.0) Pungitius pungitius дают потомство F1 с промежуточным числом позвонков (М=30.9) (Зюганов, 1984б).
Полиморфизм по брачной окраске. Полиморфизм по брачной окраске (красносамцовые и черносамцовые популяции) описан у трехиглой колюшки на западном побережье США (см. раздел 1.4).
Мак-Фейл (McPhail, 1969) показал, что особи на парапатричных и аллопатричных «красносамцовых» и «черносамцовых» популяций скрещиваются в эксперименте и гибриды первого поколения промежуточны по окраске. Хаген и Муди (Hagen, Moodie, 1979) кроме первого получили второе поколение гибридов и беккроссов. F1-гибриды сходны по фенотипу окраски с таковыми, полученными Мак-Фейлом (на горле рассеяны красные и черные пятна, спина от зеленого до темно-коричневого оттенка), причем реципрокные скрещивания давали эквивалентные результаты. Во втором поколении при скрещивании гибридов F1 самих на себя и при возвратных скрещиваниях (гибрид F1 х родитель) были получены соотношения фенотипов по окраске, хорошо описываемые однолокусной диаллельной моделью без доминирования какой-либо аллели (АА — красные, АА1 — промежуточные, А1А1 — черные). Авторы полагают, что на экспрессивность гена, детерминирующего брачную окраску, влияют полигенные локусы-модификаторы, так как наблюдается значительная изменчивость в соотношении красных и черных пигментов у гибридов и есть большое сходство между беккроссами (потомками от возвратных скрещиваний) и особями из той родительской популяции, с которой скрещивались гибриды F1.
Спинные колючки. Пенчак (Penczak, 1963) скрещивал трехколючковых самцов Gasterosteus aculeatus с четырехколючковыми самками и получил в F1 только 3-колючковых особей. Скрещивания самцов и самок с 4 колючками дали также потомство F1 только с 3 колючками. На этом основании автор делает вывод, что 4 спинные колючки — рецессивный признак. Линдсей (Lindsey, 1962а) при скрещивании особей «3 колючки» х «3 колючки» получал выщепление 2 % 4-колючковых особей при повышении температуры выращивания потомства. Кэмпбелл (Campbell, 1979) провел 3 межпопуляционных скрещивания особей с 3 колючками и с редуцированным числом колючек (2 и 1). Результаты оказались неодинаковыми: потомки от одного скрещивания оказались все с 3 колючками, от другого — с редуцированным числом, а от третьего — оба фенотипа.
Результаты скрещиваний свидетельствуют о межпопуляционных различиях в соотношении генетической и паратипической компонент изменчивости числа спинных колючек. Факторы внешней среды также несомненно влияют на изменчивость числа спинных колючек Gasterosteus aculeatus.
Pungitius. По числу спинных колючек есть высокодостоверные различия между Pungitius tymensis (М=10.8) и Pungitius pungitius (М=8.8). Скрещивание самка Pungitius tymensis х самец Pungitius pungitius дало в F1 среднее число колючек 10.5 (материнский эффект), а реципрокное скрещивание выявило среднее число спинных колючек у гибридов 9.8 (промежуточное наследование) (Kobayashi, 1957). Длина спинных колючек у Pungitius tymensis (3.7 % от длины тела) намного короче, чем у Pungitius pungitius (5.8) и Pungitius sinensis (6.1). Межвидовых гибридов первого поколения tymensis х sinensis и tymensis х pungitius очень легко отличить по этому признаку: казалось бы, все колючки у гибридов должны быть промежуточной длины, однако у гибридов короткие колючки чередуются с длинными (аддитивный эффект) (Kobayashi, 1957, с. 375) (рис. 32).

Похожими были результаты межродовых скрещиваний Лейнера (Leiner, 1934) Gasterosteus aculeatus х Pungitius pungitius, гибриды имели от 3 до 8 колючек, и короткие колючки (влияние генов Pungitius) чередовались с длинными колючками (влияние Gasterosteus). Блоу и Хаген (Blow, Hagen, 1981) обнаружили изменчивость числа спинных колючек у Apeltes от 1 до 7 (см. раздел 1.6) и установили, что коэффициент наследуемости числа колючек весьма высок (-h2=0.61) (Hagen, Blow, 1983).
Тазовый пояс. Генетика редукции тазового пояса лучше всего изучена у Culaea inconstans. Нельсон (1977) провел 19 индивидуальных и 4 групповых скрещивания Culaea с разными фенотипами тазового пояса. Особи для скрещиваний были взяты из полиморфной популяции оз.Астотин (провинция Альберта, Канада). Хотя между полной выраженностью тазового пояса и полной утратой его имеется непрерывная серия промежуточных форм, Нельсон (Nelson, 1977) использовал для скрещиваний 3 дискретных фенотипа. «А» (absence) — полное отсутствие обеих (левой и правой) половинок таза и колючек; «I» (intermediate) — промежуточный фенотип: есть только 1 половинка тазовой кости, но нет колючек, или есть обе половинки таза и только 1 (левая или правая) колючка; «С» (complete) — полная выраженность тазового пояса и обеих колючек. Индивидуальные скрещивания были выполнены в аквариумах, а групповые в искусственных прудах, и от 30 до 60 основателей было интродуцировано в каждый пруд. Результаты индивидуальных и групповых скрещиваний оказались сходными. В скрещиваниях типа «А» х «А» в F1 наблюдалось расщепление на все 3 фенотипа (60 % «А», 20 %, «I», 20 % «С») в пруду и (80 % «А», 17 % «I», 3 % «С») в аквариумах. В скрещиваниях типа «I» х «I» наблюдалось расщепление в F1 на все 3 фенотипа при соотношении примерно 2«А» : 1«I» : 1«С». Скрещивания «С» х «С» давали также расщепления на 3 фенотипа при их примерном соотношении 25 % «А», 10 % «I», 65 % «С». Скрещивания типа «С» х «А» не обнаружили доминирования «дикого типа» над редукцией, а в потомстве F1 произошло расщепление 50 %«А», 20 % «I», 30 % «С». Скрещивание «А» х «I» обнаружило расщепление: 60 % «А», 30 % «I», 10 % «С». Скрещивание «С» х «I» выполнено не было. Результаты скрещиваний не позволили Нельсону (Nelson, 1977) предложить какую-либо модель генетического контроля признака, автор лишь сделал осторожное заключение о наличии частичного генетического контроля признака и не пытался обсуждать свои данные. Он полагает, что температура воды и наличие кальция или фтора могут также влиять на изменчивость признака. Кроме того, в аквариумах была высокая смертность икры, а в прудах обитали хищные беспозвоночные, что могло исказить соотношения фенотипов в расщеплениях в скрещиваниях. Однако на основании результатов работы Нельсона (Nelson, 1977) можно предположить, что модель детерминации «тазовых» фенотипов включает 2 и более генов, каждый по крайней мере с 2 или более аллелями. Судя по расщеплениям в скрещиваниях «С» х «С» и «А» х «А», ни один из этих фенотипов не является гомозиготным, они оба гетерозиготны, а скрещивание «С» х «А» показало отсутствие доминирования «дикого типа» и наличие рецессивных аллелей в генотипе, его детерминирующем. Кирпичников (1979, с. 84) предполагает, что редукция pelvis у колюшковых, как и у других рыб, «определяется простой рецессивной мутацией». Судя поданным Нельсона (Nelson, 1977), у Culaea это отнюдь не так. К тому же, судя по наличию серии непрерывных переходов между фенотипами «С» и «А», полигены также участвуют в генетическом контроле признака.
Gasterosteus aculeatus. Кэмпбелл (Campbell, 1979) провел три межпопуляционных скрещивания между колюшками «дикого» типа (с нормальным тазовым поясом) и колюшками с редуцированным тазовым поясом (он обозначает их как аномальные). Одно скрещивание продуцировало все потомство — норму, второе — всех аномальных, а третье — норму, аномальных и промежуточных. Результаты работы Кэмпбелла (Campbell, 1979) говорят о генетической основе межпопуляционных различий по степени редукции тазового пояса и об отсутствии полного доминирования «дикого типа» над «редукцией». В частности, результаты третьего скрещивания свидетельствуют о гетерозиготности и «дикого типа», и «редукции».
Жиль (Giles, 1983) скрещивал между собой 8 родителей Gasterosteus aculeatus (морфа hologymna), лишенных тазового пояса, а также боковых пластин и 2 спинных колючек, собранных из мономорфных популяций, обитающих на Гебридских островах (Великобритания) в озерах с низкой концентрацией кальция (0.94—2.5 мг/л). Потомство от скрещиваний было выращено в воде оз. Ломонд (3.8 мг/л), где обитают колюшки с нормально развитыми брюшными, спинными колючками, тазовым поясом и боковыми пластинками (морфа leiurus). Тем не менее все потомки F1 оказались фенотипически идентичны родителям, хотя и развивались в более богатой кальцием воде, что привело автора к выводу — «скелетная редукция не является простым онтогенетическим ответом на низкую концентрацию кальция... и ... подчеркивает наличие генетической основы скелетной редукции» (с. 540).
Pungitius pungitius. Нами были проведены групповые скрещивания между особями с нормально развитым тазом и брюшными колючками и особями, лишенными таза и колючек. В одном карьере «Рецессивный» было поставлено скрещивание: 45 самок «норма» (из р. Сходня Московской обл.) х 30 самцов «редукция» (из оз. Машинное, Белое море). В другом карьере «Реципрокный» было поставлено реципрокное скрещивание: 15 самок «редукция» (из морского залива Левин Наволок, Белое море) х 30 самцов «норма» (из р. Сходня). Результаты в обоих случаях оказались одинаковыми: в F1 в обоих карьерах оказались только особи «норма» с тазовым поясом и брюшными колючками (n=115 для «Рецессивного» и n=86 для «Реципрокного» карьеров). Примерно у 30 % особей F1 из обоих карьеров наблюдалась асимметрия в длине левой-правой брюшных колючек, однако до полной редукции одной из колючек дело дошло только у одной особи. Затем из карьера «Рецессивный» было отсажено в другой водоем — «Смешанный» 15 самцов и 20 самок потомков F1 от этого скрещивания, имеющих фенотип «норма». В следующем году были выловлены в этом водоеме колюшки F2 — потомки от скрещивания гетерозигот самих на себя. Особи F2 имели следующие фенотипы: 116 «норма», 4 «промежуточные», 19 «редукция» (83.4 : 2.8 : 13.8%). Необходимо дальнейшее изучение наследования этого признака (Зюганов, Розанов, 1987).
Солеустойчивость икры. Хойтс (Heuts, 1946, 1947b) исследовал генетику солеустойчивости икры 2 форм Gasterosteus aculeatus в Бельгии. Проходная trachurus нерестится в низовьях рек, а жилая leiurus — в верховьях, хотя между двумя формами есть узкая гибридная зона, где обе формы контактируют. Оказалось, что у форм разные оптимумы развития икры: выживаемость икры leiurus х leiurus была максимальной в пресной и слабосоленой (до 6 ‰) воде, a trachurus х trachurus — при солености 17 ‰. Гибридная икра (самка trachurus х самец leiurus) имела оптимум солености, характерный для trachurus. Напротив, гибридная икра (самка leiurus х самец trachurus) имела оптимум солености, характерной для leiurus. Таким образом, здесь сильную выраженность имеет материнский эффект.
Интересно, что в бассейне Белого моря икра trachurus и leiurus имеет одинаковый оптимум в широком диапазоне солености: от пресной воды до морской соленостью 26 ‰ (Соин, Зюганов, 1979).
Солеустойчивость сперматозоидов. Характеристика полиморфизма по солеустойчивости спермиев Gasterosteus aculeatus дана ранее в разделе 2.7. Все спермии у выщепляющихся в первом поколении самцов формы leiurus от группового скрещивания trachurus х trachurus, проведенного в пресной воде, не активируются в морской воде, но все спермии trachurus, выщепившихся в этом же скрещивании, активны в морской воде соленостью 26 ‰. При индивидуальном скрещивании самец trachurus х самка leiurus (карьер «Микрооленчик», в пресной воде) у выщепившихся в F1 особей semiarmatus часть спермиев (примерно 50 %) активировалась в морской воде, т. е. вела себя как trachurus, а остальные спермии не активировались в морской воде, т. е. вели себя как leiurus (Зюганов, 1981а, 1981б). Самцы trachurus, выщепившиеся в F1 в этом же скрещивании, обнаружили активацию большинства (80—90 %) спермиев в морской воде. Leiurus в этом скрещивании не выщепилось (Зюганов, 1983в, 1983г). Результаты реципрокного скрещивания (самец leiurus х самка trachurus) в карьере «Малыш» оказались аналогичными, за исключением того, что у semiarmatus активировалась в морской воде меньшая часть спермиев (15—20 %), так же как и у trachurus (50—60 %), по сравнению с предыдущим скрещиванием. Эти результаты позволили выдвинуть гипотезу, что гены, определяющие морфы, тесно сцеплены с генами, определяющими солеустойчивость спермиев (Зюганов, 1981а, 1981б, 1983в). Однако спермии самцов leiurus, выщепившихся от скрещивания самец semiarmatus х самка leiurus, обнаружили активацию в морской воде (активировалась 30—50 % спермиев). Это означает, что нет 100%-ного сцепления признаков «leiurus» и «отсутствие солеустойчивости спермиев», как это предполагалось ранее. Следовательно, генетический контроль солеустойчивости спермиев оказался гораздо сложнее (Зюганов и др., 1987).
Представляется, что различия по солеустойчивости спермиев между морской trachurus и пресноводной leiurus не абсолютны, а относительны. При попадании в пресноводный изолированный водоем группа основателей trachurus в течение нескольких первых поколений расщепляется на 3 морфы: trachurus, leiurus и semiarmatus. С течением длительного времени частота leiurus накапливается и затем фиксируется на уровне 1.0 (мономорфизм), а остальные 2 морфы элиминируются. Эксперименты в природе показали, что выщепившаяся leiurus сразу же в первом поколении теряет способность к активации спермиев в морской воде, a trachurus теряет эту способность постепенно и более плавно. Начиная со второго поколения, только 9 % самцов trachurus в популяции полностью утеряли солеустойчивость спермиев (судя по наблюдениям в карьере «Рудник»), а примерно через 14—15 поколений (судя по наблюдениям в карьере «Нильмо») уже 78 % самцов trachurus утеряли солеустойчивость спермиев, к этому времени уже все самцы semiarmatus утеряли солеустойчивость (Зюганов, 1980).
Особенности репродуктивного поведения. В норме самец Gasterosteus aculeatus во время сексуальной фазы (см. раздел 2.8.2) проползает через гнездо с 7—10-минутным интервалом перед повторным проползанием (Wootton, 1976). Однако в некоторых европейских популяциях есть самцы (их называют «маньяки»), выполняющие этот элемент 2—4 раза подряд без всяких интервалов, затем следует интервал в 7 мин, характерный для нормальных самцов, и многократное проползание повторяется вновь, так что 1 проползание нормального самца соответствует нескольким проползаниям «маньяка». Генетический анализ показал простое моногенное наследование этого признака: «норма» доминирует над «маньяком». Признак «маньяк» не сцеплен с полом и числом боковых пластин (с морфой). Однако внешние условия могут модифицировать этот признак. Так, самцы, достигшие половозрелости при длинном световом дне и высокой температуре (о которых было известно, что генетически они являются «маньяками»), обнаруживали высокую экспрессивность гена. Вместе с тем самцы из той же линии, но выдержанные перед нерестом 2—3 мес в «зимних» условиях, обнаружили слабую экспрессивность этого гена и не выполняли элементов поведения, характерного для «маньяка» (Sevenster, Hurt, 1974).
4.5.2. ХРОМОСОМЫ
Как уже отмечалось ранее (см. раздел 4.2), хромосомные наборы были изучены у всех (кроме Spinachia) родов колюшковых (Muramoto et al., 1969; Chen, Reisman, 1970). В данном разделе представляет интерес вопрос, различаются или нет кариологически разные формы и виды внутри полиморфных родов Gasterosteus и Pungitius. Мурамото и соавт. (Muramoto et al., 1969) показали, что на Дальнем Востоке Pungitius pungitius и Pungitius tymensis не отличаются ни по числу (2n=42), ни по структуре кариотипа, а Pungitius sinensis лишь незначительно отличается от двух первых по морфологии хромосом. Вид Pungitius platygaster имеет диплоидный набор хромосом: 2n=42 (Е. Ю. Крысанов, личн. сообщ.).
Gasterosteus aculeatus и Gasterosteus wheatlandi имеют 2n=42 хромосом и незначительно различаются по морфологии хромосом, у Gasterosteus wheatlandi меньше на 2 пары метацентрических хромосом и соответственно меньше на 2 число плеч (52 против 54 у Gasterosteus aculeatus) (табл. 13). Интересно, что у Gasterosteus wheatlandi найдена мужская гетерогаметность типа XY, а у Gasterosteus aculeatus гетерогаметный пол цитогенетически не выявляется. У Apeltes, наоборот, гетерогаметностью обладают самки — типа WZ (Chen, Reisman, 1970).
Между trachurus и leiurus у трехиглой колюшки Японии не найдено различий покариотипам (Muramotoet al., 1969). Росс (Ross, 1973) показал, что калифорнийские формы Gasterosteus aculeatus: trachurus, leiurus, hologymna кариотипически полностью идентичны и не отличаются от Gasterosteus aculeatus из штата Мэн (США), исследованных Ченом и Рейсманом (Chen, Reisman, 1970). Росс (Ross, 1973) предпринял скрещивания между leiurus и hologymna и не нашел существенных различий между гибридами и контролем по таким показателям, как оплодотворяемость икры, смертность эмбрионов и личинок.
Наличие особой пары крупных субметацентрических хромосом у всех колюшковых свидетельствует, по мнению Чена и Рейсмана (Chen, Reisman, 1970), о монофилетическом происхождении колюшковых.
4.5.3. ПРОТЕИНОВЫЙ ПОЛИМОРФИЗМ
Сравнение электрофоретического (э/ф) спектра белков было произведено между разными формами внутри Gasterosteus aculeatus и между разными видами Pungitius. Сравнивая спектры белков у жилой leiurus и морской trachurus в р. Литтл Кэмпбелл (Британская Колумбия, Западная Канада), Хаген (Hagen, 1.967) нашел, что у обеих форм фиксированы разные аллели общего белка мышц, а у гибридной semiarmatus в зоне пространственного контакта присутствуют оба аллеля. Факт фиксации разных электроморф вне зоны контакта trachurus и leiurus говорит об отсутствии потока генов между ними. Мурамото и соавт. (Muramoto et al., 1969) обнаружили различия в изозимных спектрах глюкозо- 6-фосфат- и галактозо-6-фосфат-дегидрогеназы между проходной trachurus, с одной стороны, и жилой trachurus + leiurus — с другой, при отсутствии различий между двумя последними. Более существенная разница по изозимам Г-6-ФГД наблюдается между Gasterosteus aculeatus и видами Pungitius.
Эвайс (Avise, 1976) исследовал диморфную (trachurus+leiurus) пресноводную калифорнийскую популяцию Gasterosteus aculeatus «Фриант» по 15 локусам (11 локусов кодировали энзимы + 4 кодировали общий белок) и не нашел различий по всем локусам между обеими морфами. На этом основании автор сделал вывод о существовании единой интербредной популяции, несмотря на ее морфологический диморфизм. Средняя степень гетерозиготности популяции составляла 8 % (доля особей в популяции гетерозиготных на 1 локус), что, по мнению автора, сходно со средней степенью гетерозиготности рыб в целом. Сравнивая работы Хагена (Hagen, 1967) и Эвайса (Avise, 1976), можно заключить, что «электрофоретический» подход четко выявил ситуацию, когда одни и те же морфологические варианты (trachurus и leiurus) обнаруживают генетическое видовое единство в континентальной пресноводной популяции («Фриант») и выявляют репродуктивную изоляцию на морском побережье в другом районе (р. Литтл Кэмпбелл).
Белл и Ричкинд (Bell, Richkind, 1981) исследовали изменчивость 12 протеиновых локусов у Gasterosteus aculeatus в бассейне одного ручья (Браш-крик) на севере Калифорнии, причем здесь leiurus привязана к медленнотекущим водам с низким перепадом высот, а жилая trachurus — к быстротекущим водам с более резким перепадом высот. Авторы обнаружили, что 11 локусов были мономорфны и не различались у 2 морф, а 1 локус был полиморфным, но частоты э/ф-вариантов также не различались между морфами, что свидетельствует об отсутствии генетической изоляции между trachurus и leiurus в Северной Калифорнии.
В Италии (Северо-Западная Адриатика) обитает Gasterosteus aculeatus (морфа, leiurus), причем существует облигатно пресноводная форма и форма, способная вне сезона размножения мигрировать в солоноватые лагуны. Пресноводная форма имеет только гемоглобин НbA, а солоноватоводная полиморфна и имеет три типа гемоглобина: HbA, НЬВ и промежуточный HbAB (Raunich et al., 1972). Функциональное значение различий по спектру гемоглобина между пресноводной и солоноватоводной формами, а также физиологическое значение полиморфизма солоноватоводной формы неясны, и авторы не дают объяснений на этот счет. Можно предположить, что особенности э/ф-спектра гемоглобина связаны с разной эффективностью функционирования, когда рыба находится в воде разной солености. У мигрирующих рыб поэтому более выгоден полиморфизм, а у пресноводных, постоянно живущих в стабильной среде, — мономорфизм.
Мак-Фейл (McPhail, 1984) сравнивал э/ф-спектры 4 ферментов у двух симпатрических форм Gasterosteus aculeatus оз. Энос (о. Ванкувер, Канада), которых он считает генетически изолированными, по трем локусам; он нашел существенные различия в частотах аллелей между 2 формами. Одно из самых обширных исследований аллозимной изменчивости Gasterosteus aculeatus выполнено Витлер (Whitler, 1980, — цит. по: Bell, 1984) на о. Ванкувер и сопредельных районах материковой части Британской Колумбии (Тихоокеанское побережье Канады). Исследовано 8 локусов (6 из них полиморфны) у 73 морских и пресноводных популяций. Оказалось, что в целом пресноводные популяции намного более разнообразны, чем морские, хотя найдена и региональная дифференциация среди морских популяций. Малые изолированные пресноводные популяции менее генетически разнообразны, чем крупные озерные. Генетические дистанции между парами пресноводных популяций примерно сходны с таковыми между парами пресноводных и морских популяций, что свидетельствует о независимом происхождении пресноводных популяций от морских.
Совместно с В. И. Борисовым нами исследовалась аллозимная изменчивость пресноводных и морских популяций Gasterosteus aculeatus бассейна Белого моря (Кандалакшский залив) по общему белку, гемоглобину, α-глицерофосфат-, алкоголь- и лактат-дегидрогеназам. Сравнивались две морские выборки (trachurus), выборки из нескольких «старых» (возраст 5—7 тыс. лет) пресноводных изолированных озер (leiurus), выборка из пресноводной триморфной популяции, открытой для притока мигрантов trachurus из моря, и выборки из новообразованных пресноводных изолированных популяций (карьеров).
По гемоглобину во всех изученных популяциях был обнаружен мономорфизм, гемоглобин везде был представлен одной фракцией (одна полоса на геле), причем имелось полное совпадение э/ф-подвижности гемоглобина у trachurus и leiurus. По общему белку не выявилось значительной внутри- и межпопуляционной изменчивости, все мажорные фракции э/ф-спектра оказались мономорфными у морских и пресноводных популяций. Незначительная внутрипопуляционная изменчивость минорных фракций во всех анализируемых популяциях выявилась лишь в интенсивности окрашивания некоторых фракций, но эта изменчивость оказалась столь слабой, что не представлялось возможным подвергнуть ее строгому количественному анализу. По ферментам α-глицорофосфат и алькогольдегидрогенеза обнаружен мономорфизм при полном совпадении э/ф-подвижности фракций у морских и пресноводных популяций.
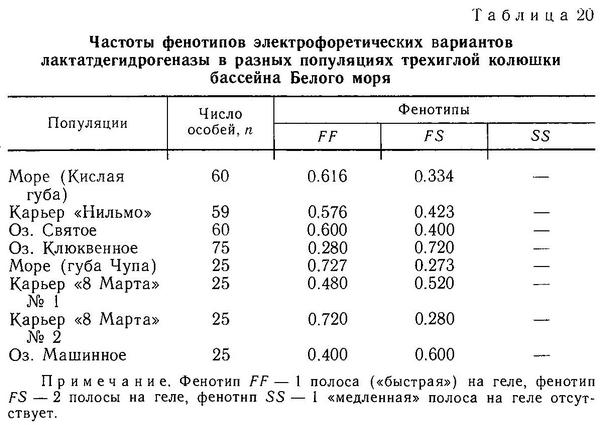
Полиморфным оказался фермент лактатдегидрогеназа (ЛДГ). Обнаружилось всего 2 полосы в э/ф-спектре этого фермента — быстрая (F) и медленная (S). Во всех популяциях обнаружен полиморфизм: есть фенотипы FF — одна полоса и FS — две полосы (табл. 20). Любопытным оказался факт полного отсутствия гомозигот по медленной фракции ЛДГ (SS), а также наличие полового диморфизма — в морских и молодых пресноводных популяциях все самки гомозиготны по FF, в молодых пресноводных популяциях все самцы гетерозиготны (FS), но в морских и «старых» озерных популяциях у самцов наблюдается полиморфизм (FF и FS). Однако в «старых» озерных популяциях и среди самок наблюдается полиморфизм (FF и FS) (рис. 33).
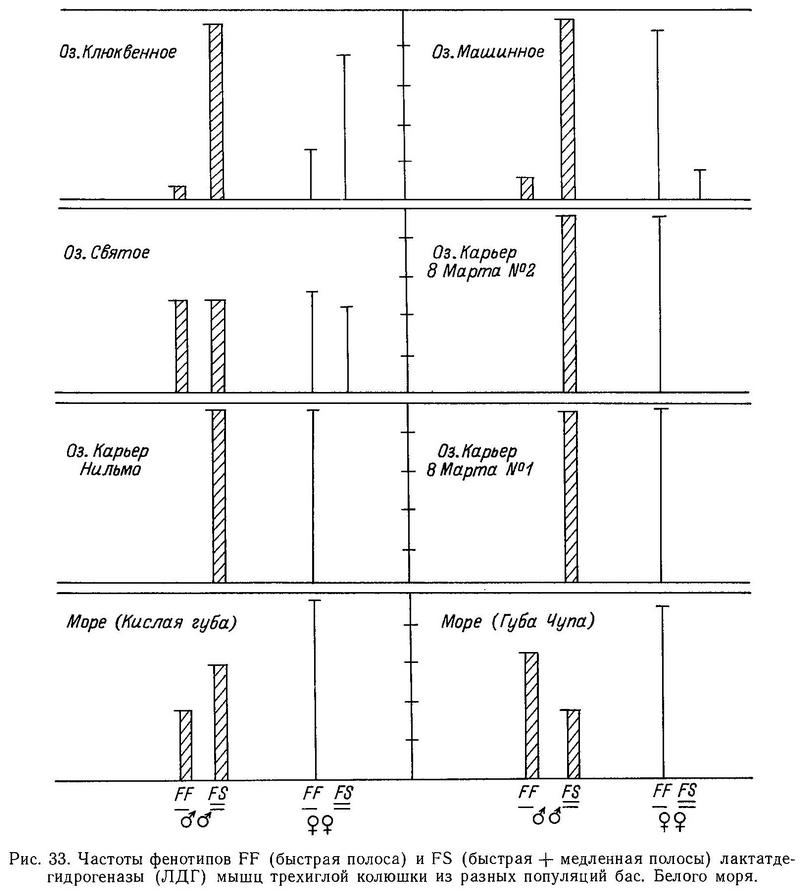
Факт наличия всего 2 полос трудно пока истолковать, поскольку известно, что ЛДГ кодируется аутосомными локусами и является белком-тетрамером (состоит из 4 полипептидных единиц) (Wessel, 1965), так что при диаллельном кодоминантном наследовании должно быть не 2 полосы, а больше. Медников (личн. сообщ.) считает, что в данном случае мы имеем дело с посттрансляционной модификацией части белковых молекул, изменяющих их э/ф-подвижность.
По мнению Васильева (личн. сообщ.), сцепление с полом аллелей F и S в большинстве популяций хорошо объясняется при допущении мужской гетерогаметности Gasterosteus aculeatus (у Gasterosteus wheatlandi цитогенетически доказана мужская гетерогаметность типа XY — Chen, Reisman, 1970). Тогда понятно, что фенотип SS в таких популяциях вообще не может возникать. В тех популяциях (старых озерных), где у самок имеется фенотип FS, объяснение может быть найдено в транслокации части половой хромосомы Y, несущей аллель S, на аутосомы. Ранее я предполагал (Зюганов, 1980), что отсутствие SS объясняется отбором против этого фенотипа, на что В. П. Васильев справедливо возразил, что тогда величина отбора для популяции оз. Клюквенное должна быть катастрофической, поскольку здесь частота гетерозиготного фенотипа FS у самцов составляет 0.9 и необходимо допустить сильную гибель гомозигот SS.
В целом изменения генотипического состава изозимного спектра ЛДГ можно представить по такой схеме (рис. 33).
Самки. В исходных морских популяциях имеется мономорфизм FF, который сохраняется при образовании молодой озерной популяции в течение нескольких десятков лет. С течением времени в старых озерных популяциях появляется аллель 5 в гетерозиготном состоянии. При вторичном образовании молодой изолированной пресноводной популяции leiurus (карьеры «8 марта» № 1 и 2) из старой (оз. Машинное) снова теряется аллель 5 и возникает мономорфизм FF.
Самцы. В исходных морских популяциях — полиморфизм (FF и FS). При изоляции в пресноводном водоеме — становление мономорфизма по FS уже через несколько десятков поколений. После пресноводной эволюции снова возникает полиморфизм (FF+FS), и после новой изоляции части старой озерной популяции опять возникает мономорфизм FS.
Общей тенденцией у самок и самцов являются исчезновение гетерогенности при вселении в новый водоем, что хорошо объясняется эффектом основателя, и вторичное возникновение гетерогенности в процессе «пресноводной» эволюции, что можно объяснить как повторными инвазиями, так и накоплением транслокаций части половой хромосомы Y на аутосомы.
Сравнение частот фенотипов ЛДГ между trachurus и leiurus в оз. Клюквенном (trachurus FF — 0.286, FS —0.714; leiurus FF — 0.282, FS — 0.718) выявило отсутствие достоверных различий, что свидетельствует о принадлежности этих морф к единой интербредной популяции (данные по другим белкам также подтверждают это). Не было найдено различий по ЛДГ между сеголетками и взрослыми рыбами в популяциях «Святое» и «Клюквенное».
Таким образом, анализ аллозимной изменчивости Gasterosteus aculeatus в бассейне Белого моря не выявил различий между морской trachurus и морфами пресноводных колюшек, которые свидетельствовали бы о значительной генетической дивергенции этих форм.
Сравнение э/ф-спектров глюкозо- и галактозо-6-фосфатдегидрогеназ у ряда форм и видов Pungitius было проведено в Японии (Muramoto et al., 1969). Pungitius pungitius и «trachura type Pungitius pungitius» (фенотипически сходный с Pungitius sinensis, но имеющий в отличие от последнего очень узкий ряд боковых пластин) идентичны по обоим белкам. Pungitius pungitius tymensis вообще не проявил активности (выявляемой электрофоретически) по белку Gal-6-DG, но спектр G-6-DG этого вида был идентичен таковому обеих форм Pungitius pungitius, хотя по активности полос Pungitius tymensis отличался от Pungitius pungitius. Спектры обоих белков Pungitius sinensis резко отличались от таковых вышеупомянутых видов и форм. Таким образом, выявились отличия по белкам между всеми 3 видами, признаваемыми японскими авторами, и не обнаружилось различий между 2 формами Pungitius pungitius.
По кариотипу Pungitius tymensis и Pungitius pungitius ничем не различались, но кариотип Pungitius sinensis отличался от двух первых по соотношению мета-, субмета-, субтело- и акроцентрических хромосом (Muramoto et al., 1969).
В целом аллозимная изменчивость у колюшковых изучена слабо по сравнению с морфологической, физиологической и этологической изменчивостью. Несомненно, более широкое применение метода электрофореза углубило бы наше понимание эволюции этой группы.
Иммунологические методы нашли еще меньшее применение для выяснения таксономических отношений внутри семейства. Известна лишь одна работа (Penczak, 1961 в), в которой изучена серологическая дистанция между Gasterosteum aculeatus и Pungitius pungitius в Польше. Оказалось, что межродовая дистанция велика — 56 % и сравнима, по мнению Пончака, с межродовыми дистанциями внутри семейств Cottoidae и Salmonidae.
Анализ данных, представленных в этом разделе, показывает, что внутри- и межпопуляционная изменчивость по многим рассмотренным здесь признакам имеет генетическую основу. Выяснить это очень важно, поскольку естественный отбор может «оперировать» только с изменчивостью, имеющей значительную генетическую компоненту. Если же изменчивость фенотипических признаков отражает лишь гетерогенность внешних условий, воздействующих на одинаковые генотипы, то отбор со стороны факторов внешней среды не приведет к эволюционным изменениям в популяциях.
4.5.4. ФАКТОРЫ ЭВОЛЮЦИИ
Из 4 известных элементарных эволюционных факторов — мутационный процесс, популяционные волны, изоляция, естественный отбор (Тимофеев-Ресовский и др., 1977) лучше других экспериментально изучено на колюшковых (в основном на Gasterosteus acicleatus) действие изоляции и отбора. Несомненно, что генотипическая изменчивость, наблюдаемая по многим признакам в родах Gasterosteus, Pungitius и Culaea, детерминирована действием мутационного процесса. Популяционные волны (флуктуации численности) у короткоцикловых колюшек также, видимо, играли большую роль в эволюции во время пиков и спадов численности, изменяя набор мутаций и их концентрацию в популяциях и приводя к колебанию давления естественного отбора. Сейчас все исследователи колюшковых согласны (см. сводки: Wootton, 1976, 1984; Bell, 1984), что у Gasterosteus aculeatus пресноводная морфа leiurus происходит независимо от морской trachurus в разных участках ареала. Следовательно, рецессивные мутации типа А→а аллелей, детерминирующих «пластинковые фенотипы», происходят независимо в разных пресноводных популяциях. Также независимо происходят мутации, приводящие к редукции спинных и брюшных колючек, тазового пояса у Gasterosteus, Pungitius, Culaea в разных частях их ареалов. Меланизм по брачной окраске Gasterosteus aculeatus наследственно детерминирован (см. раздел 4.5.1 ) и возникает в разных местах по Тихоокеанскому побережью Сев. Америки (McPhail, 1969; Hagem, Moodie, 1979; Bell, 1984); следовательно, мутации «меланизма» независимо происходят в разных участках ареала Gasterosteus aculeatus, хотя экспериментально действие мутационного процесса не изучено. Белл (Bell, 1976а) показал, что популяционные волны (пульсации ареала trachurus), происходящие в плейстоцене вследствие температурных колебаний, могли привести к современному фенотипическому разнообразию пресноводной формы Gasterosteus aculeatus на Тихоокеанском побережье Сев. Америки.
Действие изоляции как эволюционного фактора изучено на колюшках значительно лучше, чем действие популяционных волн. Существуют 2 типа доказательств действия изоляции: 1) исследование фенотипического разнообразия пресноводных колюшковых в местообитаниях, освободившихся от ледника в известное время; 2) экспериментальное вселение основателей в изолированные водоемы в недавнее время. Понятно, что первый тип доказательств является косвенным, второй тип — высокодостоверным, но естественно, что за короткое время изоляции трудно ожидать существенных генотипических сдвигов в популяции. Рассмотрим первый тип доказательств.
Муди и Реймчен (Moodie, Reimchen, 1976b) привели геологические доказательства, что озера островов Королевы Шарлотты (Тихоокеанское побережье Канады), ныне населенные Gasterosteus aculeatus, были покрыты льдом во время последнего оледенения 8—10 тыс. лет назад. Возраст оледенения определен радиоуглеродным методом. Современные популяции Gasterosteus aculeatus этих озер представлены морфами leiurus и hologymna (лишенные пластин вообще), а также колюшками, в ряде популяций лишенными тазового пояса, брюшных колючек и двух передних спинных колючек. Авторы заключают, что эти популяции эволюционировали in situ после отступления; ледника и вторичной колонизации морской формой trachurus. Дивергенции популяций способствовало наличие хищных рыб (лососевых) в одних озерах и их отсутствие в других, так что в ряде популяций колюшки имеют крупные размеры тела — до 12 см, длинные брюшные и спинные колючки (антихищнические адаптации), а в других — наружный скелет почти полностью утерян. Белл (Bell, 1974) сообщил, что у ряда популяций Gasterosteus aculeatus с о. Тексадо (650 км от островов Королевы Шарлотты) имеются сходные фенотипы leiurus и hologymna и наблюдается утеря колючек, но этот остров освободился от ледника 5 тыс. лет назад. Эти данные позволяют предполагать, что изоляция в пресноводном водоеме части морской популяции trachurus приводит к становлению мономорфизма малопластинковых и даже беспластинковых фенотипов за период в несколько тысячелетий. Однако механизм этого становления остается пока неизвестным.
Пенчак (Penczak, 1965, с. 23) обнаружил, что в Польше в прудовом хозяйстве «Вильчак» около г. Быдгощ обитала морфа trachurus (как и в соседних реках) и в 1937 г. в популяции Gasterosteus aculeatus не было найдено других морф. Однако около 30 лет спустя Пенчак обнаружил в ней 10 % semiarmatus и leiurus. Поскольку в Польше в целом морфа trachurus составляет 97.26 %, semiarmatus 1.83, a leiurus только 0.42 % (всего исследовано 2122 особи), то все leiurus Польши локализованы в этом пруду. Пенчак, делает, на мой взгляд, неверный вывод, что leiurus и semiarmatus мигрировали в Польшу из Германии, где доля leiurus и semiarmatus значительно выше, чем в Польше. Я полагаю, что в пруду «Вильчак» эти 2 формы образовались in situ в результате изоляции.
Мюнцинг (Münzing, 1963) предложил два возможных механизма образования мономорфных популяций leiurus в пресноводных водоемах (см. раздел 3): 1) миграция смешанных (триморфных) популяций из моря в пресный водоем и последующая селекция морфы leiurus; 2) мутация морфы trachurus — уменьшение числа боковых пластин — с последующим отбором leiurus.
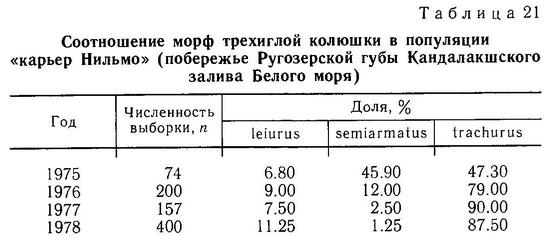
Нами предложен иной механизм возникновения и становления мономорфизма leiurus в пресноводных водоемах, который выдержал экспериментальную проверку (Зюганов, 1978, 1980, 1982, 1983а, 19836). Отправной точкой для гипотезы послужила находка в 1977 г. в бассейне Белого моря (побережье Кандалакшского залива) изолированного пресноводного водоема — карьера «Нильмо», где ранее добывали слюду, и затопленного грунтовыми водами в 1940 г. (Зюганов, 1978). По сообщениям местных рыбаков, в него было запущено в 1965 г. несколько десятков морских колюшек. Поскольку морская популяция Gasterosteus aculeatus состоит на 98—99 % из trachurus (Мухомедияров, 1966; Потапова, 1972; Зюганов, 1978), то и основатели, надо полагать, были представлены этим фенотипом. В 1975—1978 гг. популяция «карьер Нильмо» была уже триморфной, соотношение морф дано в табл. 21. Очевидно, полиморфизм в этой популяции является результатом выщепления морф leiurus и semiarmatus при вселении trachurus в изолированный водоем. Позже (Зюганов, 1983г) была исследована генетика «пластинкового» полиморфизма Gasterosteus aculeatus в бассейне Белого моря и сделаны экспериментальные вселения морских основателей trachurus в пресноводные изолированные водоемы, где и происходило сходное расщепление в течение 1—2 поколений и постепенное увеличение частоты leiurus и semiarmatus (табл. 22—25). Все эти факты позволяют предложить механизм возникновения и становления мономорфизма leiurus в пресноводных изолятах.
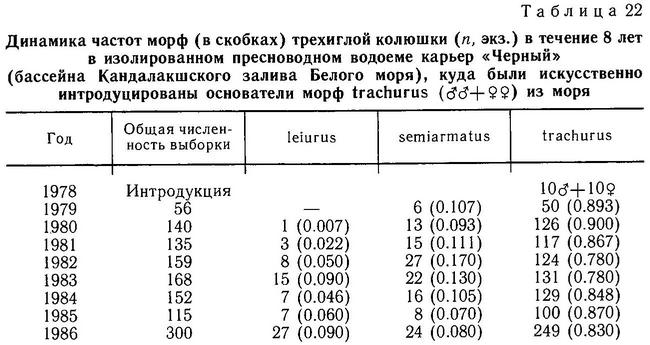
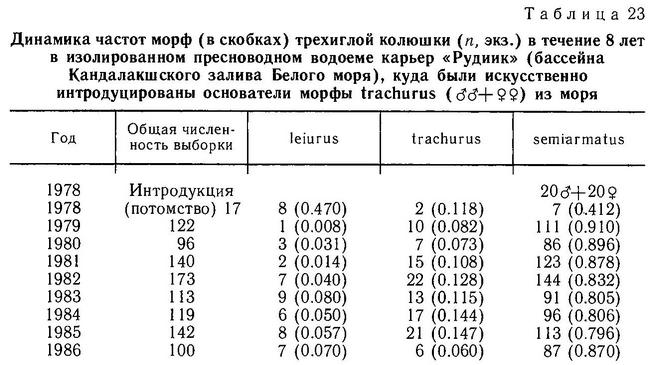
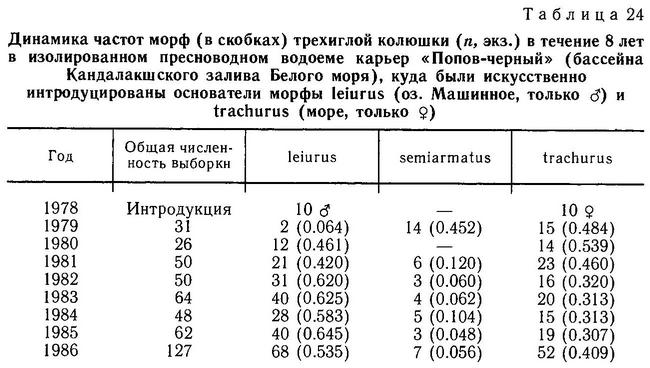
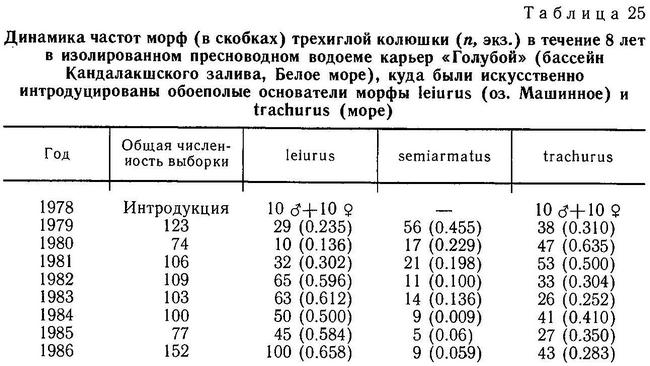
Рассматривая изменения генотипического состава популяций, мы можем судить об изменении не генофонда популяции в целом, а только частот аллелей конкретного признака — боковых пластин. Функция этото признака до конца так и непонята (Bell, 1984), и мы рассматриваем его как маркерный, видимо плейотропно или иным образом связанный с существенными компонентами приспособленности организма. Итак, морская мономорфная популяция trachurus насыщена рецессивными аллелями морфогенного локуса Аа, находящимися в гетерозиготном состоянии. Частоту аллеля а в морской популяции количественно трудно оценить, так как она может меняться по годам или от района к району. Однако можно считать, что она достаточно высока (видимо, не менее 0.1 в беломорской популяции), так как 20—40 основателей trachurus из моря достаточно для выщепления в первом поколении leiurus и semiarmatus при вселении в пресноводный изолированный водоем. Определенная степень гетерозиготности морской популяции, видимо, поддерживается повышенной приспособленностью гетерозигот по А, т. е. генотипа Аасс (trachurus). В то же время давление отбора в морской воде направлено против leiurus и semiarmatus, т. е. генотипов аасс, ааСс, ааСС, АаСс, АаСС, поскольку находки leiurus в море вовсе не отмечены, за исключением южного фланга ареала в Калифорнии (Bell, 1979b) и Италии (Raunich et al., 1972), a semiarmatus в полносоленой морской воде встречается с достаточно низкой частотой (0.5—2 %). Здесь уместно вспомнить данные Гутса (Gutz, 1970), установившего, что leiurus обладает только пассивным гипоосмотическим осморегуляторным механизмом, не эффективным в соленой воде дри относительно низких температурах, в то время как trachurus имеет активный осморегуляторный аппарат двустороннего действия (гипер- и гипоосмотический), эффективно действующий в морской и пресной воде в широком диапазоне температур.
При колонизации небольших изолированных пресных водоемов основателями морской trachurus резко повышается вероятность перехода рецессивных аллелей в гомозиготное состояние и выщепляется морфа leiurus, отбор которой в пресной воде, очевидно, благоприятствует. Происходит смена направления давления отбора. Дело в том, что рыбам в морской и пресной воде приходится решать диаметрально противоположные осморегуляторные проблемы: в морской воде выводить соли из тела против градиента и поглощать воду, а в пресной — поглощать соли и выводить воду из тела. Видимо, костные пластины плейотропно связаны с особенностями осморегуляции. Было показано, в частности, что верхним пределом активации спермиев морской trachurus является соленость 52 ‰, a leiurus соответственно 16‰ (в Белом море соленость 26 ‰) (Зюганов, Хлебович, 1979; Зюганов, 1981а, 1981б, 1983в, 1985б). Однако мы до сих пор не знаем точного механизма действия отбора, регулирующего частоты аллелей «А» и «а» в пресной воде. Возможно, фенотип leiurus селективно выгоден в слабоминерализованной и бедной кальцием воде олиготрофных водоемов, так как генотип «аа» — детерминирует редуцированный костный панцирь. Рыбы, представленные этим фенотипом, имеют меньшие энергетические траты на постройку костного панциря, куда входит кальций. Подробнее этот вопрос будет обсужден в разделе 4.5.5.
С течением времени отбор в пресноводных изолированных водоемах оставляет только морфу leiurus. Как видно из предыдущего для этого достаточно времени 5—8 тыс. лет (Bell, 1974). Однако, возможно, скорость становления мономорфизма leiurus еще выше. Так, оз. Машинное (где сейчас обитает мономорфная популяция leiurus), расположенное на побережье губы Чупа Кандалакшского залива Белого моря (Лоухский р-н Карельской АССР), по сообщениям местных жителей, всего 100 лет назад отделилось от моря. Ранее оно было морским заливом. Близость озера к морскому побережью (всего 150 м), его топография, размеры, а также известный факт постепенного поднятия беломорского щита (Авилов, 1966) — все это подтверждает недавнюю изоляцию озера от моря. Поэтому вполне возможно, что всего за 100 лет завершается становление мономорфизма leiurus.
До того как популяция достигнет мономорфизма leiurus и она пройдет более или менее длительную стадию транзитивного (переходного) полиморфизма, на этой стадии есть все три морфы. Превращение полиморфной пресноводной популяции в leiurus носит необратимый характер, как это следует из нашей схемы наследования (Зюганов, 1983 г.), и как это было подтверждено экспериментально обратным вселением «новообразованных» leiurus и leiurus из старой популяции (оз. «Машинного») обратно в морские условия (Зюганов, 1985а).
Примечательно, что на начальных этапах становления leiurus она является не более чем внутривидовой группировкой по отношению к trachurus (они могут быть членами одного помета). Однако эта внутривидовая группировка уже необратима, так как при осолонении водоема не может снова стать морской и вымрет. В то же время trachurus, родившиеся и живущие несколько поколений в пресной воде, могут беспрепятственно вернуться к морскому образу жизни. Ничто так ярко не опровергает широко распространенное в ихтиологии ошибочное мнение по поводу принципиальной разницы между внутривидовыми группировками и видами: «внутривидовые группировки обратимы, а виды нет... видовые различия необратимы, т. е. вид не может в отличие от большинства внутривидовых группировок превратиться в исходный, от которого он произошел (Никольский, 1980, с. 17, 57)», как факт невозможности возврата новообразованной leiurus в море.
Заметим, что термин «обратимость» можно понимать двояко: 1) как «превращение одной формы в другую при изменении условий», именно так понимал это Никольский (1980); 2) как «обмен генами». В данном случае выщепившаяся leiurus необратима в смысле Никольского (поскольку она гомозиготна по рецессивному аллелю «аа» и как бы ни менялись условия внешней среды, она не может превратиться в гетерозиготу «Аа» или гомозиготу по доминантному аллелю «АА» — trachurus). В смысле обмена генами leiurus необратима в морских условиях, так как не может скрещиваться с trachurus в море, leiurus там «стерильна», но обратима в пресной воде, так как способна там к обмену генами с trachurus.
Причины, по которым leiurus из относительно древних пресных водоемов неспособна жить в море, более или менее понятны. Например, Мак-Фейл (McPhail, 1969) для leiurus из Британской Колумбии, Линдсей (Lindsey, 1962а) для leiurus из Англии и Хойтс (Heuts, 1947b) (Бельгия) экспериментально показали низкую выживаемость ее икры в морской воде. Между тем в бассейне Белого моря развитие икры и личинок leiurus из озер Святое, Лобанежское и др. в морской воде происходило нормально. Взрослые особи из тех же озер в лотках с морской водой соленостью 26 ‰ (t=18 °С) жили в течение 1 мес без видимой потери жизнеспособности (Соин, Зюганов, 1979). Хойтс (Heuts, 1947b) и Хлебович (1968) на основании экспериментов пришли к выводу, что взрослые особи и морской trachurus, и пресноводной leiurus обладают осморегуляторным механизмом двустороннего действия, обеспечивающим гипер- и гипоосмотическую регуляцию соответственно в пресной и морской воде. Однако Гуте (Guts, 1970) показал, что leiurus из бассейна Балтийского моря в отличие от анадромной trachurus, которая имеет активный механизм осморегуляции, обладает только пассивной осморегуляцией за счет увеличения массы пула свободных аминокислот при увеличении солености внешней среды. Этот механизм хорошо работает лишь при сравнительно высоких (порядка 20 °С) температурах и неэффективен при низких (1—4°С). Поэтому при понижении температуры от 20 до 1 °С выживаемость взрослых особей leiurus в морской воде быстро падает (Guts, 1970). Кроме того, обнаружено, что сперматозоиды leiurus из древних пресноводных популяций бассейна Белого моря (озера Лобанежское, Машинное и др.) не активируются в солоноватой воде свыше 16 ‰, даже если половозрелый самец leiurus перед опытом выдерживался 1 мес в аквариуме с морской водой. В то же время сперматозоиды самцов trachurus активируются и в пресной, и в морской воде до 50 ‰ (Зюганов, Хлебович, 1979; Зюганов, 1981а, 1981б).
Белл (Bell, 1979b) сообщил, что в морской лагуне (Калифорния) соленостью 32 ‰ наблюдал нерест leiurus. Это было летом, после пересыхания пресного ручья, впадающего в лагуну, где постоянно обитала популяция leiurus. Возможно, что в южных частях ареала колюшки leiurus не утратили способности к обитанию в море из-за того, что пассивная осморегуляция leiurus «срабатывает» в относительно теплой морской воде.
Сравнительно длительный период становления мономорфизма leiurus свидетельствует о том, что различия в приспособленности к пресноводным условиям между leiurus и двумя другими морфами относительно невелики. Даже небольшой поток генов trachurus из моря (вторичный контакт) стабильно поддерживает триморфизм в пресноводных популяциях, как это происходит, например, в озерах Клюквенное и Марцы на беломорском побережье (Зюганов, 1978). Искусственно спровоцированный одноразовый контакт между морской trachurus и пресноводной leiurus в изолированных карьерах (Голубой, Попов-черный) (Зюганов, 1982, 1983г) привел к возникновению триморфных популяций в следующем поколении и поддержанию полиморфизма в течение 8 лет слежения за ними (табл. 24, 25). Кроме того, существование нескольких десятков полиморфных континентальных изолированных популяций Gasterosteus aculeatus на Тихоокеанском побережье Сев. Америки (Hagen, Gilbertson, 1972; Bell, 1984) свидетельствует о небольшой величине различий в приспособленности каждой из трех морф к пресноводным условиям и, возможно, говорит о разнонаправленности действия отбора в разных пресноводных местообитаниях, хотя в большинстве этих популяций частота leiurus все же велика: 0.8—0.9.
В некоторых случаях эволюция пресноводных популяций идет еще дальше и leiurus превращаются в морфу hologymna (голая). Жиль (Giles, 1983) сопоставил концентрацию кальция в изолированных пресных водоемах на Гебридских островах (Великобритания) с фенотипической структурой популяций Gasterosteus aculeatus, населяющих эти озера. Оказалось, что мономорфизм hologymna наблюдается в водоемах, где концентрация кальция составляет 0.94—2.5 мг/л, а мономорфизм leiurus — при 1.8—28.3 мг/л (в среднем 13 мг/л). Хотя связй концентрации кальция в водоеме и морфы Gasterosteus aculeatus, там обитающей, не абсолютна, все же видно, что морфа hologymna обитает в водоемах с пониженной концентрацией Са++ примерно в 10 раз по сравнению с местообитаниями leiurus. Ихтиофауна Гебридских островов сформировалась 8—10 тыс. лет назад после отступления ледника в плейстоцене, и Жиль (Giles, 1983) считает, что пресноводные формы Gasterosteus aculeatus сформировались из морской trachurus (сейчас trachurus нет в этих островных водоемах).
Концепция Мюнцинга (Münzing, 1963) о происхождении leiurus пресноводных водоемов, постулировавшая либо мутации (уменьшение числа пластин у проникшей в озера trachurus), либо проникновение морфы leiurus из моря как компонента смешанной группы основателей из моря, и последующее увеличение доли leiurus за счет отбора, вызывает серьезные сомнения. Малоубедительно возникновение одних и тех же мутаций в озерных популяциях и их закрепление в столь многих случаях.
Концепция, изложенная выше (изначальная гетерозиготность морской популяции и переход рецессивных аллелей, детерминирующих leiurus, в гомозиготное состояние при колонизации trachurus пресноводного водоема), выглядит, на наш взгляд, предпочтительнее и к тому же проверена экспериментально.
По моему мнению, сходным путем leiurus формировалась не только в бассейне Белого моря, но и в других частях ареала Gasterosteus aculeatus. Так, поданным С. В. Марфина (личн. сообщ.), в Ленинградской обл. (в черте г. Ленинграда в р. Неве и на побережье Финского залива) обитает только морфа trachurus с незначительной 0.5—1 %) примесью semiarmatus. Однако в одном изолированном пруду в районе проспекта Славы в черте города в 1984 г. им была найдена морфа leiurus; пруд был изолирован от Невы постройкой дамбы несколько лет назад. Очевидно, что прерывание потока генов trachurus из многочисленной популяции Невы в популяцию малого водоема привело к выщеплению и накоплению частоты leiurus.
Белл и Баумгартнер (Bell, Baumgartner, 1984) описали Gasterosteus aculeatus из небольшого пруда (10х26 м) близ г. Бостон (штат Массачусетс, США) на Атлантическом побережье США. В этой прудовой изолированной популяции доля leiurus составила 13.5 %, semiarmatus 1.7 и trachurus 80.9 %. Этот пруд расположен в бассейне р. Мадди, в которой Gasterosteus aculeatus не найдена вообще. Однако на восточном побережье Сев. Америки подавляющее большинство популяций пресноводных Gasterosteus aculeatus представлено морфой trachurus (за тремя исключениями — Bell, 1984). Очевидно, именно изоляция в малом водоеме части популяции trachurus привела к выщеплению leiurus, хотя Белл (Bell, 1984), на мой взгляд, ошибочно полагает, что дрейф генов привел к полиморфизму в этой прудовой популяции. Выше уже приводились данные Пенчака (Penczak, 1965), обнаружившего возникновение морфы leiurus через 30 лет после изоляции прудовой популяции, хотя вокруг существовали многочисленные популяции trachurus. Поэтому наша концепция «прохождения узкого горлышка» численности морской trachurus в пресной воде, приводящая к выщеплению leiurus, применима и к другим районам ареала Gasterosteus aculeatus. Хаген и Моди (Hagen, Moodie, 1982) предприняли попытку объяснить распределение морфы leiurus в пределах всего ареала. Они нашли, что leiurus имеет тенденцию к отсутствию в тех местах, где есть холодные зимы и выражена большая разница между среднеянварскими и среднеиюльскими температурами. Они полагают, что leiurus получает преимущество в тех местах, где климат теплый или умеренный и где внутригодовые колебания температур невелики, в то время как trachurus получает преимущество там, где колебания годовых температур сильны. В подтверждение своей гипотезы они приводят карту распространения форм с зимними и летними изотермами. Их модель хорошо объясняет в целом североамериканское и западноевропейское распространение форм Gasterosteus aculeatus, но авторы, к сожалению, игнорировали данные по восточноевропейскому и восточноазиатскому распространению leiurus в водоемах СССР. Известно, что многочисленные мономорфные популяции leiurus обитают в Карелии, на Кольском полуострове, Камчатке (Берг, 1949; Потапова, 1972; Зюганов, 1978, 1980). Хаген и Муди (Hagen, Moodie, 1980) игнорируют эти многочисленные исключения под тем предлогом, что «локальный климат» в этих местах может быть иным, т. е. более теплым, нежели в окружающих районах с суровым климатом и большим перепадом зимне-летних температур. Однако, судя по нашим собственным наблюдениям (Зюганов, 1980), поверхностная температура воды в озерах Мурманской обл. и Карелии, где обитают мономорфные популяции leiurus, достигает в июле 15—18 °С, а сами водоемы замерзают с ноября по конец мая (температура воды около 0°С). Таким образом, налицо и резкий перепад зимне-летних температур, и суровый «локальный» климат. То же самое можно сказать относительно мономорфных популяций leiurus в водоемах Камчатки. Хагену и Муди (Hagen, Moodie, 1982) из данных Потаповой (1972) было известно одно исключение — мономорфная популяция leiurus из оз. Дальнего. Эти авторы, а вслед за ними и Белл (Bell, 1983) полагают, что это озеро теплое, когда на самом деле оно замерзает более чем на полгода и летом температура воды в нем 15—18 °С (Крохин, 1970). Недавно было найдено несколько мономорфных озерных популяций leiurus в бассейне р. Камчатки, в частности в оз. Азабачьем (Зюганов и др., 1987). И для этого озера имеются температурные данные (Крохин, 1970), указывающие на холодный климат и наличие ледового покрова с середины ноября по середину июня (7 мес).
Поэтому из климатической закономерности, подмеченной Хагеном и Муди (Hagen, Moodie, 1980), имеется слишком много исключений, чтобы считать ее всеобщей, и популяции leiurus существуют, таким образом, не только в теплом и умеренном климате, но и в условиях сурового климата Севера.
Судя по всему, границы ареала Gasterosteus aculeatus, а также формообразование внутри этого таксона контролируются комбинацией таких важнейших абиотических факторов, как температура, соленость, минеральный состав воды, причем в разных частях ареала относительный вклад каждого из них варьирует. Баумгартнер и Белл (Baumgartner, Bell, 1984) выявили еще один абиотический фактор, влияющий на распределение морф Gasterosteus aculeatus. Для рек и ручьев Калифорнии они обнаружили, что жилая trachurus встречается на участках с большим перепадом высот (быстрое течение), a leiurus на участках с медленным течением. В этой части побережья штата Калифорния нет морской trachurus, и поэтому распределение двух морф в текущих водоемах выглядит необычным: trachurus обитают в верховьях рек и ручьев, a leiurus — в низовьях, устьях ручьев и лагунах.
В своей сводке Белл (Bell, 1984) подчеркивал, что есть «крупномасштабный» (в пределах всего ареала, — В. З.) характер географического распределения морф и «мелкомасштабный» (микрогеографическая изменчивость). «Крупномасштабная» географическая изменчивость — это наличие на южном фланге ареала (южная Калифорния, Средиземное море) мономорфных популяций leiurus и hologymna и отсутствие trachurus; это существование зоны в умеренных широтах, где наблюдаются повышенная частота semiarmatus и высокая степень полиморфизма Gasterosteus aculeatus (средняя Калифорния, штаты Орегон, Вашингтон, Британская Колумбия — Сев. Америка; Северное море, Западная Балтика — Европа). Ранее такой характер «крупномасштабной изменчивости объясняли дивергенцией изолированных популяций и широким фронтом вторичного контакта. Например, для тихоокеанского побережья Сев. Америки Миллер и Хаббс (Miller, Habbs, 1969) фенотипическое разнообразие Gasterosteus aculeatus объясняли вторичным контактом ранее изолированных трех подвидов: Gasterosteus aculeatus aculeatus (trachurus), Gasterosteus aculeatus microcephalus (leiurus), Gasterosteus aculeatus williamsoni (hologymna). Позднее Хаген и Мак-Фейл (Hagen, McPhail, 1970), а также Белл (Bell, 1976, 1984) подвергли критике эту концепцию, показав полифилетическое происхождение двух последних «подвидов» и придя к выводу о решающей роли отбора в независимом становлении полиморфизма пресноводных популяций на Тихоокеанском побережье Сев. Америки. Такой же критике была подвергнута аналогичная концепция Мюнцинга (Münzing, 1963) для Европы, по которой он считал, что гибридизация между «южной малопластинковой» расой из Средиземноморья и «северной» расой из севера Европы привела к морфологическому разнообразию в Европе. Однако при этом он игнорировал существование мономорфных многочисленных популяций leiurus на севере Европы. Критика способа возникновения leiurus в пресных водах дана выше в этом разделе.
Белл (Bell, 1984) полностью разделяет концепцию Хагена и Муди (Hagfen, Moodie, 1982) о климатической детерминации современного распределения морф по ареалу. Критика этой гипотезы также дана выше, и эта гипотеза также не в состоянии объяснить «крупномасштабное» распределение морф по ареалу. Не боясь впасть в повторение, хочу подчеркнуть, что объяснение надо искать в комбинации факторов (температура, соленость, минеральный состав воды, вторичная интерградация, хищники, конкуренты и т. д.), причем в разных частях ареала и вклад разных факторов может быть различен. Вот почему для каждого «глобального» объяснения можно найти много исключений.
Что касается «мелкомасштабной» (= микрогеографической) изменчивости фенотипического разнообразия морф, то здесь выявлены очень интересные ситуации. В частности, уместно привести вышеупомянутый пример, когда Баумгартнер и Белл (Baumgartner, Bell, 1984) нашли связь между скоростью течения в реках и ручьях Калифорнии и распределением trachurus и leiurus.
Американские авторы на западном побережье Сев. Америки исследовали ряд интересных ситуаций, когда определенные биотические факторы (хищные рыбы, птицы, рептилии, насекомые, паразиты и конкуренты) определяли эволюцию фенотипического разнообразия колюшковых и детерминировали микрогеографическую изменчивость по разных признакам.
Мак-Лиан (Maclean, 1980) исследовал триморфную популяцию оз. Хейшолт (Британская Колумбия) и нашел, что за несколько лет частота semiarmatus снизилась из-за более высокой интенсивности инвазии Schistocephalus solidus по сравнению с trachurus и leiurus, частота которых увеличилась. Он также нашел гетерогенность пространственного распределения морф в озере. Если весной (вне нереста) морфы распределены случайно, то в июне самки leiurus занимают самые мелкие участки литорали, trachurus занимают наибольшую глубину, a semiarmatus — узкую зону на промежуточной глубине. В одном участке озера самцы и самки leiurus и trachurus были более «территориальны», a semiarmatus более «мобильны». По его мнению, «территориальность» самок связана с увеличением их «репродуктивности» (плодовитости), а более «территориальные» самцы охраняют большую территорию.
Гильбертсон (Gilbertson, 1980, — цит. по: Bell, 1984) исследовал диморфную (leiurus+semiarmatus) озерную популяцию Gasterosteus aculeatus на Аляске за 11 лет и также нашел падение частоты semiarmatus с 0.21 до 0.12 за этот период. Вопреки данным Мак-Лиана (Maclean, 1980), semiarmatus в популяции, изученной Гильбертсоном (Gilbertson, 1980), имела более низкую экстенсивность инвазии Schistocephalus solidus. Гильбертсон (Gilbertson, 1980) приходит к выводу, что дифференциальная репродукция детерминировала временную изменчивость в частотах морф. В этой популяции есть рыбы 3 возрастных классов: годовики, двух- и трехгодовики. Автор не нашел резких изменений в соотношении морф между возрастными классами I и II, а также II и III. Не обнаружил он также селективного хищничества на морфы со стороны щуки и лосося Salmo clarki, поэтому он и пришел к выводу о дифференциальном репродуктивном успехе морф. Однако Хэй (Hay, 1974, — цит. по: Bell, 1984), исследуя диморфную (leiurus+semiarmatus) популяцию Gasterosteus aculeatus в Британской Колумбии, обнаружил, что Salmo clarki и водный скорпион Ranatra fusca селективно выедают более мелких особей и в то же время leiurus растут медленнее, чем semiarmatus. Тэелл (Bell, 1984) предполагает, что в популяции, изучаемой Гильбертсоном (Gilbertson, 1980), либо semiarmatus росли хуже leiurus, либо semiarmatus росли лучше leiurus, но хищники выедали более крупных, что и привело к падению частоты semiarmatus.
Хаген и Гильбертсон (Hagen, Gilbertson, 1972) на западном побережье США и Канады обнаружили, что модальное число пластин (на одной стороне тела) было 7 (у 70—80 % особей) в пресноводных популяциях, находящихся под сильным прессом хищных рыб (лососи рода Salmo). Интересно, что неважно, какая морфа имела 7 пластин, leiurus или semiarmatus. У рыб из этих популяций были также значительно длиннее брюшные и спинные колючки, чем у не подверженных хищничеству. Данные авторов были подтверждены Муди и Реймченом (Moodie, Reimchen, 1976а, 1976b) на островах Королевы Шарлотты, Беллом и Ричкиндом (Bell, Richkind, 1981) на калифорнийских колюшках и Гильбертсоном (Gilbertson, 1980) для колюшек Аляски. Хаген и Гильбертсон (Hagen, Gilbertson, 1972) также нашли, что колюшки из крупных озер имеют больше жаберных тычинок, позвонков и более прогонистое тело, по сравнению с ручьевыми, что отражает разницу в образе жизни между ними. Муди (Moodie, 1972b) нашел, что средняя длина спинных колючек у самок, добытых из желудков лососей Salmo clarki оз. Майр, существенно меньше, чем у пойманных в озере. У колюшек из желудков также существенно выше частота 8-пластинковых особей, чем у живущих в озере, в то время как у озерных колюшек частота 7-пластинковых фенотипов составляла 73 %. У парапатричной ручьевой формы, живущей в мелких ручьях, впадающих в это озеро, частота 7-пластинковых особей составляла всего 2 %. Хаген и Гильбертсон (Hagen, Gilbertson, 1973b) показали, что в оз. Вапато (штат Вашингтон) 7-пластинковые особи в желудках Salmo galrdneri встречались гораздо меньше, чем 8-, 9- или 6-пластинковые. Муди и соавт. (Moodie et al., 1973) в лабораторных экспериментах обнаружили, что 7-пластинковые особи лучше избегают хищников Salmo clarki и Ptychochelius oregonensis в зимних условиях, так что не само по себе наличие 7 пластинок защищает колюшек от хищных рыб, а этот фенотип, видимо, плейотропно связан с определенными поведенческими чертами, способностью эффективно «уворачиваться» от хищных рыб.
Белл и Хаглунд (Bell, Haglund, 1978) обнаружили, что в эксперименте 10-пластинковые (5 слева + 5 справа) колюшки достоверно эффективнее избегают потенциального хищника — водяного ужа Tamnophys couchi hammondi. Лучшая избегаемость 10-пластинковых рыб в опыте не зависела от модального числа пластин в популяции, откуда взята рыба. Этот уж широко распространен в водоемах Калифорнии, где отсутствуют лососи и вообще ихтиофауна очень бедна; модальное число пластин у колюшек — в южнокалифорнийских популяциях 5, а не 7, как в более северных районах, где уж отсутствует. Интересно, что избегание хищников не зависит от модального числа пластин в популяции, откуда взяты рыбы для опыта. Хотя полевых данных о выедании колюшек ужами мало, авторы полагают, что уж может быть важным фактором отбора в природных популяциях Gasterosteus aculeatus.
Популяция Gasterosteus aculeatus оз. Вапато (штат Вашингтон) произошла от основателей из соседнего оз. Челан, где 46 % особей имели 7 пластин. Эта популяция была изучена Хагеном и Гильбертсоном (Hagen, Gilbertson, 1973b) на предмет селективного хищничества колюшек лососем Salmo gairdneri. Оказалось, что за три года (с 1968 по 1970) частота 7-пластинковых колюшек увеличилась с 45 до 62 %. Лосось переходит на питание колюшкой зимой, и в желудках лосося 7-пластинковые фенотипы почти не попадались, а другие фенотипы были «сверхпредставлены» в желудках. Таким образом, в популяции шел направленный отбор. Сходные результаты были получены Гильбертсоном (Gilbertson, 1980) для популяции оз. Алекнагик (Аляска), находящейся под прессом селективного хищничества щуки и арктического гольца Salvelinus alpinus. Таким образом, в 4 районах (Аляска, материковая и островная Британская Колумбия, штат Вашингтон, Калифорния) по 4 видам хищных рыб (Salmo clarki, Salmo gairdneri, Esox lucius, Salvelinus alpinus) показано, что 7-пластинковые фенотипы имеют повышенную селективную ценность при симпатрии с хищниками.
Разница в лучшем избегании хищных рыб 7-пластинковыми колюшками и лучшего избегания ужей 6-пластинковыми особями остается пока загадкой (Bell, 1984).
Интересно, что у европейских leiurus не отмечено такой тесной связи 7-пластинковых фенотипов с наличием в водоемах хищных рыб (Gross, 1977; Paepke, 1982) в Центральной и Южной Европе (мода — 5 боковых пластин). В бассейне Белого моря на о. Великом популяции оз. Святого, где есть хищники кумжа и окунь, колюшка имеет среднюю по пластинам М=4.8, а в соседнем оз. Лобанежском, где нет другой рыбы, кроме Gasterosteus aculeatus, — М=5.0 (Зюганов, 1980), так что никакой связи преимущественного выживания 7-пластинковых особей с хищниками нет. Такие поведенческие признаки, как предпочтение разных мест для гнездования и агрессивность, различаются среди самцов с разным числом боковых пластин у leiurus (Huntingford, 1977; Kynard, 1979). Реймчен (Reimchen, 1983) показал, что грудные 4-5 пластин контактируют с птеригиофорами спинных колючек и с тазовым поясом, так что они сильно укрепляют колючки против внешних усилий, отклоняющих пластины в стороны. У рыб экспериментальное удаление пластин приводило к отклонению спинных колючек на существенно больший угол в сторону при одной и той же силе, чем у неповрежденных рыб (Reimchen, 1983). Это важно, когда хищник глотает колюшку и она в ответ растопыривает колючки. Ясно, что эти 4—5 грудных пластин функционально очень важны, даже в онтогенезе они появляются первыми (Igarashi, 1970), но какое значение имеют пластинки, лежащие кпереди и сзади от этих 4-5 грудных пластин, менее ясно.
Реймчен (Reimchen, 1983) полагает, что три наиболее передние мелкие боковые пластины, хотя и не сочленяются со спинными щитками, создают дополнительную защиту передней части тела рыбы от зубов лососей. В частности, они могут защищать выходы нервов боковой линии и отросток блуждающего нерва.
Кроме фенотипического разнообразия Gasterosteus aculeatus по боковым пластинам американскими авторами получены многочисленные доказательства действия хищников как селективного фактора на такие «защитные» структуры, как спинные, брюшные колючки и тазовый пояс. Полевыми наблюдениями и экспериментами установлено, что хищные лососевые рыбы являются фактором, контролирующим увеличение длины и крепости спинных и брюшных колючек, а также размеры тазового пояса. Примеры рассмотрены в разделе 1.6. Напротив, в популяциях Gasterosteus aculeatus и Culaea inconstans, не подвергающихся давлению хищных рыб, наблюдается редукция этих защитных структур (см. раздел 1.6). Реймчен (Reimchen, 1980) на основании своих данных пришел к выводу, что отсутствие хищных лососевых рыб влечет возникновение большой плотности водных насекомых в литоральной зоне водоема, где хищные насекомые (в основном личинки стрекоз) выедают мальков колюшек. Им легче хватать «околюченных» мальков, чем с «гладкой поверхностью», т. е. лишенных брюшных колючек и брюшной пластины. Таким образом, фенотипическое разнообразие Gasterosteus aculeatus по защитным структурам зависит от взаимодействия двух селективных агентов: хищных позвоночных (отбор на наличие колючек) и насекомых (отбор на отсутствие колючек). Белл (Bell, 1984) полагает, что механизм, предложенный Реймченом (Reimchen, 1980) для Gasterosteus aculeatus, может быть применен также к Pungitius и Culaea. Вывод Реймчена (Reimchen, 1980) частично был подтвержден на Culaea inconstans в эксперименте: водный жук Dytiscus селективно выедал рыб с нормально развитым тазовым поясом и брюшными колючками, чем «редуцированных», но и только когда у рыб было 5 спинных колючек. Если же в эксперименте использовались рыбы с 6 спинными колючками, то жуки равновероятно выедали «норму» и «редуцированных», что предполагает существование поведенческих различий между 5- и 6-колючковыми фенотипами.
Окраска. Меланизм брачной окраски самцов Gasterosteus aculeatus отмечен для небольшого числа популяций (см. раздел 1.4) островов королевы Шарлотты (Moodie, 1972а, 1972b) и материковой Британской Колумбии (McPhail, 1969; Hagen, Moodie, 1979; Hagen et al., 1980). Семлер (Semler, 1971) отмечал аналогичный меланизм для популяции оз. Вапато (штат Вашингтон, США), где популяция была полиморфна: «красные» и «не красные» самцы, а Белл (Bell, 1982) отмечал меланизм для одной высокогорной калифорнийской популяции и нашел такой же полиморфизм, что и Семлер (Semler, 1971). Однако все отмеченные случаи меланизма по брачной окраске локализованы на Тихоокеанском побережье Сев. Америки.
Генетика полиморфизма брачной окраски изучена только для популяции бассейна р. Чехэлис (материковая Британская Колумбия) и сопредельных речных бассейнов (см. настоящий раздел).
Мак-Фейл (McPhail, 1969) и позднее Хаген и Муди (Hagen, Moodie, 1979) показали, что главным фактором, детерминирующим возникновение меланизма по брачной окраске Gasterosteus aculeatus бассейна р. Чехэлис, является эндемичная для этого района рыбка Novumbra hubbsi, имеющая сходные размеры тела с Gasterosteus aculeatus, черный цвет тела и обладающая территориальностью во время нереста. Вначале Мак-Фейл (McPhail, 1969) предположил, что Novumbra является хищником по отношению к молоди Gasterosteus aculeatus и действительно установил в эксперименте, что молодь «black» намного эффективнее избегает Novumbra, чем молодь «red». Однако в природе Мак-Фейл (McPhail, 1969) не находил молоди колюшек в желудках Novumbra. Хаген и соавт. (Hagen et al., 1980) в эксперименте показали, что «черные» самцы Gasterosteus aculeatus имеют больший успех в охране гнезд, чем «красные», поскольку территориальные самцы Novumbra существенно чаще вторгались на участки хорошо заметных «красных» самцов. Однако в отсутствие Novumbra «red»-самцы захватывают большую гнездовую территорию, чем «black»-самцы и, следовательно, имеют больший репродуктивный успех. Авторы объясняют возникновение и эволюцию «черносамцовых» популяций Gasterosteus aculeatus как конвергенцию брачной окраски колюшки с таковой Novumbra, что облегчает оборону гнездовой территории. Муди (Moodie, 1972b) показал на черносамцовой популяции оз. Майер (острова Королевы Шарлотты), что хищные лососевые рода Salmo чаще атакуют искусственно окрашенных помадой «красных» самцов, чем «черных». Однако Семлер (Semler, 1971) на популяции оз. Вапато (штат Вашингтон) показал, что самки при нересте оказывают предпочтение искусственно окрашенным помадой «красным» самцам, чем «черным». Очевидно, полиморфизм в полиморфных по окраске самцов популяциях может поддерживаться разнонаправленными силами: преимуществом «красных» самцов во время половой фазы нереста и преимуществом «черных» самцов во время родительской фазы нереста при симпатрии с хищниками или конкурентами, такими как Novumbra.
Интересно, что Мак-Фейл (McPhail, 1969) в эксперименте обнаружил предпочтение самками (взятыми из мономорфных черносамцовых популяций, симпатричных с Novumbra) именно «красных» самцов (взятых для опыта из аллопатричных популяций), а не «своих» «черных». Однако те же самки при предъявлении им в опыте «красных» самцов из парапатричных популяций «отвергали» их. Мак-Фейл (McPhail, 1969) интерпретирует эти результаты как наличие факта неполной этологической репродуктивной изоляции, призванной уменьшить «загрязнение генами из «красносамцовых» парапатричных популяций «черносамцовые» популяции. Белл (Bell, 1976b) считает, что здесь налицо эффект репродуктивного смещения признаков. Более подробно изолирующие механизмы между «красносамцовыми» и «черносамцовыми» популяциями будут обсуждены в разделе 4.5.6.
Факторы эволюции других видов колюшковых изучены намного слабее, чем у Gasterosteus aculeatus. Мюнцинг (Münzing, 1969) отводил большую роль плейстоценовым оледенениям, как фактору, приводящему к изоляции в разных рефугиумах плейстоценовых Pungitius, что привело к образованию аллопатричных форм Pungitius. В западно-европейском рефугиуме возникла беспластииковая форма laevis, а в понто-арало-каспийском «опластиненная» форма platygaster. В восточно-азиатском рефугиуме возникла опластиненная и с килем форма sinensis. Мак-Фейл (McPhail, 1963) также полагает, что морфологическая дифференциация в Сев. Америке на «берингийскую» и «миссисипскую» формы произошла из-за изоляции и дивергенции в берингийском и миссисипском плейстоценовых рефугиумах во время висконсинского оледенения. Однако Гросс (Gross, 1979), изучавший географическую изменчивость Pungitius pungitius, Pungitius platygaster, Pungitius pungitius laevis в Европе, обнаружил сходную клинальную изменчивость в широтном направлении всех трех форм по признакам «число лучей; в спинном и анальном плавниках, число спинных колючек», а по признакам «число жаберных тычинок, высота тела и длина брюшной колючки» он нашел межпопуляционную изменчивость, которую связывает с различиями в питании, гидрологических особенностях водоемов и давлением хищников. Таким образом, Гросс (Gross, 1979) полагает, что дифференциация по исследуемым признакам «произошла позднее, чем в плейстоцене, так как они чувствительны к среде», и эта изменчивость может быть скорее результатом влияния «длительных и стабильных условий внешней среды, чем результатом ледниковых событий». Будущие исследования покажут, альтернативны ли эти две гипотезы, или комбинативны» — заключает Гросс (Gross, 1979, с. 411).
Североамериканские авторы показали, что изменчивость по структуре тазового пояса и числа спинных колючек Culaea inconstans детерминируется давлением хищных рыб и хищных насекомых (Nelson, 1969, 1971b; Reist, 1980а). Блоу и Хаген (Blow, Hagen, 1981; Hagen, Blow, 1983) обнаружили широкую географическую изменчивость по числу спинных колючек у Apeltes quadracus (от 1 до 7, хотя везде количественно преобладают особи с 4 и 5 колючками).
Авторы полагают, что отбор со стороны хищников благоприятствует фенотипам с наибольшим числом колючек, а отбор со стороны конкурентов — с наименьшим числом. От соотношения этих двух факторов в каждом конкретном водоеме и зависит фенотипическая структура Apeltes quadracus. Учитывая достаточно высокий коэффициент наследуемости числа колючек Apeltes — 0.61 (Hagen, Blow, 1983), а также стабильность частот по колючковым фенотипам в каждом местообитании (каждой географической точке) в разное время дня, месяца одного года, в разные годы и даже за период в 50 лет, можно согласиться с авторами, что отбор (а не модификационная изменчивость) ответствен за фенотипическую структуру, обнаруженную авторами у Apeltes.
Работа Гросса (Gross, 1978b), изучавшего географическую изменчивость Spinachia spinachia, показывает очень низкую изменчивость и мономорфизм Spinachia по всем изученным морфологическим признакам (число спинных колючек, боковых пластин, жаберных тычинок, лучей в плавниках и т. п.). Видимо, стабильность условий в море и определяет такое фенотипическое однообразие Spinachia spinachia.
Исследования факторов, детерминирующих фенотипическое разнообразие Gasterosteus aculeatus, показали, что отбор по данному признаку может влиять на эволюцию других признаков, что один и тот же фенотип может иметь различную приспособленность в разных условиях или на разных стадиях жизненного цикла (например, окраска, брюшные колючки).
4.5.5. ПАРАЛЛЕЛЬНАЯ ИЗМЕНЧИВОСТЬ
Симпсон (Simpson, 1961) определяет параллелизм как «независимое развитие сходных признаков в двух или более линиях, происходящих от общих предков, основанное на характеристиках этих предков или канализированное (направляемое) этими характеристиками». Яблоков и Юсуфов (1981) определяют параллелизм как «процесс филетического развития в сходном направлении двух или нескольких первоначально дивергировавших и генетически близких групп». Многие определения термина «параллелизм» разными авторами отличаются в деталях, но имеют одно общее положение: сходное развитие признаков у родственных форм.
В сем. Gasterosteidae широко распространена параллельная изменчивость по ряду признаков (элементы грудного и тазового скелета, спинные и брюшные колючки, брачная окраска, нерестовое и гнездостроительное поведение, образ жизни и др.) (Nelson, 1971а; Wootton, 1976; Bell, 1984). Наиболее примечательна эта изменчивость по полиморфным признакам «число костных латеральных пластин на теле» и «на киле». Полнее всего этот полиморфизм реализуется в двух самых сложных по своей популяционной структуре и широко распространенных в семействе родах Pungitius и Gasterosteus (Зюганов, 19836). Три других рода мономорфны.
У ряда форм в родах Gasterosteus и Pungitius выполнен генетический анализ числа боковых пластин, проведены также и межродовые скрещивания. Все это дает основание для обсуждения причин параллельной изменчивости этих признаков в семействе.
В литературе неоднократно описывались случаи параллельной изменчивости растений и животных. В частности, у рыб известен целый ряд ярких примеров параллелизма морфологических признаков (Кирпичников, 1967; Берг, 1977; Никольский, 1980; Савваитова, 1982). Однако в большинстве описанных случаев генетический анализ не был произведен. Вавилов (1935) обобщил большой материал по параллельной изменчивости у растений и сделал вывод о том, что «мутации в близких видах и родах идут, как правило, в одном и том же направлении» (с. 38). Из этого следует, что гомология признаков родственных видов в основном обусловлена генотипической гомологией. Иными словами, одинаковые изменения фенотипического порядка у близких таксонов определяются гомологичными генами, т. е. генами, возникшими из одного и того же исходного прародительского гена (Смирнов, Ватти, 1974). Поэтому полиморфные варианты у близких таксонов должны наследоваться сходно. Этот вывод является генетической основой, механизмом закона гомологических рядов в наследственной изменчивости. Вавилов, однако, осторожно подчеркивал, что параллельные изменения у близких видов и родов (в пределах семейства) не во всех случаях определяются гомологичными генами: «под одинаковой внешностью и в одинаковых условиях могут скрываться иногда разные генотипы» (с. 38). Тем не менее автор закона подчеркивал «приложимость закона гомологических рядов, в основном, и к генотипам».
В последнее время стало накапливаться все больше данных, указывающих, что гомологическая фенотипическая изменчивость не всегда определяется гомологической генетической изменчивостью, т. е. гомология может быть ложной (Медников, 1980). Ложная гомология или аналогия — явление в параллельной изменчивости, когда одинаковые изменения фенотипического порядка обусловлены разными, негомологичными генами. По существу можно ставить знак равенства между ложной гомологией, аналогией и конвергентным сходством.
Майр (1971) полагает, что конвергентное сходство в отличие от сходства, обусловленного общностью происхождения, независимо возникает у более или менее родственных таксонов в результате ответа на одинаковое давление отбора.
Медников (1980) предлагает иной механизм возникновения ложной гомологии: «Направленной оказывается не сама генетическая изменчивость, а пути и способы проявления ее в признаках организма, в фенотипе. Разнообразные изменения гена могут в конечном счете привести к сходным изменениям признаков организма... В тех случаях, когда для развития признака требуется совместное и последовательное действие многих генов, возникновение гомологических рядов неизбежно» (с. 14, 25). В отличие от Майра, объясняющего конвергентное сходство ответом на одинаковое давление отбора, Медников первостепенную роль в возникновении ложной гомологии отводит внутренним, молекулярно-генетическим процессам. Нетрудно видеть, что взгляды Медникова перекликаются с концепцией «канализированности развития» Уоддингтона (Waddington, 1957).
В связи с тем что гомологическая фенотипическая изменчивость близкородственных таксонов может потенциально определяться по крайней мере 3 разными причинами, рассмотренными выше: 1) сходными мутациями; 2) сходным давлением отбора; 3) канализированностью развития, мы будет употреблять определение «параллельная» вместо «гомологическая» изменчивость.
Параллелизм мы рассматриваем как сходное развитие признаков у родственных форм, первоначально дивергировавших и генетически близких.
На основе сравнения результатов скрещиваний гомологичных полиморфных вариантов (морф) в родах Gasterosteus и Pungitius попытаемся определить — генотипическая здесь гомология или ложная, т. е. контролируется ли параллелизм в этих родах гомологичными генами? Попытаемся также обсудить роль факторов внешней среды (давление отбора) и генетических факторов в возникновении параллелизма в семействе.
Как уже отмечалось в разделе 1.6, все разнообразие морфологических вариантов по числу костных пластин в родах Gasterosteus и Pungitius по существу можно свести к 8 основным типам (рис. 4). Имеется всего 4 градации признака «пластины на теле»: 1) пластины полностью покрывают тело (20—30, чаще 25—27), 2) пластины частично покрывают тело (10—20, чаще 12—15), 3) пластин на теле мало (2—10, чаще 5—7), 4) пластин на теле нет (0). Это не условно выделяемые градации, а реально существующие варианты в природных популяциях; если строить кривую распределения этого признака, суммируя множество популяций, то мы получим 4-модальную кривую с 4 пиками и 3 провалами между ними.
Имеются также 2 градации признака «киль на хвостовом стебле»: а) киль есть, б) киля нет (более тонкое разделение — киль сильно выражен и киль слабо выражен — мы не учитываем). Итак, все возможные сочетания 4 градаций пластин на теле и 2 градаций киля дают нам 8 возможных фенотипов (=морф, ==морфотипов) у Pungitius и Gasterosteus. По нашему мнению, пластины на теле и киль — два разных признака, детерминируемых разными локусами, но в ряде популяций эти локусы сцеплены (Зюганов, 1983г).
Морфологические варианты в родах Spinachia, Apeltes, Culaea. Фенотип Spinachia spinachia по числу костных пластин на теле (в среднем 21) и килю — trachurus (la, рис. 4). Судя по всему, Spinachia spinachia мономорфна по этому фенотипу и не обнаруживает заметной изменчивости (Leiner, 1934; Nelson, 1971а; Gross, 1978b). Этот вид занимает ограниченный ареал (Балтийское и Северное моря) и нерестится в солоноватой воде не менее 5—6 ‰. Обращает на себя внимание корреляция между фенотипом trachurus и морским образом жизни как у Gasterosteus aculeatus, так и у Spinachia spinachia.
Фенотип Apeltes quadracus — hologymna (4б), у нее полностью отсутствуют пластины на теле и киль. Этот вид мономорфен (Hagen, Blow, 1983). Интересно, что обитает Apeltes quadracus преимущественно в морской и солоноватой воде и в этом смысле не подчиняется закономерности, характерной для Gasterosteus aculeatus и Spinachia spinachia, отмеченной выше.
Фенотип Culaea inconstans не соответствует ни одному из 8 основных фенотипов, характерных для сем. Gasterosteidae в целом. Тело Culaea inconstans, на первый взгляд, голое и не покрыто типичными костными пластинами, характерными для других колюшек. Но при тщательном исследовании обнаруживается ряд из 30—36 очень мелких, не налегающих друг на друга костных бляшек, расположенных вдоль боковой линии, киля нет. В передней части тела имеется второй ряд пластин (обычно из 5 пластин), расположенный над основным рядом (Nelson, 1969, 1971а). Ареал Culaea inconstans — пресные воды в Сев. Америке в районе Великих Озер и Центральной Канады. Фенотип Culaea inconstans обнаруживает неожиданный параллелизм с фенотипом Pungitius platygaster aralensis из изолированной и бессточной р. Чу (Киргизия, СССР). Эта популяция описана Турдаковым и Пискаревым (1955), которые склонны выводить ее в самостоятельный подвид. У колюшек из р. Чу есть также 2 ряда мелких пластин, расположенных один над другим в передней части тела.
Рассмотрение фенотипов по признаку «костные пластины» в трех вышеуказанных родах показывает, что Spinachia и Apeltes в гомологическом ряду сем. Gasterosteidae занимают крайние положения, а Culaea inconstans и вовсе не вписывается в этот ряд (рис. 31).
Факт поразительного параллелизма в изменчивости признаков «костные пластины на теле» и «киль» филогенетически родственных форм сем. Gasterosteidae находит, на первый взгляд, наиболее рациональное объяснение в том, что основой этого параллелизма являются сходные изменения гомологичных генов. Проблема установления гомологичности отдельных генов разных видов решается в основном путем генетического анализа (Смирнов, Ватти, 1974). По существу, чтобы говорить о генетической гомологии, мы должны убедиться, что полиморфные варианты по какому-то признаку сходно наследуются в сравниваемых таксонах. Это один из главных критериев генотипической гомологии. Другой важный показатель гомологичности генов — сходство в характере проявления их в онтогенезе. Третий — сходная плейотропность (Смирнов, Ватти, 1974). Эти критерии дают лишь основания высказывать обоснованные предположения о возможной гомологичности генов у разных видов и родов. Надежность их повышается в случае комплексного использования нескольких критериев. Сравнение наследования морфологического полиморфизма у Gasterosteus и Pungitius (см. раздел 4.5.1.) выявляет разный характер доминантно-рецессивных отношений между морфами trachurus (многопластинковые) и leiurus (малопластинковые), а также разный характер генетической детерминации боковых пластин, в частности неодинаковое количество генов, контролирующих его формирование. Если расщепления в скрещиваниях между trachurus и leiurus у Gasterosteus aculeatus описываются двулокусными моделями, то расщепления в F1 аналогичных скрещиваний Pungitius pungitius х Pungitius platygaster двулокусной моделью не описываются и в модель нужно вводить еще 1 или 2 гена. Видимо, Gasterosteus и Pungitius имеют разный набор генов-модификаторов, участвующих в формировании фенотипа trachurus, а также leiurus. Кроме того, скрещивания, проведенные Кобаяши (Kobayashi, 1957): Pungitius sinensis (trachurus) х Pungitius pungitius (leiurus) (см. рис. 24), указывают на полигенный характер детерминации этих фенотипов в японских популяциях Pungitius.
Заметим, что Вавилов (1935), отмечая доказанные случаи ложной гомологии (аналогии) в фенотипическом параллелизме, ссылался на примеры, где были выявлены неодинаковое количество генов в детерминации признака и разный характер доминантно-рецессивных отношений: «... мы знаем, что красная окраска зерна у пшеницы может быть обусловлена одним, двумя и тремя генами, желтые семядоли у гороха бывают как доминантного, так и рецессивного типа...» (с. 36).
Итак, проверка гомологичности генов в рассматриваемом случае межродового параллелизма по критерию сходства в наследовании приводит нас к выводу о ложной гомологии боковых пластин. Теперь проверим гомологичность по другому критерию: сходство в характере онтогенеза признака. У Gasterosteus aculeatus и Pungitius sinensis фенотип trachurus составляет непрерывный ряд пластин на теле и киле в количестве в среднем 34 (суммарно). У обоих видов закладка пластин начинается при длине рыбы 15—20 мм и заканчивается при 35—40 мм (Igarashi, 1962, 1964, 1965). Однако если у Pungitius sinensis закладка пластин начинается с хвостового киля и продолжается по направлению к голове, то у Gasterosteus aculeatus формирование подобного полного ряда пластин идет иначе. Начинается одновременная закладка 4 пластин в передней части тела. От этих образований закладка продолжается и к передней, и к задней части тела. В итоге тело полностью покрывается пластинами. На хвостовом стебле независимо появляется другой центр закладки (при длине рыбы 20 мм). Затем ряд пластин нарастает по направлению к переднему отделу тела, и при длине рыб 40 мм пластины на теле и киль соединяются. Существование 2 центров формирования пластин, по мнению Игараши (Igarashi, 1964), «совершенно уникальный пример в сравнении со многими другими костистыми рыбами». Таким образом, к одному и тому же фенотипу у Gasterosteus и Pungitius ведут разные пути онтогенеза. Поэтому проверка по этому критерию приводит к выводу о ложной гомологии, к выводу о конвергентном сходстве.
Рассмотрим теперь концепцию Майра (1971) в применении к данному случаю, в соответствии с которой конвергентное сходство независимо возникает у более или менее родственных таксонов в результате ответа на одинаковое давление отбора. Для этого сравним особенности полиморфизма в популяциях Gasterosteus aculeatus и Pungitius, которые обитают в одних и тех же водоемах и, следовательно, подвергаются сходным давлениям отбора, по крайней мере со стороны абиотических факторов внешней среды (температура, минерализация воды и т. п.), а также со стороны некоторых биотических факторов (хищники, паразиты). Обнаруживается следующая картина. В пресных водоемах Центральной и Северо-Западной Европы обитают мономорфные популяции Pungitius pungitius (Münzing, 1969; Gross, 1979) (фенотип leiurus + keel), но в тех же водоемах обитают полиморфные популяции Gasterosteus aculeatus: trachurus + semiarmatus + leiurus (Münzing, 1959). Например, в исследованных нами озерах Марцы и Клюквенное бассейна Белого моря, в Финском заливе Балтийского моря обитали мономорфные популяции Pungitius pungitius и полиморфные Gasterosteus aculeatus. На Дальнем Востоке — обратная картина: например, на Сахалине и Курильских островах (озера Рейдово, Тунайча, Чибисан и др.) обитают полиморфные популяции Pungitius (trachurus, semiarmatus, leiurus + keel, hologymna + keel). В тех же водоемах нами были обнаружены мономорфные популяции trachurus вида Gasterosteus aculeatus. Число таких примеров можно увеличить. Если бы одинаковый полиморфизм в 2 родах возникал под воздействием сходного, давления отбора, то мы обнаруживали бы сходство в полиморфизме популяций Gasterosteus и Pungitius в одних и тех же водоемах. Тем не менее это не так. Если говорить о морских и солоноватых водах, то у Gasterosteus aculeatus в морских условиях обитают мономорфные популяции trachurus; Gasterosteus wheatlandi, который также обитает в соленых водах, имеет часто фенотип leiurus. Spinachia spinachia (фенотип trachurus) и Apeltes quadracus (фенотип hologymna) также обитают в соленых водах. Pungitius pungitius — вид наиболее толерантный по отношению к соленой воде в роде Pungitius, имеет фенотип leiurus. В целом в сем. Gasterosteidae мы не находим общей корреляции между толерантностью к соленой воде и развитием фенотипа trachurus, слишком много имеется исключений.
На наш взгляд, адаптивное значение полиморфизма по числу костных пластин наиболее понятно для таксона Gasterosteus aculeatus. Если верна гипотеза о первично морском происхождении колюшек (самые древние остатки были обнаружены в позднемиоценовых морских отложениях и имели фенотип trachurus (Bell, 1976а), наиболее примитивный род Spinachia обитает в морской воде и имеет фенотип trachurus, ближайшие родственники колюшек, рыбы из сем. Aulorhynchidae, имеют фенотип trachurus и обитают только в море), то фенотип trachurus следует рассматривать как исходный. Видимо, сплошной костный панцирь нужен колюшкам, обитающим в морских и солоноватых водах, как защита от хищников и для лучшего плавания и маневрирования (Wootton, 1976). Неорганическая часть наружного костного скелета в значительной степени состоит из кальция, и у морских колюшек нет проблем для постройки полного ряда боковых пластин в сильноминерализованной и богатой кальцием морской воде (400 мг/л Са++ при солености 35 ‰, — Попов и др., 1979). По-другому обстоит дело в слабоминерализованных пресных олиготрофных водоемах (1—30 мг/л Са++) (Giles, 1983). Там значительное селективное преимущество получит фенотип leiurus с редуцированным рядом костных щитков, поскольку в слабоминерализованной воде, бедной кальцием, резко возрастают энергетические траты на постройку массивного костного панциря. Большинство авторов, пытавшихся объяснить адаптивный смысл полиморфизма по числу пластин у Gasterosteus aculeatus, считало, что гены, детерминирующие этот признак, плейотропно детерминируют какие-то иные, важные в адаптивном отношении черты (осморегуляционные и температурные адаптации, черты поведения, помогающие эффективно избегать хищников, и другие) (Wootton, 1976). Жиль (Giles, 1983), один из немногих, связывает полную редукцию боковых пластин у трехиглой колюшки Гибридских островов с низким уровнем кальция в озерах.
Мы полагаем, что морским популяциям колюшек «выгодно» иметь гетерозиготность по гену «А», контролирующему закладку боковых пластин, так как при освоении пресных вод и при образовании жилых пресноводных изолированных популяций отбор будет благоприятствовать морфе leiurus (генотип «аа»). Колюшкам этой морфы легче набрать из пищи и окружающей воды, бедной кальцием, необходимое количество ионов кальция для постройки редуцированного ряда боковых пластин, чем колюшкам морфы trachurus. Возможно, гетерозиготность морской популяции поддерживается за счет обратных инвазий из короткоживущих пресноводных группировок в процессе попыток освоения пресной среды.
Несмотря на то что мы не знаем в данном случае основных звеньев цепи передачи наследственной информации от гипотетического гена «А» к признаку, можно все же с уверенностью полагать, что этот морфогенетический путь является многоступенчатым, поскольку рассматриваемый признак является не простым белком, а сложным структурным образованием. Несомненно, что кроме гена, ответственного за вопрос «что?», есть гены, ответственные за вопросы «когда», «где» и «сколько» (Медников, 1980). По аналогии с другими признаками, для которых расшифрован морфогенетический путь от гена к признаку (например, окраска млекопитающих), предполагаем, что мутация любого из генов, включенных в эту цепь и отрицательно влияющая на активность ферментов, блокирует дальнейший онтогенез признака и приведет к той или иной степени редукции признака. Совмещение таких мутаций в гомозиготе приведет, видимо, к появлению фенотипов leiurus и hologymna (в зависимости от того, на каком отрезке блокирована цепь). В этой связи понятно, почему у Gasterosteus aculeatus фенотип trachurus всегда доминантен или полудоминантен по отношению к leiurus. В гетерозиготе все равно будет работать одна доза гена «А». Поэтому скрещивания trachurus + leiurus, проведенные в разных популяциях трехиглой колюшки, дали однозначный результат — доминирование trachurus.
Для рода Pungitius адаптивное значение полиморфизма по боковым пластинам менее понятно с точки зрения схемы, нарисованной для Gasterosteus. Pungitius platygaster и Pungitius sinensis имееют фенотип trachurus и обитают в основном в пресных водах. В морских же водах часто обитает Pungitius pungitius, имеющая фенотип leiurus. Непонятно также, почему у Pungitius в ряде случаев доминантным оказывается фенотип leiurus при скрещивании типа trachurus х leiurus (Kobayashi, 1957; Зюганов, 19846). Предположение, что фенотипы trachurus, используемые в этих скрещиваниях, были гетерозиготными, — меловероятно, так как колюшки этого фенотипа брались из мономорфных нерасщепляющихся популяций. Учитывая другой тип онтогенеза признака «боковые пластины» у Pungitius (Igarashi, 1962, 1964, 1968, 1969), можно полагать, что этот признак детерминируется иным морфогенетическим путем и в «игре» принимают участие другие гены. Возможно, здесь мы имеем дело с параллелизмом анатомическим, «... вытекающим из одинаковых возможностей развития, заложенных в органах, и наблюдающихся в систематических группах не ниже родовых» (Филипченко, 1925, с. 253). Поскольку роды Gasterosteus и Pungitius дивергировали уже в плиоцене, по крайней мере 7 млн. лет назад (Штылько, 1934; Rawlinson, Bell, 1982), неудивительно, что этот признак у них мог возникнуть на разной генетической основе.
Итак, вероятнее всего, в основе параллелизма полиморфного признака «костные пластины» в сем. Gasterosteidae лежат не генотипическая гомология (Вавилов) и не сходный ответ на одинаковое давление отбора (Майр), а механизм канализации развития (Филипченко — Уоддингтон — Медников). Видимо, сходные фенотипы в разных родах детерминируются разными морфогенетическими путями. Согласно Уоддингтону (Waddington, 1957), независимо от того, какие гены окажутся объединенными в генофонде, наличие ряда определенных путей развития гарантирует получение стандартного конечного результата. Причем эта стабильность может сохраняться не только при наличии изменчивости в генофонде, но и при изменениях внешней среды. Нужно сказать, что если 2 первые гипотезы (генотипическая гомология и ответ на одинаковое давление отбора) довольно легко фальсифицируемы генанализом и сопоставлением полиморфизма сравниваемых популяций с внешними условиями среды, то наиболее вероятная последняя гипотеза, к сожалению, с трудом поддается проверке. Для этого необходимо применение сложных молекулярно-генетическцх методов. Признак «киль», видимо, генотипически гомологичен в родах Gasterosteus и Pungitius, поскольку он одинаково наследуется и имеет сходный онтогенез (Igarashi, 1962, 1964; Зюганов, 19846). Хотя Белл (Bell, 1984) не рассматривал межродовой параллелизм по числу щитков (между Gasterosteus и Pungitius), но внутри рода Gasterosteus, по мнению Белла (Bell, 1981), возникновение морфы leiurus происходило в разных местах назависимо и параллельно. Белл (Bell, 1981) предлагает свой механизм возникновения малопластинковой и беспластинковой формы — а именно педоморфоз. Известно, что педоморфозом, или неотенией, называют явление, когда способность к размножению организма достигается на одной из стадий, бывших прежде ювенильными (Грант, 1980). Основываясь на экспериментальных данных Игараши (Igarashi, 1964), обнаружившего, что во время онтогенеза trachurus проходят стадии leiurus и semiarmatus, а также на обнаруженной самим Беллом сходной корреляции между числом грудных и килевых пластин у неполовозрелых trachurus и взрослых semiarmatus, Белл (Bell, 1981) предположил возникновение leiurus и semiarmatus от trachurus путем педоморфоза. Он считает, что различия по числу пластин между взрослыми trachurus и взрослыми leiurus существуют благодаря разной скорости нарастания (увеличения числа пластин) по отношению к размеру тела. Таким образом, гены, детерминирующие морфы, контролируют, собственно, скорость нарастания пластин. Заметим, что против этой гипотезы говорит факт одинакового созревания trachurus и leiurus в сходном возрасте (1 год) при одинаковых размерах (40—45 мм). Нужны дополнительные экспериментальные подтверждения этой гипотезы.
У Gasterosteus wheatlandi имеется сходный с Gasterosteus aculeatus полиморфизм по числу пластин, однако между морфами trachurus и semiarmatus в отличие от Gasterosteus aculeatus имеется плавный переход без chiatus, так что между этими двумя морфами невозможно провести четкую границу (Sargent et al., 1984). Авторы обследовали большое число популяций вдоль Атлантического побережья Сев. Америки и нашли, что leiurus доминирует на севере ареала (к северу от мыса Код почти 100 % популяций представлены leiurus), a trachurus — semiarmatus — на юге. Эта картина контрастирует с общей тенденцией распределения морф у Gasterosteus aculeatus: leiurus на юге, a trachurus на севере. Хотя генетика морф у Gasterosteus wheatlandi не изучена, судя по приведенным фактам параллелизм в полиморфизмах у обоих видов вызван не одинаковыми генами и не сходным давлением отбора, а сходные фенотипы детерминированы разными морфогенетическими путями.
Белл (Bell, 1984) отмечал, что меланизм по брачной окраске Gasterosteus aculeatus на островах Королевы Шарлотты, в штате Вашингтон, материковой Британской Колумбии и Южной Калифорнии возник параллельно.
Наряду с межродовым параллелизмом по числу боковых пластин наиболее интересен у колюшковых случай межродового параллелизма, редукции и утраты тазового пояса у Gasterosteus, Pungitius и Culaea. В разделе 4.2 было показано, что эти три рода наиболее тесно группируются внутри семейства по самым разным признакам и, вероятно, представляют монофилетическую группу. Они также имеют наибольшее сходство по строению pelvis. Все это предполагает, на первый взгляд, общие механизмы параллельной утраты пояса в трех родах. Нельсон (Nelson, 1971b) отмечал, что среди лучеперых рыб всего 33 семейства обнаруживают утрату пояса или у отдельных видов и родов, или у целых семейств, и среди них только у колюшковых полиморфизм по отсутствию-присутствию pelvis встречается в пределах одной локальной популяции, что является уникальным среди рыб.
Белл (Bell, 1984) полагает, что межродовой параллелизм редукции pelvis контролируется сходным отбором (преимущественно со стороны хищников) у Gasterosteidae. На мой взгляд, Белл в этом заблуждается. Существование симпатрических популяций бестазовых Pungitius и имеющих нормальный тазовый пояс Gasterosteus aculeatus в водоемах Ирландии (Nelson, 1971b) и озерах Беломорского побережья (наши данные) говорит о том, что редукция pelvis не вызывается общими для двух родов причинами. Нельсон (Nelson, 1971b) не приводит данных о хищниках для Ирландских популяций, но в беломорских водоемах и в озерах, лишенных хищных рыб, и в море, где много разнообразных хищников для обоих видов колюшек симпатрично обитают «дикий тип» Gasterosteus aculeatus и бестазовые Pungitius pungitius.
Для Gasterosteus aculeatus и Culaea inconstans хищники также не могут являться общим фактором, обусловливающим редукцию тазового пояса. Во-первых, оба вида аллопатричны (редукция таза у Gasterosteus aculeatus известна на островах Британской Колумбии и Великобритании), а редукция таза у Culaea встречается у рыб из канадской провинции «Северо-западные территории». Во-вторых, они занимают в водоемах разные ниши, имеют разный набор хищных видов, применяющих разную тактику охоты за жертвами, а жертвы — разную тактику защиты. К тому же у Gasterosteus наблюдается тесная корреляция между редукцией таза и редукцией других защитных структур (спинные колючки, боковые пластинки) (Campbell, 1979; Reimchen, 1980; Giles, 1983), а у Pungitius и Culaea такой корреляции нет, за исключением двух популяций Pungitius из Ирландии и Греции (Stephanidis, 1971; Nelson, 1971b; Nelson, Atton, 1971), поскольку колючки у Culaea и Pungitius все равно не являются эффективным защитным механизмом против хищников и их способ защиты — бегство от хищника с дальней дистанции и прятание в укрытиях (Nelson, 1969).
У колюшковых имеется интересный случай межродового параллелизма по некоторым признакам репродуктивного поведения. Так, известно, что Gasterosteus aculeatus строит гнезда на грунте, не сооружает «колыбельку» и во время ухаживания ведет самку к гнезду по прямой линии (Van Iersel, 1953). Pungitius pungitius строит гнезда над грунтом на растениях, сооружает «колыбельку» и во время фазы ухаживания ведет самку к гнезду по «зигзагообразной линии» (Morris, 1958). Вместе с тем описана популяция Pungitius pungitius из оз. Гурон (Великие озера, США), где нет укореняющихся растений в литоральной зоне и отсутствует Gasterosteus aculeatus — в этом водоеме самцы строят гнезда на грунте в расщелинах между камнями (McKenzie, Keenleyside, 1970). Они не сооружают, «колыбельки» и при ухаживании ведут самку к гнезду по прямой линии — все, как у Gasterosteus aculeatus. Очевидно, изменения в гнездостроительном поведении колюшек из оз. Гурон необратимы и генетически закреплены, так как в эксперименте при наличии выбора, когда самцам предлагались и укореняющиеся растения на песке, и каменный субстрат, они строили гнезда на грунте (McKenzie, Keenleyside, 1970). Этот случай межродового параллелизма явно вызван сходным давлением отбора: адаптацией Pungitius к условиям в водоеме, где постройка гнезд на растениях не происходит из-за их отсутствия, и популяция «Гурон» была вынуждена перейти на тип гнездостроения, к которому уже давно перешли Gasterosteus. Но с переходом на этот тип у Pungitius соответственно изменились другие поведенческие признаки: прекращение сооружения «колыбельки» (ее просто негде сооружать из-за отсутствия стеблевых растений), прямое ведение к гнезду самки (так как нет густых зарослей, где нужно маневрировать) и т. д. Однако, судя по всему, любая популяция Pungitius pungitius при интродукции ее в водоем, лишенный укореняющейся растительности в литоральной зоне, может перейти на грунтогнездостроение в первом же поколении, судя по нашим экспериментам (Зюганов, 1986). Дело в том, что интродукция основателей из типичных популяций Pungitius pungitius, где самцы строят гнезда на растениях (р. Сходня Московской обл., оз. Машинное Карельской АССР), в водоемы, лишенные растений (карьер «Уютный») (см. раздел 2.8.1), приводила к переходу самцов к постройке гнезд на грунте среди расщелин камней. Это предполагает пластичность гнездостроительного поведения в любой популяции Pungitius pungitius и широкую норму реакции по признаку «выбор субстрата для гнезда». Если нет привычного субстрата — растений, то в необычных условиях популяция перестраивается на «эксплуатацию» другого нерестового субстрата.
Итак, параллелизм в репродуктивном поведении самцов Pungitius pungitius оз. Гурон и карьера «Уютный» носит лишь внешний характер, так как способность к грунтогнездостроению у гуронских колюшек необратима и наследственно закреплена. Колюшки же из карьера «Уютный» не утратили способности к постройке гнезд на растениях и при пересадке в водоем, богатый данной растительностью, снова перешли к гнездованию над грунтом. Исходя из наших данных, для объяснения происхождения популяции «Гурон» можно привлечь эффект Болдуина (ситуация, когда в результате удачной модификации фенотипа организм остаётся в благоприятных условиях среды до тех пор, пока отбор не приведет к генетическому закреплению этого фенотипа, — (Майр, 1974).
Эволюция популяции оз. Гурон не обязательно связана с постепенным исчезновением растительности в этом озере и длительным приспособлением популяции к размножению при отсутствии растений. Напротив, уже при колонизации этого озера основатели Pungitius pungitius, возможно, обладали широкой наследственной программой строить гнезда и на растениях, и на грунте. Эти две программы, очевидно, были созданы в изменчивых условиях среды еще при образовании таксона Pungitius pungitius и альтернативно могли включаться или выключаться по сигналу из внешней среды. При длительном существовании в стабильных условиях оз.Гурон в популяции программа «постройка гнезд на растениях» перешла в «спящее» состояние и постепенно ликвидировалась как не имеющая селективной ценности. Оставшаяся генная программа, ответственная в прошлом лишь за часть диапазона широкой модификационной изменчивости, стала функционировать постоянно. В итоге признак «грунтогнездостроение» у гуронских колюшек не имеет модификационных альтернатив и фенокопия превратилась в генокопию. Это объяснение базируется на гипотезе Хлебовича (1982), оригинально трактующей «эффект Болдуина».
В целом же можно заключить, что и межродовой, и межпопуляционный параллелизм по этому признаку детерминирован сходными условиями среды.
В семействе колюшковых имеется тоже параллелизм по окраске тела, форме и длине брюшных и спинных колючек, форме хвостового плавника, типам жизненного цикла и другим признакам. Однако эти случаи не проанализированы генетически и экспериментально, так что здесь затруднительно говорить о механизмах этого параллелизма. Но уже вышеописанные случаи (проанализированные генетически и экспериментально) свидетельствуют о том, что разные механизмы детерминируют параллелизм в сем. Gasterosteidae — сходная генетика (генотипическая гомология) сходный отбор, канализация развития.
Представляется, что будущие успехи в разработке теории признака прольют свет на природу параллелизма в сем. Gasterosteidae.
4.5.6. ИЗОЛИРУЮЩИЕ МЕХАНИЗМЫ И ПРОБЛЕМА ВИДА
Изолирующими механизмами (репродуктивной изоляцией) называют различного рода механизмы, препятствующие скрещиванию данного вида с другими видами. Майр (1974, с. 68) дает определение изолирующих механизмов как «биологических свойств особей, которые предотвращают скрещивание действительно или потенциально симпатрических популяций». Это определение исключает географическую или любую другую чисто внешнюю изоляцию.
Участок суши не является изолирующим механизмом, разделяющим две популяции рыб разных рек, которые в ином случае (при потенциальной симпатрии) способны скрещиваться. Майр (1974) справедливо подчеркивает, что невозможно плодотворно обсуждать природу и возникновение изолирующих механизмов, если в категорию этих механизмов включать столь чуждый элемент, как географическая изоляция. Изолирующие механизмы всегда имеют отчасти генетическую основу, подчеркивает Майр (1974). Им выделены 2 типа механизмов: 1) предотвращающие межвидовые скрещивания (прекопуляционные), 2) уменьшающие успешность межвидовых скрещиваний (посткопуляционные).
В первый тип входит сезонная, биотопическая, этологическая и механическая (предпринимаются попытки к копуляции, но осеменения не происходит) изоляция. Во второй тип входят гибель гамет и зигот, нежизнеспособность и стерильность гибридов (Майр, 1974,с. 69).
У колюшковых рыб с их сложным репродуктивным поведением развит именно первый тип репродуктивной изоляции, в основном этологическая репродуктивная изоляция. Тем не менее выявлен и второй тип изоляции — при межродовых скрещиваниях Gasterosteus acuteatus х Pungitius pungitius обнаружена гибель зигот-гибридов, а также нежизнеспособность и стерильность гибридов (Leiner, 1940; Kobayashi, 1962). Механизмы этологической репродуктивной изоляции между видами разных родов (Gasterosteus aculeatus — Pungitius pungitius, Culae inconstans — Pungitius pungitius), а также между «хорошими» видами одного рода (Gasterosteus aculeatus — Gasterosteus wheatlandi) обсуждены в разделе 2.8.2. В этом разделе будут обсуждены механизмы репродуктивной изоляции и проблемы вида в таксонах колюшковых Gasterosteus aculeatus-complex и Pungitius sp.-complex, систематический статус и границы которых интенсивно дискутируются в литературе.
Итак, в сем. Gasterosteidae 3 рода Spinachia, Culaea и Apeltes содержат лишь по 1 виду и таксономические отношения между хорошими аллопатрическими видами Spinachia spinachia, Culaea inconstans и Apeltes quadracus не вызывают споров (Bertin, 1925; Wootton, 1976; Bell, 1984). Однако 2 других рода, Gasterosteus и Pungitius, политипичны и включают комплексы алло-, пара- и симпатричных форм, систематические отношения между которыми, неясны. Много лет назад Хаббс писал, что «систематическая интерпретация колюшек долгое время была — и до сих пор остается — одной из наиболее запутанных проблем в ихтиологии (Hubbs, 1929). Это утверждение справедливо и сегодня. При сравнении форм внутри каждого из этих родов обнаруживается разная степень филетической дивергенции, а также репродуктивной изоляции. Попытки выделить в составе родов Gasterosteus и Pungitius совокупности, соответствующие критериям биологических видов, встречают затруднения. Возникает вопрос, применима ли вообще концепция биологического вида к группам с такой структурой, и если нет, то на каких основах должна строиться их классификация?
Эволюционно-таксономические отношения форм в роде Gasterosteus. Как уже отмечалось в разделе 4.1, важной вехой в истории классификации рода Gasterosteus явилась работа Бертэна (Bertin, 1925), синонимизировавшего все 42 «вида», выделенных ранее систематиками-типологами. Бертэн ввел все их в один политипический и полиморфный вид Gasterosteus aculeatus-complex. Впоследствии из него был выделен самостоятельный вид Gasterosteus wheatlandi, симпатричный с Gasterosteus aculeatus, на Атлантическом побережье Сев. Америки. Морфологически он очень трудно отличим от Gasterosteus aculeatus, но все же его можно отличить от последнего наличием бугорка у основания брюшной колючки, брачной окраской самцов и самок (Mclnerney, 1969). Доказано, что этологические изолирующие мехинизмы между двумя видами хорошо развиты и эффективно предотвращают обмен генами (Reisman, 1968b).
Итак, в настоящее время род Gasterosteus состоит из 2 номинальных видов: Gasterosteus aculeatus и Gasterosteus wheatlandi.
Хотя описание таксономических видов в роде Gasterosteus в основном прекратилось после работы Бертэна (1925), но полевыми и экспериментальными исследованиями во второй половине столетия выявилось много ситуаций, когда между разными формами Gasterosteus aculeatus обнаруживалась строгая репродуктивная изоляция. К настоящему времени на Тихоокеанском побережье Сев. Америки и Азии обнаружено 5 географических точек, где имеются такие ситуации (рис. 34).
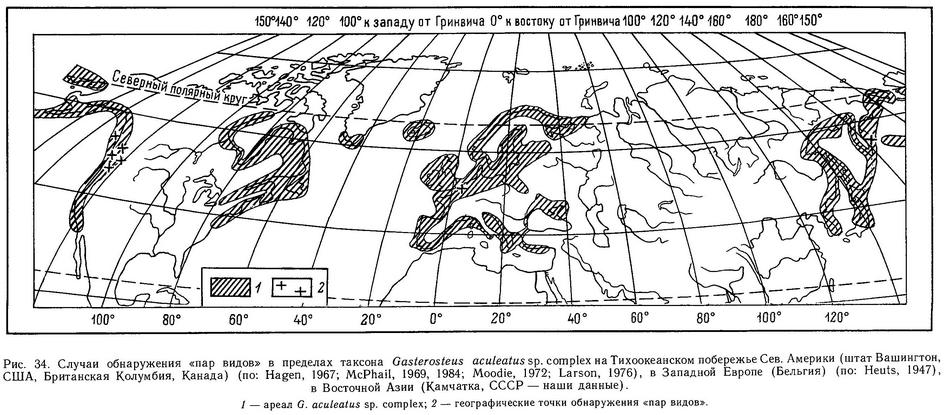
Так, Хаген (Hagen, 1967) изучил подобную ситуацию в ручье Литтл Кэмпбелл (на границе между штатом Вашингтон (США) и Британской Колумбии (Канада). В верхней части ручья (длина которого 20 км) обитает leiurus, а в нижней нерестится проходная trachurus и на участке 1,5 км имеется гибридная зона. Две формы различались между собой морфологически: помимо боковых пластинок они различались по длине тела, числу жаберных тычинок, лучей спинного и анального плавника, позвонков, длине и форме брюшных колючек, окраске, э/ф спектру белков и другим признакам. Хаген (Hagen, 1967) выявил механизмы репродуктивной изоляции между ними: это сезонная и биотопическая изоляция. Хотя ему не удалось выявить в эксперименте этологической изоляции между ними, поскольку он использовал тесты по «ориентации» самки на самца, позднее Хэй и Мак-Фейл (Hay, McPhail, 1975) на том же материале, применив другую методику экспериментов, обнаружили, что в тестах по предпочтению в аквариумах самки trachurus намного чаще предпочитали скрещиваться с самцами trachurus, а самки leiurus соответственно с самцами своей формы. Интересно, что искусственно полученные гибриды leiurus х trachurus были вполне жизнеспособными и плодовитыми (Hagen, 1967).
Остальные случаи обнаружения генетической изоляции на Тихоокеанском побережье Сев. Америки относятся к разным формам морфы leiurus. Мак-Фейл (McPhail, 1969) в бассейне р. Чехэлис (п-ов Олимпия, штат Вашингтон, США) обнаружил две формы (обе относятся к морфе leiurus), различающиеся брачной окраской самцов («красные» и «черные»), числом жаберных тычинок, положением спинных колючек на теле, устойчивостью к высокой солености воды. Обе формы парапатричны (ареалы их слегка перекрываются), и возникновение «черной» формы Мак-Фейл (McPhail, 1969) и Хаген и др. (Hagen et al., 1972) объясняют таким фактором отбора, как обитание в р. Чэхэлис Novumbra hubbsi (см. разделы 1.4 и 4.5.4). Скрещивания между «черной» и «красной» формами показали, что самки-гибриды имеют пониженную жизнеспособность и плодовитость. Самцы-гибриды вяло вентилировали икру в гнездах, что приводило к повышенной гибели икры. Кроме частичной посткопуляционной изоляции наблюдалась и прекопуляционная. Так, самки «красной» формы предпочитали при наличии выбора в эксперименте нереститься с «красными» самцами, а самки «черной» формы также предпочитали самцов своего фенотипа. Это имело место, когда в скрещиваниях участвовали производители, взятые из парапатричных (соседних) популяций. Когда же для скрещиваний с «черными» самками использовали «красных» самцов из удаленной от р. Чехэлис популяции, то «черные» самки предпочитали их даже больше, чем «своих» самцов. Этот феномен Белл (Bell, 1976b) относит к эффекту «репродуктивного смещения признака», призванному защитить чистоту генофонда «черной» формы именно от соседней, парапатричной «красной» формы, т. е. репродуктивная изоляция в данном случае выработалась «на месте», на границе обитания двух форм. Таким образом, возникает интересная эволюционная ситуация, когда «черная» форма ведет себя как «вид» по отношению к соседней, граничащей с ней «красной», но не является видом по отношению к удаленной, аллопатричной «красной» форме.
Муди (Moodie, 1972а, 1972b), Муди и Реймчен (Moodie, Reimchen, 1973, 1976а, 1976b) исследовали взаимоотношения между двумя формами leiurus, обитающими в оз. Майер (острова Королевы Шарлотты, Канада). «Черная» колюшка живет в самом озере, a leiurus в ручьях; впадающих в него. «Черная» больше по размерам тела, чем leiurus, имеет более длинные брюшные колючки, более прогонистое тело, больше жаберных тычинок, позвонков, лучей в спинном, анальном плавниках. Авторы рассматривают характеристики «черной» колюшки (крупные размеры тела, отсутствие брачной окраски, длинные колючки) как адаптацию к жизни в пелагиале и ответ на сильное давление хищничества со стороны Salmo clarki и Cottus asper. Обе формы аллопатричны по отношению к морской trachurus (расстояние между озером и морем 16 км), Муди (Moodie, 1972а) в эксперименте выявил, что самки «черной» формы этологически изолированы от самцов leiurus. Хотя Муди (Moodie, 1972а) убежден, что в бассейне оз. Майер обитают 2 биологически изолированных вида, он воздерживается от придания им формального таксономического статуса.
Ларсон (Larson, 1976) исследовал 2 симпатрические формы колюшки в оз. Пакстон (о. Тексада, Тихоокеанское побережье Британской Колумбии, Канада). Он обнаружил, что одна форма является пелагической, стайной, неагрессивной, предпочитающей держаться у поверхности воды. Другая форма — бентическая, нестайная, агрессивная, держащаяся у дна. Первая форма — планктофаг, а вторая — бентофаг. В аквариумах обе формы занимали местообитания (при наличии выбора) в соответствии с их природными экологическими предпочтениями. Между формами обнаруживались существенные морфологические различия: пелагическая форма (морфа leiurus) имела 9—14 боковых пластин, нормально развитый тазовый пояс, спинные и брюшные колючки, число жаберных тычинок варьировало у нее от 18 до 25, в то время как бентическая форма (морфа hologymna) не имела боковых пластин, у части особей отсутствовала одна спинная колючка, она лишена брюшных колючек и тазового пояса, а число жаберных тычинок у нее 11—21. По мнению Ларсона (Larson, 1976), обе формы являются разными видами, но он воздерживается от придания им формального таксономического статуса.
Мак-Фейл (McPhail, 1984) исследовал 2 симпатрические формы колюшки в оз. Энос (о. Ванкувер, Тихоокеанское побережье Британской Колумбии, Канада). Как и в оз. Пакстон, исследованном Ларсоном (Larson, 1976), в оз. Энос обнаружены «пелагическая» и «бентическая» формы колюшки. Однако здесь обе формы принадлежат морфе leiurus (5 пластин на теле) и морфологически отличаются формой тела (бентическая форма более высокотела), числом лучей в анальном плавнике (у бентической меньше лучей), числом жаберных тычинок (у бентической 16—21, у пелагической 22—28), брачной окраской самцов (у самцов пелагической формы окраска типичная красная, у бентической — черная). Между ними также обнаружены отличия по 8 пластическим признакам (длина жаберных тычинок, брюшных колючек, рыла, головы и т. д.). Обе формы различались по э/ф-спектру трех белков. Интересно, что искусственно выращенные гибриды F1 и F2 были плодовиты и не обнаруживали пониженной жизнеспособности. Обсуждая взаимоотношения пелагической формы оз. Энос и оз. Пакстон (поскольку озера расположены неподалеку), Мак-Фейл (McPhail, 1984) приходит к выводу, что пелагическая форма оз. Энос — «уникальный дериватный вид», а бентическая форма обоих озер в принципе «одно и то же». Правда, читатель, сравнивая данные обеих работ, найдет, что бентическая форма в оз. Пакстон лишена пластин, тазового пояса, брюшных колючек в отличие от таковой оз. Энос, а в оз. Энос бентическая форма — меланист, но Мак-Фейл (McPhail, 1984) почему-то не придает значения таким отличиям. Несмотря на то что гибриды F1 и F2 между двумя формами в оз. Энос плодовиты и жизнеспособны, автор считает их различными «биологическими видами», предполагая, что «должен быть сильный отбор против гибридов и высокая степень положительной ассортативности в скрещиваниях внутри каждой формы». Его предположения были подтверждены, и вскоре Риджвэй и Мак-Фейл (Ridgway, McPhail, 1984) экспериментально показали наличие репродуктивной этологической изоляции между двумя формами. Самцы пелагической формы строят гнезда на открытом грунте, а бентической — в зоне растительности, хотя часто обе формы занимают соседние участки. Нерест между самцом одной формы и самкой другой прерывался на фазе «ведение к гнезду». Авторы отмечают, что этологическая изоляция между формами настолько сильна, что гибридов в озере встречается менее 1 %. Недавно нами (совместно с К. А. Савваитовой, Г. А. Головатюк и В. Ф. Бугаевым) были обнаружены генетически изолированные симпатрические группировки в оз. Азабачьем (бассейн р. Камчатка, п-ов Камчатка, — Зюганов и др., 1987). В озере постоянно обитает жилая морфа leiurus, а весной и летом туда на нерест из моря заходит нереститься типичная trachurus. Примечательно, что несмотря на нерест в одних и тех же местах, гибридов (semiarmatus) вообще обнаружено не было. Кроме боковых пластин обе формы отличаются по окраске, числу жаберных тычинок и другими пластическими признаками (Зюганов и др., 1987; Зюганов, 1988; Зюганов, Бугаев, 1988).
Таким образом, имеется 6 документированных ситуаций, когда формы ведут себя как «хорошие виды», т. е. генетически изолированы и не обмениваются генами, причем две из них — это пары trachurus—leiurus, а три — различные формы внутри морфы leiurus (рис. 34).
В Европе (Бельгия) был зарегистрирован только один случай частичной репродуктивной изоляции между trachurus и leiurus. Хойтс (Heuts, 1946, 1947b) показал, что leiurus занимает верхние участки рек, а морская trachurus приходит на размножение из моря и нерестится в эстуариях и нижних течениях рек. Зоны перекрывания между ними очень узкие, и гибриды редки, так что поток генов между двумя формами весьма ограничен. Хойтс (Heuts, 1946, 1947b) на основании экспериментов полагает, что различие в температурных и соленостных оптимумах развития икры между двумя формами является одним из факторов, ограничивающих поток генов между trachurus и leiurus. Обе формы различаются по числу позвонков, длине тела и другим признакам. Тем не менее Хойтс (Heuts, 1947b) не называет эти формы видами.
Вместе с тем во всех остальных изученных случаях в Европе обнаруживается широкая интрогрессия между trachurus и leiurus с образованием значительной доли semiarmatus (промежуточного фенотипа). Такие ситуации выявлены в бассейне Северного и Балтийского морей (Münzing, 1959, 1962, 1963, 1972; Penczak, 1965, 1966; Erkinaro-Eino, 1976; Gross, 1977; Paepke, 1982, и др.), Баренцева моря (Берг, 1949), Белого моря (Зюганов, 1978, 1980, 1983а), т. е. везде там, где встречаются обе формы — trachurus и leiurus. Судя по данным японских авторов, такая же широкая интрогрессия между двумя формами происходит в Японии, где также встречаются trachurus, leiurus и semiarmatus (Kobayashi, 1932; Ikeda, 1933, 1934; Igarashi, 1964, 1965, 1970, и др.).
Что касается Сев. Америки, то морфа leiurus встречается там преимущественно на западном побережье, на восточном отмечены всего лишь 4 находки leiurus (Bell, 1984). Там и в пресных водах доминирует морфа trachurus. Однако на Тихоокеанском побережье отмечено достаточно много случаев триморфизма в пресноводных популяциях, по крайней мере часть из которых можно трактовать как результат широкой интрогрессии между морской trachurus и пресноводной leiurus. Так, Нарвер (Narver, 1969) исследовал Gasterosteus aculeatus в озерах Чигник и Блэк на Аляске (США). Озеро Блэк, более удаленное от моря, соединяется рекой с оз. Чигник, из которого река впадает в море. Обе озерные популяции триморфны (t+s+l), причем trachurus подразделяется на два фенотипа: эстуарный и озерный. Первый имеет более широкие пластины и развитый киль. В оз. Блэк частота leiurus и semiarmatus больше, a trachurus меньше, чем в оз. Чигник. Эстуарные фенотипы (т. е. проходная trachurus) встречаются в оз. Чигник, но крайне редки в оз. Блэк. В эстуарии встречается только trachurus. Нарвер (Narver, 1969) полагает, что «эстуарный фенотип оказывает генетическое влияние на обе озерные популяции. Миллер и Хаббс (Miller, Hubbs, 1969) на основании исследования большого коллекционного материала обосновали возможность широкой интрогрессии между различными популяциями trachurus, leiurus и hologymna на западном побережье США. Множество полиморфных пресноводных популяций западного побережья США (от Аляски до Южной Калифорнии) описано Хагеном и Гильбертсоном (Hagen, Gilbertson, 1972), Беллом (Bell, 1976а, 1982, 1984), Эвайсом (Avise, 1976) и другими авторами.
Таким образом, начиная с 50-х гг. нашего века широкие популяционные исследования в природе при тщательном изучении изолирующих механизмов с привлечением экспериментальных методик выявили целый ряд сильно дивергировавших популяций (алло-, пара- и симпатричных) пресноводных колюшек (в основном в бассейне Тихого океана). Была установлена та или иная степень развития механизмов репродуктивной изоляции между разными формами — от отсутствия таковых до полной репродуктивной изоляции. Возникает такое положение, которое Майр (1974) образно назвал «кошмар для систематика — радость для эволюциониста». Вуттон (Wootton, 1976, с. 256) подчеркивал, что поскольку в таксоне Gasterosteus aculeatus идут, с одной стороны, процессы видообразования, а с другой — процессы реинтеграции в единый, морфологически менее вариабельный вид, то этот динамизм должен предостерегать систематиков от «применения строгих правил». В то же время Вуттон вряд ли прав, считая, что «только широкие эксперименты по скрещиваниям и морфологическое, анатомическое, биохимическое, физиологическое и поведенческое исследования дадут твердый базис для классификации трехиглой колюшки». Дело в том, что этот таксон уже достаточно хорошо изучен с применением подходов, указанных Вуттоном, и уже сейчас ясна невероятная сложность структуры этого таксона, и дальнейшие исследования несомненно только вскроют еще большую сложность и в смысле классификации не дадут ничего нового.
На мой взгляд, применение биологической концепции вида «виды — это группы действительно или потенциально скрещивающихся естественных популяций, репродуктйвно изолированные от других таких групп» (Майр, 1974) к таксону Gasterosteus aculeatus приводит к неизбежному заключению, что он не является биологическим видом, поскольку в этом таксоне обнаруживается множество популяций, скрещивания между которыми предотвращены той или иной степенью репродуктивной изоляции. Поэтому позиция объединителя в этом случае будет уязвима. С другой стороны, если мы попытаемся «раздробить» таксон на несколько видов меньшего объема: например, Gasterosteus trachurus, Gasterosteus leiurus, Gasterosteus hologymna и т. п., мы рискуем поднимать до видового ранга почти каждую изолированную популяцию, поскольку у Gasterosteus aculeatus весьма высока морфологическая и этологическая изменчивость. К тому же непременно столкнемся с тем, что ряд этих «видов» будет связан в областях контакта зонами интеградации. Поэтому позиция дробителя здесь также уязвима, как и объединителя. Не случайно большинство современных исследователей-популяционистов, описавших сильно дивергировавшие популяции трехиглой колюшки и установивших наличие репродуктивной изоляции, в ряде мест отказалось от возведения, в соответствии с правилами зоологической номенклатуры, этих популяций в ранг видов (McPhail, 1969; Moodie 1972а, 1972b; Larson, 1976; McPhail, 1984; Ridgway, McPhail, 1984). Единственным исключением явилась работа Хагена (Hagen, 1967), в которой автор предложил выделить морскую форму trachurus в самостоятельный вид Gasterosteus trachurus, а пресноводную форму именовать другим видом Gasterosteus aculeatus. Его в этом начинании никто не поддержал, и вскоре он сам отказался от такой классификации (Hagen, McPhail, 1970), признав, что «в одних местах они могут вести себя как виды, а в других как подвиды».
В этой же работе Хаген и Мак-Фейл (Hagen, McPhail, 1970) подвергли критике концепцию Миллера и Хаббса (Miller, Hubbs, 1969) считавших, что все морфологическое разнообразие Gasterosteus aculeatus на Тихоокеанском побережье Сев. Америки происходит от вторичной интерградации трех ранее разделенных подвидов Gasterosteus aculeatus aculeatus (trachurus), Gasterosteus aculeatus microcephalus (leiurus) и Gasterosteus aculeatus williamsoni (hologymna). Полемизируя с Миллером и Хаббсом (Miller, Hubbs, 1969), Хаген и Гильбертсон (Hagen, Gilbertson, 1972) приводят доказательства того, что обмен генами между анадромной trachurus и пресноводной leiurus не является главной причиной полиморфизма, поскольку ими найдены 4 изолированные и полиморфные (t+s+l) популяции колюшки, обитающие в озерах, расположенных в глубине материка и образовавшихся около 10 тыс. лет назад (озера Шелан, Бапато и др.). Авторы заключают, что эти морфы произошли в результате отбора и именуют ситуацию «сбалансированным полиморфизмом».
Белл (Bell, 1976а) показал, что подвиды Gasterosteus aculeatus williamsoni и Gasterosteus aculeatus microcephalus, выделенные Миллером и Хиббсом (Miller, Hubbs, 1969), на самом деле являются сборными таксонами и многие калифорнийские популяции leiurus и hologymna произошли от морской trachurus независимо друг от друга.
Белл (Bell, 1976а) обосновал точку зрения, в соответствии с которой комплекс форм в пределах Gasterosteus aculeatus является надвидом. Он установил, что фенотипическая дифференциация Gasterosteus aculeatus произошла уже в позднем миоцене, по крайней мере 10 млн. лет назад: все отпечатки leiurus, hologymna обнаружены в пресноводных отложениях, a trachurus — в морских. Судя по морфологии, trachurus существенно не изменилась за этот длительный срок. Белл предложил следующую модель становления надвида. Морская форма trachurus — это основная стволовая линия, от которой отщепились в разных местах и в разное время на протяжении 10 млн. лет пресноводные изоляты leiurus. Trachurus не изменилась с миоцена из-за стабильных условий в море; южная граница ее ареала определяется сочетанием высокой солености и высокой температуры воды. В плейстоцене, во время ледниковых периодов ее ареал пульсировал около 20 раз. Этим создавались хорошие возможности для изоляции отщепившихся пресноводных ручьевых популяций, а вторичный контакт с морской trachurus закреплял биологическую изоляцию. Таким образом, видообразование у колюшек аллопатрическое, механизм — локальный отбор в пресных водоемах, где условия более разнообразны, чем в море. Давление и направления отбора разные в разных географических изолятах. К настоящему времени, по мнению Белла (Bell, 1976а), часть этих изолятов — уже виды; часть — полувиды, находящиеся на пути к скорому завершению становления изолирующих механизмов. Морская trachurus является по существу и предковым, и сестринским видом по отношению к группе пресноводных видов и полувидов leiurus и hologymna (Bell, 1979а).
Для более полного понимания эволюции Gasterosteus aculeatus до последнего времени не хватало ответов на следующие важные вопросы: 1) каковы пусковые механизмы становления морфы leiurus в пресных водоемах и с какой скоростью идет образование этой морфы от морских рыб-основателей? 2) могут ли пресноводные популяции снова стать анадромными? (Bell, 1976а). Понятно, что ответить на эти вопросы было трудно, поскольку во всех случаях исследователи имели дело уже с результатами процесса микроэволюции. Для ответа на них стоило попытаться путем эксперимента в природных условиях воспроизвести вселение морских рыб в пресный водоем, где ранее не было колюшек, следить за такой навообразованной популяцией, а затем имитировать ее возврат в морские условия. Понятно, что в большинстве случаев сделать это технически трудно. Трудно было также предсказать, сколько потребуется времени, для того чтобы произошли интересующие нас события.
Нам удалось провести такие эксперименты в водоемах бассейна Белого моря (Зюганов, 1980, 1982, 1983а). Эти эксперименты описаны выше в разделах 2.7 и 4.5.4. Они показали, что пусковым механизмом образования морфы leiurus является изоляция небольшой группы основателей морских trachurus в пресноводном водоеме. Уже в первых нескольких поколениях происходит расщепление гетерозиготных trachurus на три морфы. Эксперименты также показали, что становление leiurus является необратимым процессом и эта морфа не может снова стать анадромной морской и при осолонении водоема вымрет. Физиологическим механизмом этого является открытое Гутсом (Guts, 1970) явление пассивной осморегуляции leiurus, не эффективной в морской воде при низких температурах, а также обнаруженный нами (Зюганов, Хлебович, 1979) эффект отсутствия активации спермиев leiurus в морской воде. Таким образом, в море невозможно существование самовоспроизводящейся группировки особей leiurus. Надвидовая концепция Белла (Bell, 1976а) «Gasterosteus aculeatus superspecies» не полностью описывает эволюционно-таксономическую ситуацию у Gasterosteus aculeatus, поскольку в ряде случаев trachurus и leiurus, достигшие видового и полувидового ранга, сосуществуют парапатрично и симпатрично (Hagen, 1967; McPhail, 1969; Hagen, McPhail, 1970; Moodie, 1972a, 1972b; Зюганов и др., 1987). Это противоречит определению надвида (надвид — монофилетическая группа близкородственных и в значительной мере или полностью аллопатрических видов, — Майр, 1971).
Грант (1980, с. 177) отмечал, что для обозначения популяционных систем, промежуточных между расами и видами в отношении скрещивания друг с другом, интерградации и репродуктивной изоляции, используют термин «полувид». Совокупность аллопатрических полувидов называют надвидом (Майр, 1971; Грант, 1980). Грант (1980) предлагает совокупность симпатрических или маргинально симпатрических (погранично-симпатрических, — В. З.) полувидов называть сингамеон. Сингамеон, по его мнению, более всеобъемлющая популяционная система, чем биологический вид. В применении к таксону Gasterosteus aculeatus концепция «сингамеон» также не полностью описывает ситуацию из-за существования популяций leiurus, аллопатричных по отношению друг к другу, но явно достигших полувидового или видового ранга (например, популяции оз. Майер, — Moodie, 1972а, 1972b; оз. Пакстон, — Larson, 1976; оз. Энос, Ridgway, McPhail, 1984, и др.). Описания таких популяций даны в обзоре Белла (Bell, 1984). Таким образом, таксону Gasterosteus aculeatus присущи черты и надвида, и сингамеона.
Недавно Степанян (1983) выдвинул новую концепцию для описания сложных эволюционно-таксономических ситуаций, которую он назвал «экс-конспециес» (былой единый вид). Экс-конспециес — монофилетическая группа таксонов, которым придается видовой ранг, хотя они связаны зонами вторичной гибридизации и поэтому могут считаться занимающими пограничное положение между видом и подвидом. К сожалению, и эта концепция описывает рассматриваемую ситуацию не полно, так как имеются примеры существования trachurus и leiurus в качестве внутрипопуляционных группировок (Avise, 1976; Зюганов, 1978, 1980, 1983а, 19836).
Таким образом, ни одна из существующих эволюционно-таксономических концепций (биологический вид, надвид, сингамеон, былой единый вид) не в состоянии описать ситуацию в таксоне Gasterosteus aculeatus. В роде Gasterosteus действительно существуют не биологические виды (за исключением Gasterosteus wheatlandi), а только популяции, находящиеся на разных стадиях генотипической и фенотипической изоляции. Принимая во внимание значительный возраст этого таксона (не менее 10 млн. лет), не похоже, что данная структура его сформировалась из-за незавершенности видообразования. За такое длительное время видообразование могло завершиться неоднократно. На мой взгляд, большинство изученных форм в этом таксоне не является зарождающимися видами in statu nascendi. Напротив, начавшаяся генетическая дивергенция фиксировалась на разных стадиях в разных частях ареала и дальше не пошла. Важно подчеркнуть, что эти формы «не стремятся» к завершению видообразования. Здесь мы наблюдаем не видообразование как динамический процесс, а квазистационарное состояние приостановившейся дивергенции, способной в ряде случаев к реверсии (Зюганов, 1988, 1989).
Такая структура характерна не только для Gasterosteus и Pungitius (см. след. раздел), но и для многих других групп рыб Coregonus, Salvelinus, Brachymystax, населяющих водоемы высоких широт с нестабильными условиями среды (Мина, Васильева, 1979; Решетников, 1980; Савваитова, 1982). Такая популяционная структура обеспечивает им большую стабильность. Пока остается открытым вопрос, на каких основах должна строиться классификация групп с такой структурой. В своей работе «Проблема вида у Gasterosteus aculeatus на Тихоокеанском побережье Северной Америки» Хаген и Мак-Фейл (1970, с. 154) ставили вопрос: «Одно и то же Gasterosteus aculeatus в Европе и Америке?». Мне кажется, на этот вопрос можно дать следующий ответ: «Да, морская trachurus и в Европе, и в Америке, и в Восточной Азии одно и то же». На удивительное однообразие и стандартность фенотипа trachurus у морских колюшек из разных морей обращал внимание еще Берг (1949). Действительно, по данным всех авторов, изучавших фенотипическую изменчивость trachurus, число пластин у этой формы колеблется от 30 до 35 (Ikeda, 1934; Heuts, 1947b; Münzing, 1963; Igarashi, 1970; Hagen, 1967; Miller, Hubbs, 1969; Igarashi, 1970; Hagen, Gilbertson, 1972; Coad, Power, 1973a; Bell, 1982; Paepke, 1982), всегда есть киль, всегда есть 3 колючки, pelvis, тело стандартной веретенообразной формы, относительно много жаберных тычинок. Судя по палеонтологическим данным (Bell, 1977), морская trachurus морфологически почти не изменилась с позднего миоцена. В любом море экологическая ниша у trachurus всегда одна и та же — планктофаг (отсюда большое число жаберных тычинок), пелагический образ жизни детерминирует веретенообразную форму тела.
Таким образом, морские условия поддерживают жесткий стабилизирующий отбор, действующий на морскую форму.
Иначе обстоит дело с пресноводной формой. Ясно, что генофонды популяций leiurus в разных географических точках далеко не идентичны, однако в каждой такой популяции зафиксированы аллели, определяющие число боковых пластин, характерное для leiurus. По существу leiurus из разных местообитаний и из разных районов объединяет только один признак — «уменьшенное число боковых пластин». Но этот признак — «признак-редукция», «признак-утрата». Майр (1971, с. 255) совершенно справедливо подчеркивал, что признаки-утраты имеют малый таксономический вес, поскольку утраты могут произойти независимо в филетических линиях, связанных более или менее отдаленным родством. Таксоны, основанные на утрате глаз, жилок крыла, пальцев, сегментов и т. д., нередко оказываются неестественными. По существу у leiurus из разных районов происходят независимо утраты не только боковых пластин, но и колючек спинных, брюшных, тазового пояса, красной брачной окраски, солеустойчивости и т. п. В то же время у leiurus варьируют форма тела, число жаберных тычинок, окраска, размеры тела и многие другие, признаки. Таким образом, leiurus из Америки и leiurus из Европы — не одно и то же.
В настоящее время трехиглую колюшку обозначают как таксон Gasterosteus aculeatus species-complex (Wootton, 1976; Nelson, 1977; Bell, 1984), с чем я согласен, поскольку ни объединение в один вид (Gasterosteus aculeatus), ни раздробление на ряд самостоятельных видов не соответствовало бы действительности.
Таким образом, я принимаю следующую классификацию рода Gasterosteus: этот род состоит из вида Gasterosteus wheatlandi и таксона Gasterosteus aculeatus species-complex (без подвидов).
Эволюционно-таксономические отношения форм в роде Pungitius.
Как уже отмечалось в разделе 4.1, в роде Pungitius к началу XX в. было описано 19 видов (6 видов в Европе, 8 в Америке и 5 в Восточной Азии). Бертэн (Bertin, 1925) их синонимизировал и свел в один вид Pygosteus pungitius. С синонимизацией Бертэна полностью согласился лишь Мюнцинг (Münzing, 1969), а остальные авторы ее не приняли (Берг, 1949; Wootton, 1976; Gross, 1979), хотя между ними также нет единой точки зрения на систематику Pungitius. Берг (1949, с. 965) выделяет 4 вида: Pungitius pungitius (с двумя подвидами Pungitius pungitius pungitius и Pungitius pungitius sinensis), Pungitius platygaster с 2 подвидами (Pungitius pungitius platygaster, Pungitius pungitius aralensis), Pungitius laevis, Pungitius tymensis (в видовой самостоятельности Pungitius tymensis, впрочем, Берг (1949, с. 969) не уверен: «Возможно, — писал он, — что это одна из форм Pungitius pungitius). С сохранением видовой самостоятельности Pungitius pungitius и Pungitius platygaster согласились впоследствии европейские (Wootton, 1976, 1984; Gross, 1979) и американские (Nelson 1971а; Bell, 1984) исследователи, которые, однако, не признали видового статуса Pungitius laevis и Pungitius tymensis, считая их подвидами Pungitius pungitius. Они же (Wootton, 1976; Bell, 1984), вслед за Бергом (1949), признают только подвидовой статус Pungitius pungitius sinensis. Отечественные систематики (Никольский, 1956; Линдберг, Легеза, 1965) также признают только подвидовой статус Pungitius pungitius sinensis, однако японские исследователи (Kobayashi, 1957; Igarashi, 1969; Tanaka, 1982, и др.) считают Pungitius pungitius, Pungitius sinensis и Pungitius tymensis самостоятельными видами на Дальнем Востоке. Итак, таксономическая ситуация в роде Pungitius и сейчас остается спорной. У Pungitius имеются, аналогичные описанным у Gasterosteus, морфы, разделяемые прежде всего по боковым пластинкам и килю (Зюганов, 19836) (рис. 4), а также по числу позвонков, жаберных тычинок и пластическим признакам. Систематики-дробители считают эти морфы видами (Kessler, 1859; Берг, 1949, и др.), объединители — подвидами или иными внутривидовыми группировками (Bertin, 1925; Münzing, 1969). В число этих форм, по Бергу (1949), входят: Pungitius pungitius, Pungitius pungitius sinensis, Pungitius tymensis, Pungitius platygaster, Pungitius platygaster aralensis, Pungitius laevis. Кроме этих 6 форм известны еще 4. В Сев. Америке различают 2 формы Pungitius pungitius. Bering-form, mississippi-form (McPhail, 1963). Берингийская форма имеет до 15 (в среднем 5) пластин на теле, больше спинных колючек и меньше жаберных тычинок, чем миссисипская, у которой отсутствуют пластины на теле. Обе формы имеют киль. Мак-Фейл (McPhail, 1963) полагает, что они пережили висконсинское оледенение в разных рефугиумах — берингийском и миссисипском. Ныне они распространены парапатрично, с узкой и длинной зоной контакта (рис. 47, б), различия между ними по морфологии — подвидового ранга. В эксперименте показано, что между ними есть поведенческая репродуктивная изоляция (почти полная). В свою очередь обе формы в значительной степени репродуктивно изолированы (судя по аквариумным тестам по предпочтению) от европейских колюшек из Англии (Foster, 1977). Судя по описаниям и фотографии, приведенным в работе Фостера, колюшки из Англии — Pungitius pungitius laevis. 2 другие формы описаны японскими авторами (Ishigaki, 1967): trachura—pungitius и Pungitius species.
Таксономические отношения pungitius — platygaster.
В Европе в настоящее время Pungitius pungitius обитает в бассейне Северного Ледовитого океана, Северного и Балтийского морей, а Pungitius platygaster — в бассейне Черного, Азовского и Каспийского морей. Их ареалы разделены незанятой областью. Pungitius pungitius имеет 0—5 (чаще 2—3) пластин на теле и хорошо развитый киль, у Pungitius platygaster киля нет, а на теле полный ряд пластин (30—34). Обе формы различаются и по ряду других признаков. Pungitius pungitius имеет больше позвонков и лучей в спинном и анальном плавниках, более низкое и длинное тело. Тело и хвостовой стебель Pungitius platygaster более короткие и высокие (табл. 26).
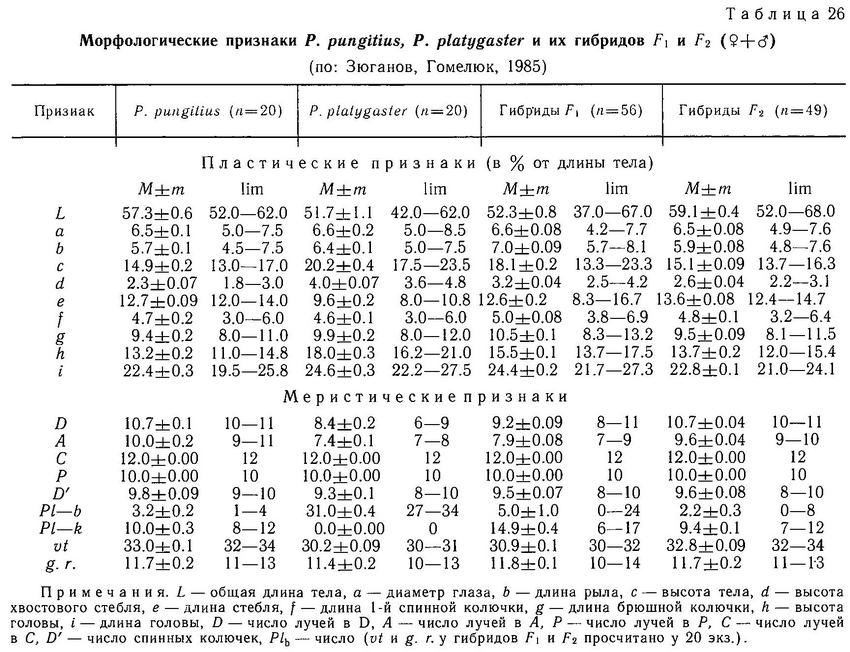
Хотя обе формы эврифаги, южная форма в большей мере бентофаг, склонный к скрытному, одиночному образу жизни в густой растительности. Северная форма — в большей мере планктофаг и хищник (поедает икру, личинок и мальков рыб). Она склонна к стайному пелагическому образу жизни и образует кроме жилой полупроходную форму. Очевидно, у Pungitius pungitius экологическая ниша шире (Зюганов, Гомелюк, 1985). Обе формы порционнонерестующие, но одноразовая индивидуальная плодовитость Pungitius pungitius больше. В биологии размножения и половом поведении между ними нет существенной разницы (Гомелюк, 1978) (рис. 35). Обе формы, например, и на Белом, и на Черном море начинают нерест при 17 °С. Количество хромосом у обеих форм 42 (Chen, Reisman, 1970; Е. Ю. Крысанов, личн. сообщ.).
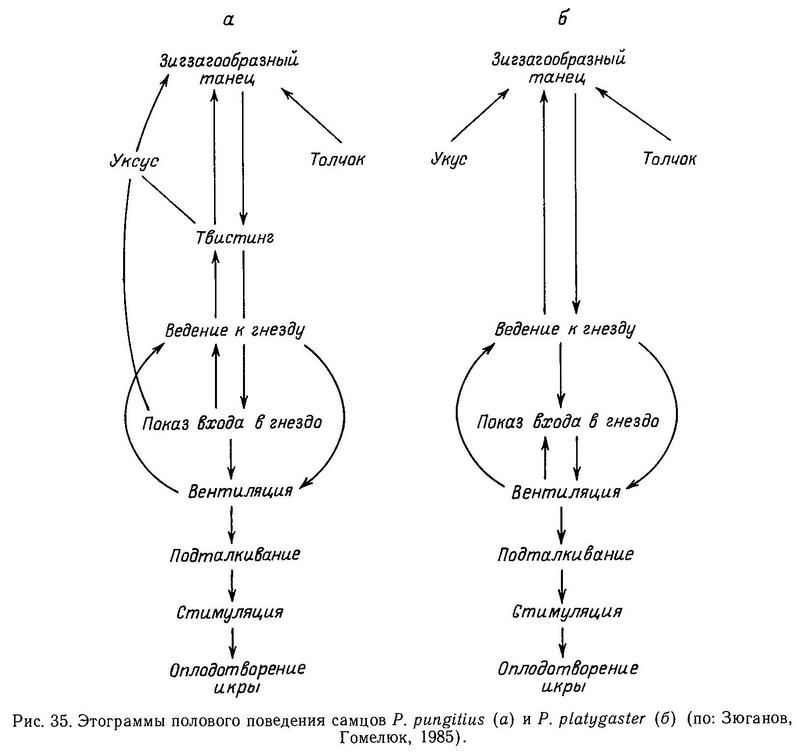
Большинство систематиков возводит эти формы в ранг видов (Берг, 1949; Gross, 1979), поскольку они обитают в разных природных зонах, а также имеют существенные морфологические отличия. Однако не всегда морфологические различия у аллопатричных форм коррелируют с наличием репродуктивной изоляции. Мюнцинг (Münzing, 1969) подчеркивал, что только эксперименты по скрещиванию прольют свет на истинные таксономические отношения между этими формами. Возможно, что дивергенция между ними не зашла далеко, и они всего лишь подвиды политипического вида. Мы предприняли попытку экспериментальных скрещиваний между 2 формами в аквариумах и природных водоемах на Белом море (Зюганов, Гомелюк, 1985).
Взрослые особи Pungitius pungitius были отловлены в р. Сходня (Московская обл.), куда в 70-х гг. они случайно были интродуцированы рыбоводами, а особи Pungitius platygaster — в Одесской обл. (Сухой Лиман). Внутривидовые и межвидовые скрещивания проводили в аквариумах, используя методику Фостера (Foster, 1977). Особенность этой методики состоит в том, что самка может свободно выбирать между конспецифичным самцом и самцом другого вида. Оказалось, что самки Pungitius pungitius и Pungitius platygaster почти равновероятно выбирают для нереста конспецифичных самцов и самцов «чужого» вида. Кроме того, когда самцу Pungitius pungitius или Pungitius platygaster, предлагали на выбор 2 самок — одну конспецифичную, а другую — «чужого» вида, во всех случаях и самец Pungitius pungitius, и самец Pungitius platygaster оплодотворял обеих (Зюганов, Гомелюк, 1985). Итак, аквариальные эксперименты показали отсутствие поведенческой репродуктивной изоляции между двумя таксономическими видами. Однако нужно было учесть, что при потенциальном контакте в природных условиях, несмотря на отсутствие поведенческих изолирующих механизмов, обмен генами между ними может быть затруднен из-за разных экологических предпочтений (Pungitius pungitius более пелагическая, а Pungitius platygaster более донная зарослевая форма). Кроме того, было неясно, плодовиты ли гибриды Pungitius pungitius х Pungitius platygaster или стерильны.
Мы провели групповые скрещивания pungitius х platygaster в природных изолированных водоемах (карьерах) на побережье Белого моря. Наблюдения за гибридными популяциями показали, что гибриды F1 и F2 плодовиты и жизнеспособны. Три созданные нами гибридные популяции способны к самовоспроизведению и существуют с 1981 г. в течение 4 лет, процветая и увеличиваясь в численности. Интересно, что если гибриды F1 фенотипически весьма разнообразны и мозаично наследовали морфологические особенности от обеих родительских форм (табл. 26), то гибриды F2 стали более однообразными и фенотипически сходными с Pungitius pungitius (Зюганов, Гомелюк, 1985). Следует сказать, что контрольная «чистая» форма Pungitius platygaster не выживает в северных условиях. Две попытки акклиматизировать здесь Pungitius platygaster оказались безуспешными. Несмотря на то что нерест Pungitius platygaster проходил успешно, мальки и взрослые, видимо, не выдерживают суровые северные зимы на широте 66°. Групповые скрещивания самцов гибридов с самками Pungitius pungitius также дают плодовитое потомство.
Итак, все эти опыты показали отсутствие пре- и посткопуляционных механизмов репродуктивной изоляции между Pungitius pungitius и Pungitius platygaster. Несмотря на то что обе формы имеют самостоятельные ареалы, развиваются (эволюционируют) независимо предположительно с плейстоцена в разных природных зонах и имеют различия в морфологии и экологии, между ними в случае контакта в природе (в умеренных температурных условиях) не будет непреодолимого изоляционного барьера. Контакт между ними ожидается в ближайшее время в Западной Сибири в р. Иртыш из-за нарушения ареала Pungitius platygaster (Зюганов, 19846), и можно предсказать интрогрессивную гибридизацию в случае этого контакта (Зюганов, Гомелюк, 1985) (рис. 36).
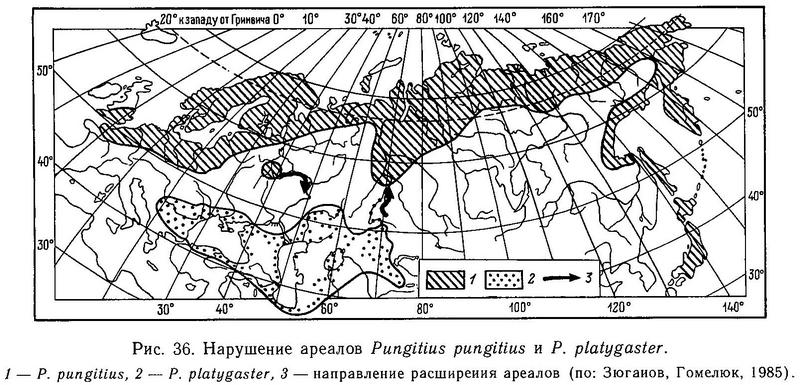
Таким образом, Pungitius platygaster и Pungitius pungitius не являются хорошими биологическими видами, но уже и не являются взаимозаменяемыми внутривидовыми формами из-за необратимой экологической дивергенции (разных температурных оптимумов). Две эти популяционные системы представляют промежуточные стадии дифференциации между разобщенными географическими расами и аллопатрическими видами. Дивергенция по морфологии и экологии у них не сопровождалась возникновением пре- и посткопуляционной изоляции. В эволюционном плане Pungitius pungitius и Pungitius platygaster следует рассматривать как полувиды (промежуточный статус между подвидом и видом), но в систематическом плане их следует оставить видами, поскольку еще мало доказательств того, что при широком контакте они сольются.
Таксономические отношения в группе pungitius — sinensis — tymensis на Дальнем Востоке.
В водоемах Дальнего Востока описаны три основные формы девятииглых колюшек рода Pungitius, таксономический статус которых вызывает споры. Форма pungitius имеет фенотипы leiurus + keel и hologymna + keel (от 0 до 5 пластин на теле) и киль. Форма tymensis имеет те же фенотипы, но отличается от pungitius отсутствием, мягких лучей в брюшном плавнике, киль у нее короче и менее развит, выходы каналов боковой линии по всему телу окаймлены костными ободками, брюшные и спинные колючки короткие, хвостовой стебель широкий и короткий. Форма sinensis имеет фенотип trachurus, у нее по сравнению с pungitius хвостовой стебель более длинный и узкий, больше позвонков и жаберных тычинок (Kobayashi, 1957) (рис. 37).
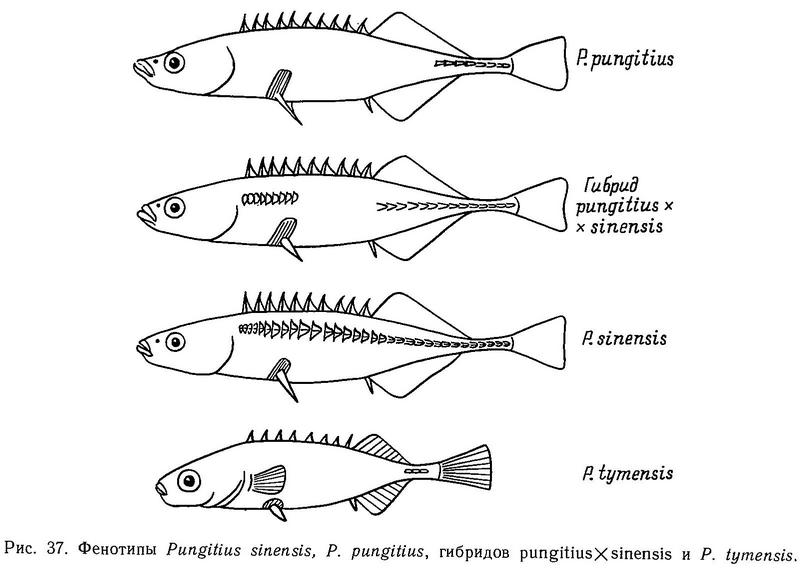
Форма pungitius обитает в прибрежных морских и пресных водах на материке — на Чукотке и Камчатке, в устье Амура, а также на островах — Шантарских, Курильских, Сахалине, Хоккайдо, Хонсю (Берг, 1949).
Советскими авторами sinensis рассматривается как подвид Pungitius pungitius (Берг, 1949; Никольский, 1956; Линдберг, Легеза, 1965, и др.) на том основании, что sinensis сменяет pungitius к югу от Камчатки в бассейнах Охотского, Японского и Желтого морей. Однако Берг (1949, с. 968) сам отмечал, что «в Амуре, в Охотском море, на Хоккайдо и на западном берегу Камчатки наряду с колюшками, покрытыми пластинками (т. е. sinensis — В. З.), встречаются и голые Pungitius pungitius». Кроме того, ареалы этих форм перекрываются на всех островах — Шантарских, Курильских, Сахалине, Хоккайдо и Хонсю. По этой причине pungitius и sinensis нельзя считать подвидами, так как ареалы подвидов, по определению, не должны значительно перекрываться. Подвид — совокупность фенотипически сходных популяций некоторого вида, населяющих часть ареала этого вида и таксономически отличных от других популяций того же вида» (Майр, 1971, с. 57).
Японские авторы (Kobayashi, 1957; Ishigaki, 1967; Igarashi, 1969; Tanaka, 1982, и др.) считают pungitius, sinensis, tymensis самостоятельными видами. Берг (19,49) считал tymensis видом, допуская возможность, что это одна из форм Pungitius pungitius. По данным японских авторов, на о. Хонсю (где перекрываются ареалы pungitius и sinensis) эти 2 формы фактически аллопатричны, т. е. обитают в разных реках: там, где живут pungitius, не встречается sinensis, и наоборот (Tanaka, 1982). Только в р. Хигара эти формы истинно симпатричны и «таксономически промежуточные фенотипы составляли 9.1 %, что свидетельствует о гибридизации между 2 видами и влечет за собой интрогрессию» (Tanaka, 1982).
Интересно, что в бассейне р. Магами (Хонсю) в окружении популяций фенотипа pungitius обитает популяция колюшек «Tendo», имеющих щитки по всему телу и киль (фенотип trachurus) (Igarashi, 1969). Эти колюшки выглядят как sinensis, однако от нее отличаются более мелкими щитками в грудной области. Называют таких рыб как «специальный тип Pungitius pungitius». Игараши (Igarashi, 1969) полагает, что типичный фенотип pungitius и фенотип trachura—pungitius из популяции Тендо являются результатом двух разных типов неотении фенотипа sinensis. Неотенизация (прерывание онтогенеза признака) последнего имеет место на более поздних стадиях жизненного цикла, чем первого. На этом основании Игараши (Igarashi, 1969) считает, что типичная pungitius и trachura-pungitius стали пресноводными жилыми в разное время и что каждый тип имеет свою собственную «эволюционную судьбу». Trachura—pungitius и sinensis различаются по структуре кариотипа, а также по э/ф-вариантам глюкозо- и галактозо-6-фосфат-дегидрогеназам (Muramoto et al., 1969).
В Японии также описана еще одна форма колюшки рода Pungitius, которая по характеру онтогенеза киля, а также по структуре щитков на киле не сходна ни с pungitius, ни с sinensis. Игараши (Igarashi, 1968) выделяет эту форму в самостоятельный вид Pungitius sp. Интересно, что по структуре кариотипа Pungitius sp. идентична Pungitius pungitius и Pungitius tymensis, но отличается от Pungitius sinensis. Однако по электрофоретическому спектру галактозо-6-фосфат-дегидрогеназы она идентична Pungitius pungitius, но отличается от Pungitius tymensis (Muramoto et al., 1969).
На о. Хоккайдо pungitius и sinensis также не встречаются в одних и тех же водоемах: в реках бассейна Охотского моря совместно обитают sinensis и tymensis, а в реках бассейна Тихого океана — pungitius и tymensis (Ishigaki, 1967). По данным Мурамото с соавт. (Muramoto et al., 1969), pungitius, sinensis и tymensis различаются по э/ф-вариантам двух вышеупомянутых ферментов, все они имеют 2n=42 хромосом, но по структуре кариотипа tymensis и pungitius идентичны, a sinensis достоверно отличается от них. Такова история вопроса. Видно, что таксономические отношения между 5 формами на Дальнем Востоке запутаны. Если большинство систематиков сходится во мнении, что Pungitius tymensis — самостоятельный вид, то в отношении других форм (и особенно форм pungitius и sinensis) много неясного. Понятно лишь одно, что концепция подвида в отношении форм pungitius и sinensis неприменима, поскольку ареалы их значительно перекрываются и как бы «вкраплены» друг в друга в шахматном порядке. Для разрешения этой проблемы нужно было найти такие водоемы, где они были бы истинно симпатричны. Тогда, сравнивая морфологические и иные признаки pungitius и sinensis, по наличию или отсутствию хиатуса можно было бы делать заключение о наличии или отсутствии репродуктивной изоляции в зоне контакта и решить проблему вида в группе pungitius—sinensis на Дальнем Востоке.
Такие водоемы были найдены нами в 1983 г. на Курильских островах и Сахалине. На о. Итуруп Курильской гряды в пресном оз. Рейдово (площадь 300х300 м) и реки, из него вытекающей (длиной 4 км) и впадающей в виде эстуария в Охотское море, были обнаружены 2 формы. В выборке из 1367 экз. оказалось 1282 экз. sinensis (93.8 %) и 85 экз. pungitius (6.2 %). По всей этой системе (устье ручья, впадающего в озеро — удаленная от моря и ближняя часть озера — верхняя, средняя, нижняя часть реки — устье реки) было сделано 7 выборок, чтобы выявить зависимость количественного соотношения форм по мере удаления от моря. Оказалось, что никакой «клинальности» нет, везде количественно доминирует sinensis. Однако непосредственно у зарослей водной растительности в любой части системы озеро—река pungitius встречалась с частотой 7.7—8.3 %, а в открытой части озера и реки; в толще воды над песчаным дном, — с частотой 0—0.75 %. Колюшек ловили сачком, предварительно подманивая их при помощи яркой белой бумажки на крючке, путем подергивания удочки. В этом водоеме sinensis является типичной пелагической стайной рыбой, тяготеющей к открытым пространствам. У нее типичная для пелагических рыб окраска: голубовато-зеленая однотонная спина и светлое брюшко. Форма pungitius, напротив, тяготеет к зарослям водной растительности и является придонной рыбой. Окраска у нее пятнисто-зеленая. Однако хищнический инстинкт у нее развит так же, как и у sinensis (она легко подманивается бумажкой из зарослей).
Судя по всему, кроме расхождения по биотопам у этих форм есть расхождение по срокам нереста. Так, в конце июля 1983 г. из 85 взрослых особей pungitius лишь самец имел брачную окраску, остальные самцы и все самки имели «пустые» гонады. Видимо, нерест у них уже закончился. В то же время большинство половозрелых самцов sinensis имели брачную окраску и находились у гнезд, самки были икряные. Видимо, у pungitius нерест проходит раньше, чем у sinensis. Различия в морфологических признаках между ними существенны (табл. 27). Очевидно, в местообитании «Рейдово» pungitius и sinensis являются репродуктивно изолированными, разошедшимися по разным экологическим нишам и срокам нереста формами. Там они ведут себя как хорошие виды. Только 1 экз. из 1367 исследованных имел фенотип, который можно трактовать как переходный между pungitius и sinensis.
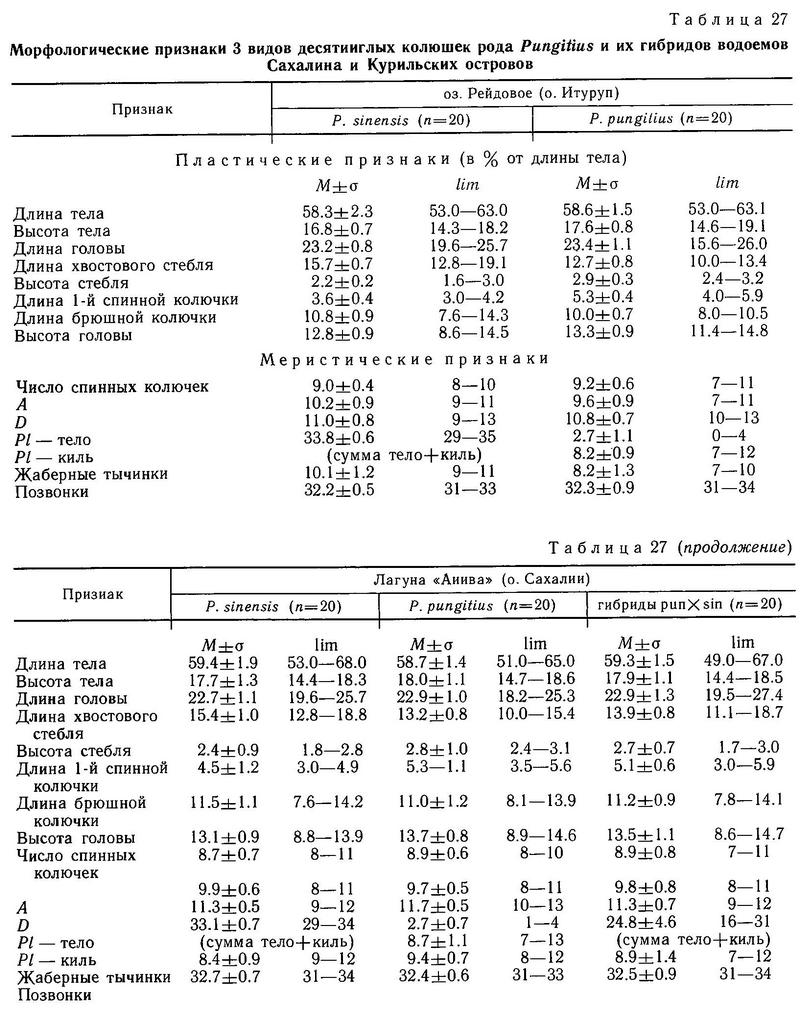
На о. Сахалин в 300 км от Курил нами были обнаружены водоемы, где все 3 формы (pungitius, sinensis, tymensis) встречаются вместе. Это озера Тунайча и Кормовое. Каждый из этих водоемов состоит из пресного озера и солоноватой лагуны, соединенных протокой. Соленость лагуны колеблется от слабосолоноватой (6 ‰) до 28 ‰, в зависимости от приливов. В пресной части обитают sinensis и tymensis, а в солоноватой части — pungitius. Sinensis и tymensis сосуществуют симпатрично (первый ведет стайный образ жизни в пелагиали, а второй обитает в зарослях водной растительности в литоральной зоне). Pungitius, не выходящий за пределы солоноватой зоны, является парапатричной формой по отношению к первым двум (рис. 38). Смещение морфологических признаков трех форм, обитающих в этих водоемах, является существенным. Недалеко от оз. Тунайча, на Южном Сахалине в таких же водоемах была обнаружена и иная ситуация. В оз. Чибисах и лагуне Анива отсутствует форма tymensis, и pungitius обнаруживает истинную симпатричность с sinensis. Pungitius проникает в пресную воду в этих водоемах, и обнаруживается значительная доля (24 и 31 % соответственно) промежуточных фенотипов по числу боковых пластин. По большинству остальных исследованных морфологических признаков средние достоверно не различаются и сближены (табл. 27).
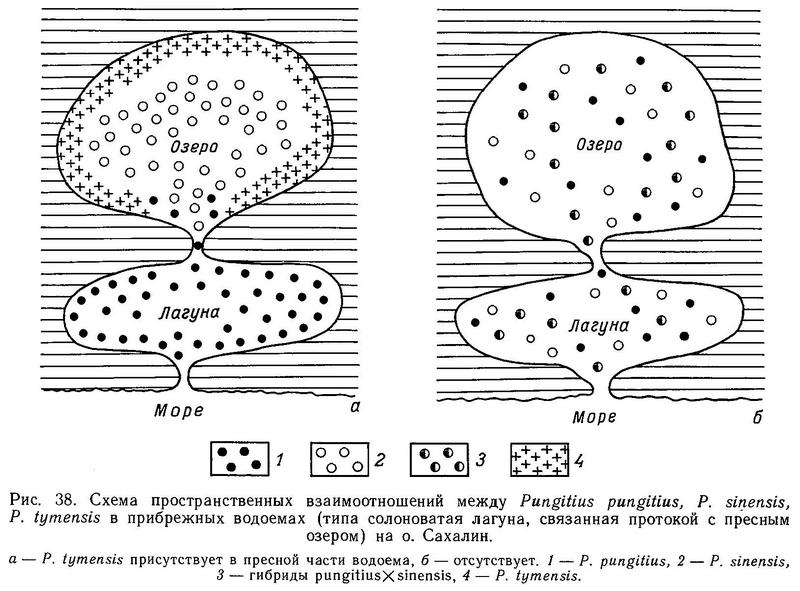
Очевидно, форма tymensis является хорошим видом по отношению к pungitius и sinensis, поскольку в зоне симпатрии с ними наблюдается разрыв по ряду морфологических признаков (длина стебля, высота стебля, длина брюшной и 1-й спинной колючки). Взаимоотношения между pungitius и sinensis сложнее. В тех водоемах, где присутствует пресноводная форма tymensis, pungitius не входит в пресную воду и является смежно-симпатрическим по отношению к sinensis и tymensis. Видимо, это объясняется большим сходством экологических ниш pungitius и tymensis (зарослевая литоральная зона). Там же, где нет tymensis, pungitius проникает в пресную воду, широко гибридизует с sinensis. Поэтому в водоемах типа Чибисах и Анива образуются смешанные популяции гибридов sinensis х pungitius.
Таким образом, на Сахалине вид Pungitius tymensis является как бы «изолятором», не допускающим пространственного и тем самым репродуктивного контакта между 2 формами в пресной воде. В то же время на о. Итуруп (где Pungitius tymensis отсутствует вообще) pungitius и sinensis истинно симпатричны и ведут себя как хорошие виды. Возникает вопрос — в чем причины различий ситуации на Сахалине и Итурупе? Видимо, ответ надо искать в различном возрасте этих островов (Курилы значительно моложе Сахалина) и, следовательно, в разном времени вторичного контакта 2 форм.
Из-за этого взаимоотношения sinensis и pungitius на 2 островах складывались по-разному. Судя по всему, pungitius и sinensis находятся на «полувидовом» уровне дифференциации и в одних частях ареала могут вести себя как хорошие, репродуктивно изолированные виды, а в других — широко гибридизовать или полностью сливаться. К этому добавим, что, по данным Кобаяши (Kobayashi, 1957), межвидовые гибриды sinensis х pungitius, sinensis х tymensis, tymensis х pungitius, полученные в эксперименте, росли и развивались, достигая годовалого возраста, и имели хорошо развитые гонады у обоих полов. Следовательно, в природных условиях механизмы репродуктивной изоляции у этих трех форм — биотопические и этологические.
Хотя популяционная структура в роде Pungitius иная, чем в роде Gasterosteus, у Pungitius имеются некие «блоки» популяций «pungitius», «laevis», «sinensis» и т. д., однородные внутри, но имеющие часто размытые границы в зоне контакта с соседними «блоками»; рассмотрение эволюционно-таксономической ситуации в этой группе по существу приводит нас к выводу, что, как и в роде Gasterosteus, популяции в таксоне Pungitius не «организованы» в виды в понимании биологической концепции вида.
Например, если брать в совокупности популяционные системы pungitius и platygaster в Европе, то здесь обнаруживается смесь признаков, сходных с расовыми и видовыми. Морфологически и экологически pungitius и platygaster достигли «видовой» стадии дивергенции. В то же время аквариальные эксперименты и экспериментальная гибридизация в условиях, максимально приближенных к природным (на Белом море), показали, что пре- и посткопуляционных механизмов изоляции между ними еще нет, гибридные популяции плодовиты и самовоспроизводимы. Майр (1971) в таких затруднительных для применения биологической концепции случаях предлагает сосредоточить внимание на главном свойстве вида — «защищенности генофонда». Попытаемся это сделать. Ясно, что в обсуждаемом нами случае генофонды двух совокупностей platygaster и pungitius не защищены ни разными биотопическими предпочтениями, ни этологической изоляцией, ни стерильностью или пониженной жизнеспособностью гибридов. Однако «чистая» популяция platygaster на севере не выживает из-за узкой приспособленности к «южным» условиям. Кроме того, из гибридных популяций на севере отбор, видимо, выбрасывает большинство генов platygaster, судя по почти полному морфологическому подобию гибридных популяций второго поколения и «чистых» популяций pungitius. Следовательно, в случае встречи и установления симпатрии platygaster и pungitius на севере генофонд pungitius будет защищен от «загрязнения» генами platygaster из-за низкой приспособленности последней к северным условиям. Встреча между ними на юге также может обернуться невозможностью внедрения генов pungitius в генофонд platygaster, поскольку икра pungitius не развивается при температуре 28 °С, обычной для нереста platygaster (Зюганов, Гомелюк, 1985). Зато нет никаких оснований ожидать взаимной защищенности генофондов в случае их встречи в природе в промежуточных условиях, скажем, при умеренных температурах воды. Такая встреча реально ожидается в Иртыше (Западная Сибирь) (Зюганов, 1984а). Следовательно, защищенность генофонда в разобранном примере зависит только от конкретных внешних природных условий, от места их встречи, что делает критерий «защищенности генофондов» весьма относительным, не рациональным и, разумеется, не являющимся внутренним свойством популяции.
Защищенность генофондов pungitius и sinensis на Дальнем Востоке также относительна и зависит от места их совместного обитания (Сахалин или Курилы), а также от наличия или отсутствия в водоеме «вида-изолятора» Pungitius tymensis, у которого экологическая ниша сходна с нишей pungitius. В некоторых местах sinensis и pungitius репродуктивно изолированы, а в других — широко гибридизируют и даже могут сливаться. В зависимости от желания исследователя их можно рассматривать как биологические виды, время от времени и в ряде мест гибридизирующие, а можно считать экологическими расами (sinensis — пресноводная, pungitius — солоноватоводная), разошедшимися в некоторых местах до уровня видов. Все зависит от того, каких ситуаций в природе больше, но чтобы это выяснить, придется сделать непосильную работу — обследовать десятки тысяч водоемов на достаточно обширной территории, где обе формы симпатричны, от о. Хонсю, до Камчатки. Но этого, видимо, и не требуется делать — важно знать, что могут быть реализованы все потенциальные исходы: от полной изоляции до полного слияния их генофондов.
Что касается таксономического статуса двух форм pungitius и sinensis на Дальнем Востоке, следует, видимо, пока считать их таксономическими видами, поскольку найдено больше таких ситуаций, когда они в зоне симпатрии репродуктивно изолированы (Зюганов, в печати; Tanaka, 1982; S. Tanaka, лич. сообщ.).
Таксономический статус беспластинковой (- голой) формы «laevis» в Западной Европе остается пока спорным. Берг (1949, с. 969) считал ее видом, правда никакого описания кроме характеристики «тело голое, киля нет» он не дает, так же как не дает аргументации за вид. Мюнцинг (Münzing, 1969) считает эту форму подвидом. Гросс (Gross, 1979) на основании того, что она «находится на юго-восточном конце клины по числу боковых пластин», и на основании того, что в Америке «миссисипи-форму Pungitius pungitius», также не имеющую пластин, Мак-Фейл (McPhail, 1963) не выделяет в подвид, предлагает «laevis» также не выделять в подвид. Однако, несмотря на то что я сам не исследовал эту форму, считаю, что она удовлетворяет требованиям, предъявляемым к подвидам, — имеет географическую самостоятельность (обитает в Западной Франции, Англии, Ирландии и Греции, существенно не перекрываясь пространственно с Pungitius pungitius) и надежно отличается от Pungitius pungitius отсутствием пластин и киля.
Стефанидис (Stephanidis, 1971) в бассейне р. Сперхиос (Греция) обнаружил колюшек рода Pungitius, лишенных полностью боковых пластин, киля на хвостовом стебле и брюшных колючек. Тазовый пояс у рыб был также редуцирован, причем на выборке из 40 экз. автор наблюдал изменчивость по выраженности редукции pelvis — от наличия брюшной пластины с зачатками колючек до остатков левой или правой косточек pelvis. Кроме того, спинных колючек было 1—6, т. е. меньше, чем это характерно для Pungitius. На основании того, что эта популяция Pungitius изолирована пространственно от остального ареала видов Pungitius (ближайшие популяции Pungitius platygaster — в Болгарии), а также на основании редукции тазового пояса и уменьшенного числа спинных колючек Стефанидис (Stephanidis, 1971) придает видовой статус этой популяции и называет ее Pungitius hellenicus n. sp. По остальным признакам (D I—VI 8—10, А I 8—10, Р 9—10, V 0—0, С 12) Pungitius hellenicus не отличается от Pungitius pungitius. Рисунок на с. 230, приведенный в указанной работе и описывающий Pungitius hellenicus, ничем не отличается от рис. 70 (с. 146), приведенного в работе Бертэна (Bertin, 1925) и описывающего Pungitius pungitius laevis (окраска, форма тела, пропорции тела, в частности высота тела, хвостового стебля, форма хвоста и т. п.). Таким образом, вероятнее всего, Стефанидис имел дело с реликтовой популяцией формы «laevis», и пока нет достаточных оснований выделять ее в самостоятельный вид. Этот «вид» не признан другими исследователями колюшковых (Wootton, 1976, 1984; Gross, 1979; Bell, 1984), поскольку у исследователей, имеющих дело с родами Gasterosteus и Pungitius, есть некое молчаливое соглашение не описывать каждую популяцию с морфологическими особенностями как вид; вследствие высокой изменчивости колюшковых пришлось бы бесконечно описывать многие сотни и тысячи видов. Так, беломорские популяции Pungitius pungitius без тазового пояса тоже бы пришлось описывать как вид, Pungitius pungitius laevis в Ирландии, Pungitius pungitius в Канаде, много популяций Gasterosteus — как виды и т. д. Итак, скорее всего, это Pungitius pungitius laevis.
Таким образом, после рассмотрения эволюционно-таксономической ситуации в роде Pungitius считаю оправданным выделение следующих таксономических видов: Pungitius pungitius, Pungitius platygaster, Pungitius tymensis, Pungitius sinensis, а форму «laevis» следует рассматривать как подвид Pungitius pungitius laevis.
В целом система сем. Gasterosteidae выглядит следующим образом.
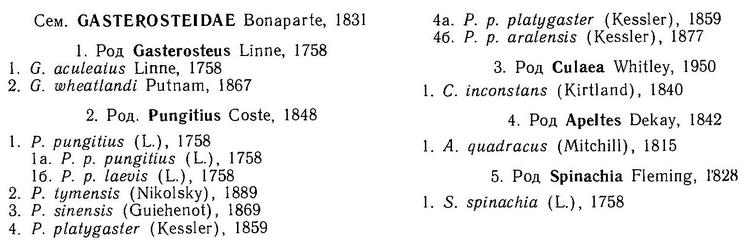
5. ХОЗЯЙСТВЕННОЕ И ПРИКЛАДНОЕ ЗНАЧЕНИЕ
Колюшковые рыбы из-за небольших размеров и «костного вооружения» относятся к малоценным и даже сорным рыбам. Специальный промысел колюшковых развит незначительно. Из всех колюшковых только Gasterosteus aculeatus и Pungitius pungitius (поскольку только они характеризуются широким распространением и высокой численностью) в какой-то мере охвачены промыслом. В литературе неоднократно обсуждался вопрос о хозяйственном вреде и хозяйственной пользе, колюшек (Regan, 1911; Европейцева, 1946; Троицкий, Фролов, 1949; Смирнов, 1951; Абдель-Малек, 1963; Мухомедияров, 1966; Пинский, 1967; Rogers, 1968; Костричкина, 1970; Никольский, 1971; Банина, Исаков, 1972; Кириллов, 1972; Самохвалова, 1973; Носкова, 1975; Wootton, 1976; Гомелюк, 1978, 1980; Кириллов, Тетерин, 1979; Сабанеев, 1982; Прокопенко, 1983; Максимов, Долгов, 1983, и др.).
Колюшкам в основном предъявляются 3 «обвинения»: 1) хищник по отношению к икре и молоди промысловых рыб; 2) пищевой конкурент промысловых рыб; 3) разносчик паразитарных инфекций по ихтиоценозу. В защиту колюшек приводятся такие аргументы: 1) предмет питания для ценных промысловых рыб; 2) ценность колюшек как технического сырья для медицинской промышленности, для производства кормовой пасты для скота и птицы, как технический жир для мыловаренной, кожевенной, химической и др. отраслей промышленности, удобрений для полей и др.; 3) колюшки Gasterosteus aculeatus и Pungitius pungitius являются единственными потребителями бентоса и зоопланктона литоральной зоны в северных широтах, где отсутствуют другие рыбы, способные занимать эту нишу (Гомелюк, 1980); 4) колюшки могут являться удобными видами-индикаторами химических загрязнений и других «средовых стрессов» (Захаров, Зюганов, 1980). Кроме того, колюшка является удобным модельным экспериментальным объектом, на котором разработаны многие проблемы микроэволюции, паразитологии, экологической физиологии, этологии и других разделов биологии, поэтому колюшки имеют не только хозяйственное (положительное или отрицательное), но и прикладное (в широком смысле) значение.
Рассмотрим все эти аргументы «за» и «против» подробнее. Предъявляемое колюшкам первое «обвинение» в поедании икры и молоди ценных промысловых рыб основано на отрывочных сведениях, а более детальные исследования питания колюшек в естественных условиях редко подтверждают это, так как в период нереста большинства промысловых рыб Gasterosteus aculeatus и Pungitius pungitius оказываются разобщенными с ними пространственно, занимая совершенно иные нерестовые биотопы (хорошо прогреваемые мелководья глубиной от нескольких сантиметров до 1 м). Крайнюю точку зрения о роли колюшек в водоемах высказал Сабанеев (1982): «Все колюшки очень прожорливы и принадлежат к числу самых вредных рыб: если бы колюшка не истребляла своей собственной икры, то, конечно, она в скором времени перевела бы всех рыб». Романычева (1952), основываясь на аквариумных наблюдениях за девятииглой колюшкой Pungitius platygaster aralensis, когда колюшка съела за два дня четырех предложенных ей мальков шемаи и сазана, заключила, что колюшка является хищником, поедающим на нерестилищах Аральского моря мальков ценных промысловых рыб. На эту работу стали ссылаться другие авторы (Дмитриев, 1953, и др.) утверждая, что колюшка опасный хищник. Между тем подробное исследование питания аральской колюшки в естественных условиях показало, что основу ее питания составляет зоопланктон (Diaptomus) и личинки хирономид (Никольский, 1940; Линдберг, 1947) и никаких рыб в ее пищевом спектре нет. Европейцева (1946), говоря о «пожирании колюшкой икры, личинок и мальков других рыб, в том числе и промысловых», ссылается на работы Кесслера, Сабанеева и других авторов, которые на самом деле опирались на свидетельства рыбаков, сообщавших, что с увеличением колюшки в водоемах уменьшается количество других видов рыб, например ряпушки. На самом деле опираться надо на работы, где детально изучен пищевой спектр колюшки в естественных условиях.
Абдель-Малек (1963) подробно исследовал пищевой спектр морской формы trachurus трехиглой колюшки Кандалакшского залива Белого, моря и приходит к выводу, что «колюшка уничтожает икру и личинок корюшки, сельди и камбалы, нанося этим вред рыбному хозяйству».
Вместе с тем если обратиться к данным самого автора, подробно изложенным в его табл. 1, то видно, что из 7 проанализированных морских заливов колюшка только в 2 поедала икру сельдевых, причем по массе эта икра составляла 13.5—13.7 %, а по встречаемости 13.7—16.7 %. Личинки сельдевых потреблялись колюшкой в 1 из 7 заливов (процент по массе 2.8, по встречаемости 2.3). Икра камбалы встречалась в желудках колюшек в 2 из 7 заливов (процент по массе 0.15—0.62, по встречаемости 8—16.7). Икра корюшки в таблице вообще не фигурирует, хотя в выводах есть. В то же время общее число пищевых компонентов спектра колюшки 38 (бентос, планктон и др.), а львиную долю массы пищевого комка колюшки составляет собственная икра (она встречалась в 6 местообитаниях из 7, причем по массе составляла от 36.4 до 95.3 %, по встречаемости 17.7—92.3 %), в среднем 60—70 %.
Таким образом, колюшка главным образом питается собственной икрой, планктоном и бентосом, а не икрой и личинками хозяйственно ценных рыб, судя по анализу данных Абдель-Малека (1963). На примере этой работы видно, как господствующая с прошлого века парадигма о вреде колюшек помешала автору, собравшему прекрасный подробный материал, беспристрастно и правильно проанализировать его и сделать адекватные выводы. Поэтому, если ссылаться на выводы этого автора, то его работа подтвердила вред колюшек, а если анализировать его материал, — то можно прийти к совершенно иному заключению. Абдель-Малек (1963), исследуя питание колюшки в июне—июле, отмечает, что у него нет данных по питанию колюшки за более ранний период, но ему «представляется, что она уничтожает значительное количество икры и личинок сельди, так как, по данным Соина (1961), нерест егорьевской сельди в Великой Салме происходит в первой половине мая» (с. 34—35). Опять-таки здесь хорошо видна степень «обоснованности» вывода автора.
Мухомедияров (1966) исследовал питание морской формы Gasterosteus aculeatus из того же района и пришел к заключению, что колюшка «поедает все, что ей доступно», особенно икру на нерестилищах других рыб, нанося этим существенный вред рыбному хозяйству Белого моря», причем автор ссылается на отдельные «указания» Гурвича (1938), Андрияшева (1954), Кузнецова (1954, 1960), что колюшка поедает икру и молодь рыб. Обратимся к непосредственным данным Мухомедиярова (1966, табл. 8). Им проанализировано 282 желудка колюшки за весенне-летний период 1957—1959 гг. В пищевом спектре колюшки обнаружено 8 компонентов, из них «икра сельди и других рыб» составляла по встречаемости 6 %, основную массу корма составляли личинки хирономид (48), зоопланктон (21) и икра колюшки (18). Мухомедияров (1966) приводит также неопубликованные данные Н. В. Печниковой (табл. 8) по питанию колюшки за 1949 год, и по ее данным икра сельди и других рыб по встречаемости составляла 2 %, а основную массу пищевого спектра составлял зоопланктон и личинки хирономид. Опять-таки, видно странное расхождение материалов автора и его выводов.
По нашим наблюдениям, проведенным в том же районе Кандалакшского залива, морская форма колюшки нерестится или на литорали (в мелких морских заливах), или в пресных ручьях, реках и озерах на мелководье. В пределах плотных нерестовых колоний колюшек нет или очень мало других видов рыб, так что колюшка не может питаться икрой и мальками других рыб по причине их отсутствия. Гомелюк (1978 и личн. сообщ.), проводивший многолетние наблюдения за нерестом колюшки на Белом море, пришел к сходному выводу. Семлер (Semler, 1971) наблюдал в оз. Вапато (штат Вашингтон, США), что 51 % колюшек на нерестилищах имели в желудках свою собственную икру.
Троицкий и Фролов (1949) отмечали также отрицательное влияние Gasterosteus aculeatus на нерест промысловых рыб Азовского моря в Кубанских лиманах. При этом авторы также ссылались на мнение Кесслера и Сабанеева, что колюшка поедает личинок и икру других рыб. Снова обратимся к конкретным данным Троицкого и Фролова (1949) по питанию колюшки в Кубанских лиманах, суммированным в табл. 12 (с. 197). Авторы исследовали 217 желудков колюшки и нашли, что процент потребления икры рыб равнялся 1.6 (основу питания составили зоопланктон и бентос, всего компонентов пищевого спектра 25). Авторы вынуждены признать, что «икра и личинки рыб отмечены в весьма незначительном количестве» (с. 198), но, веря в незыблемость парадигмы о вреде колюшки, они пытаются объяснить свои результаты тем, что «икра и личинки быстро перевариваются и их трудно обнаружить» и что они исследовали питание в апреле и июне, когда «нереста промысловых рыб не было или он был слаб» (с. 198). Шаткость первого аргумента очевидна, поскольку другим авторам (Абдель-Малек, 1963; Мухомедияров, 1966; Semler, 1971, и др.) удавалось обнаружить икру самих колюшек в желудках колюшек, когда она там действительно присутствовала. Второй аргумент авторов также вызывает сомнение, так как нерест промысловой рыбы, например тарани, происходит в мае (Лебедев и др., 1969), а судака (который, как известно, охраняет свою икру и молодь) также в мае—июне при температуре воды 18—20 °С (Лебедев и др., 1969). Троицкий и Фролов (1949, с. 192) указывают, что такая температура в лиманах бывает в мае.
Чтобы усилить свои аргументы о вреде колюшки для нереста промысловых рыб, авторы ссылаются на неопубликованные экспериментальные данные П. М. Коновалова (Троицкий, Фролов, 1949, с. 198), который помещал оплодотворенную икру тарани в «особую ловушку, которая вынималась через некоторое время из воды, и анализировались желудки пойманной рыбы». Оказалось, что у некоторых пойманных в ловушку колюшек в желудках была икра тарани. Эти данные суммированы в табл. 13. Если проанализировать табл. 13, то окажется, что всего было поймано 330 колюшек и только у 18 колюшек (5.4 %) в желудках оказалась икра тарани. Кроме того, авторы вынуждены отметить, что в аквариумах «при одновременной даче колюшкам живого планктона и икры колюшки явно предпочитали планктон» (с. 198). После этого выглядит несколько странным утверждение авторов, данное на следующей же строчке: «Итак, не подлежит сомнению поедание колюшкой как икры, так и личинок промысловых рыб». Очевидно, поняв явную натяжку этого утверждения, авторы далее продолжают: «но даже и вне зависимости от этого, колюшка должна быть признана вредной рыбой в силу значительного поглощения тех организмов, которыми питается молодь промысловых рыб». Авторы при всем том не анализировали индексы пищевого сходства питания колюшки и других промысловых рыб. Такой анализ будет дан ниже, а сейчас рассмотрим питание колюшки икрой других рыб на Балтике.
Так, Костричкина (1970) проанализировала питание морской колюшки Рижского залива Балтийского моря (всего 400 экз.). В пищевом спектре найдено 32 компонента, большинство из которых принадлежит к различным группам ракообразных. В небольшом количестве в желудках колюшки обнаружены личинки бычков — 5%, личинки песчанки 2, личинки салаки 0.4 % (табл. 1, с. 342). Автор специально исследовал питание колюшки на нерестилищах салаки с мая по октябрь в районе Салацгривы (салака Clupea harengus membras нерестится в Рижском заливе 2 раза: конец мая — начало июня и сентябрь — начало октября, нерест в прибрежной зоне на каменистых участках на глубине 3—12 м, икра донная) (Лебедев и др., 1969). В течение всего периода исследования, отмечает Костричкина (1970), основу пищи колюшки этого района составляли Copepoda, в летнее время значительную роль играли воздушные насекомые, личинки и икра салаки большое значение имели лишь в июле и октябре (50 и 80 % встречаемости). В свою очередь колюшка сама служит пищей крупной салаке (Берг, 1949). В остальные месяцы икра и личинки салаки в пище колюшки отсутствовали (всего исследовано 150 экз. колюшек).
Самохвалова (1973) исследовала выедание трехиглой колюшкой икры щуки в Куршском заливе Балтийского моря. Автор отмечает, что в маловодные годы из-за недостатка нерестилищ плотность икры щуки на отдельных участках высокая (300—500 икринок на 1 м2) и здесь концентрируется большое количество колюшки. При сочетании маловодности с неблагоприятным температурным режимом темп роста молоди щуки замедлен, и она в значительном количестве выедается колюшкой. В общем за весь период инкубации колюшка выедает 41 % живой икры; колюшка также потребляет и погибшую икру щуки. Для сохранения запасов щуки, приходит к выводу автор, необходимо интенсифицировать промысел колюшки. Это единственная работа, где строго количественно удалось оценить выедание колюшкой икры промысловой рыбы.
Остальные работы по питанию колюшки Балтийского моря указывают, что основу ее питания в Куршском заливе составляют хирономиды и зоопланктон. Так, в Каунасском водохранилище основу питания колюшки составляют личинки хирономид, воздушные насекомые, гаммариды, кладоцера и копеподы, сходный спектр имеет там и Pungitius pungitius (Бубинас, 1979). В рыбоводных прудах Латвийской СССР, по данным Пинского (1967), Pungitius pungitius в основном питается личинками хирономид и зоопланктоном. В оз. Дальнем (Камчатка), по данным Марковцева (1972), пищевой спектр Gasterosteus aculeatus весьма широк — насекомые, ракообразные, моллюски и в период нереста — собственная икра. В Якутии Pungitius pungitius питается в основном личинками хирономид, зоопланктоном (Кириллов, Тетерин, 1979). Выедание колюшками икры и личинок других видов рыб в этих работах не отмечено.
Таким образом, анализ имеющихся в нашем распоряжении 13 отечественных работ, где качественно и количественно оценен пищевой спектр колюшек, на достаточно большом материале показывает, что только в 2 случаях (на нерестилищах салаки в Рижском заливе и нерестилищах щуки в Куршском заливе Балтийского моря) колюшка в значительной мере выедает икру промысловых рыб, нанося прямой вред рыбному хозяйству. В остальных же районах СССР, где колюшка достигает большой численности, — в бассейнах Балтийского, Белого, Азовского морей, на Дальнем Востоке в питание колюшки или не входят или входят в крайне незначительном количестве икра и личинки промысловых рыб.
Анализ аналогичных работ по питанию зарубежных авторов подтверждает этот вывод. В ряде работ (Saunders, 1914; Blegwad, 1917; Markely, 1940; Hartley, 1948; Hynes, 1950; Greenbank, Nelson, 1959; Maitland, 1965; Hagen, 1967; Walkey, 1967; Rogers, 1968, 1973; Mann, Orr, 1969; Coad, Power, 1973d), качественно и количественно исследовавших пищевые спектры Gasterosteus aculeatus из стран западной Европы, США и Канады, не отмечено выедания колюшкой икры и личинок других рыб. Только в работе Хайнса (Hynes, 1950) отмечено незначительное (0.5—8.1 % в зависимости от времени года) присутствие икры и молоди рыб в желудках у колюшки из р. Биркет (Англия).
Анализ питания Pungitius pungitius в странах Западной Европы и Сев. Америки (Hynes, 1950; Coad, Power, 1973d; Cameron et al., 1973; Griswold, Smith, 1973) также показывает отсутствие икры и личинок рыб в питании колюшки.
Таким образом, подробный анализ питания колюшек в значительной степени снижает тяжесть предъявляемого колюшкам «обвинения» в том, что они уничтожают икру и молодь ценных промысловых рыб.
Рассмотрим второе «обвинение»: колюшки — пищевой конкурент промысловых рыб.
Действительно, широкий спектр, питания и обилие колюшек приводят к неизбежной конкуренции с другими видами рыб, имеющими хозяйственную ценность. Однако, как отмечал Никольский (1974, с. 275), эврифагия вырабатывается как приспособление к нестабильной кормовой базе. Таким образом, эврифагия подразумевает изменение спектра питания у одной и той же популяции в течение года. Имеется несколько работ, показывающих, как трехиглая колюшка, являющаяся эврифагом, уменьшает пищевую конкуренцию с лососевыми при возникновении напряженности в пищевых отношениях. Так, молодь нерки и Gasterosteus в озерах бассейна р. Вуд (Аляска) имеют сходный пищевой спектр и в пелагиали, и в литорали (Rogers, 1968). На литорали оба вида питаются мелкими ракообразными (кладоцера, копепода), личинками насекомых — хирономид. Но между видами есть различия в относительном выедании разных компонентов пищевого спектра: колюшки больше добывают корм со дна, а нерка — с поверхности воды; иными словами, колюшки едят больше личинок хирономид, моллюсков, водорослей и собственную икру, тогда как молодь нерки — двукрылых и коллембол, падающих в воду. В пелагиали оба вида потребляют зоопланктон, но вместе с тем нерка больше потребляет кладоцер (Daftiia, Bosmina), а колюшка — копепод. В целом пищевой спектр нерки более разнообразен, чем у колюшки, и нерка питается в 2.5 раза интенсивнее, чем колюшка. В оз. Алекнагик Роджерс (Rogers, 1973) не нашел корреляции между количеством молоди нерки в данном году и численностью колюшки в том же или в следующем году. Это свидетельствует в пользу того, что численность молоди нерки не связана с численностью колюшки. Средняя длина тела колюшек годовалого возраста отрицательно коррелирована с обилием молоди нерки в предыдущем году, поэтому очевидно, что темп роста колюшек на первом году жизни был угнетен, когда имело место обилие молоди нерки, что связано, видимо, с пищевой конкуренцией между ними. Работы Роджерса (Rogers, 1968, 1973) показывают, что при напряженных пищевых отношениях между неркой и колюшкой от конкуренции скорее «страдает» колюшка, чем нерка. В озере Дальнем (Камчатка), также обитают колюшка и нерка. Крохин (1970) отмечает, что падение численности нерки следует за увеличением численности колюшки, но затем численность обоих видов уменьшается, озеро становится менее «кормным» из-за уменьшения количества биогенов (фосфатов и др.), так как меньше трупов нерки разлагается. Марковцев (1972) описал отношения молоди нерки и колюшки в оз. Дальнем (в этом озере есть еще голец Salvelinus alpinus, который является хищником колюшки и нерки). Здесь пищевой спектр колюшки разнообразнее, чем нерки (картина обратная, чем в оз. Алекгнагик на Аляске: молодь нерки планктофаг в пелагиали, а колюшка планктофаг и факультативный бентофаг на литорали). Более подробно спектры питания обоих видов рассмотрены в разделе 2.3. Марковцев (1972) вычислил коэффициенты степени пищевого сходства между ними и установил, что в зимние месяцы они нарастают, достигая максимума в апреле (90 %), падая в августе (до 32 %). Сходство между молодью нерки и колюшкой в пелагиали значительно, а на литорали сходство между ними незначительно 0—12 %. Автор считает, что между обоими видами в годы высокой численности должны сложиться довольно напряженные конкурентные пищевые взаимоотношения, правда только в пелагиали. Однако силы этой конкуренции он не смог определить из-за отсутствия количественных данных по биомассе кормовых организмов и численности рыб. Никольский (1974) отмечал, что в ряде озер Камчатки голец питается молодью нерки и колюшкой. Снижение запасов колюшки приводит к большему выеданию нерки (при этом колюшка — пищевой конкурент нерки). Так что взаимоотношения колюшки с лососевыми не так просты, как казалось раньше, и вопрос «польза—вред» колюшки трудно решить однозначно. Вообще-то сам факт сосуществования колюшек Gasterosteus aculeatus и Pungitius pungitius с лососевыми родов Salmo, Salvelinus, Oncorhynchus в водоемах арктических широт в Европе, Азии и Сев. Америки говорит о том, что эти рыбы «притерлись» друг к другу в процессе эволюции. Лососи питаются колюшкой (см. разделы 2.4 и 4.5.4), а колюшка конкурирует в питании с молодью лососевых, и такое равновесие поддерживается, видимо, долгое время (возможно, с миоцена).
Ярким примером такого равновесия является ихтиоценоз оз. Вапато (штат Вашингтон, Тихоокеанское побережье США). В 1957 г. это озеро площадью 87 гектаров (530х208 м) было протравлено химикатом ротеноном и затем в 1965 г. заселено 51000 экз. личинок Salmo gairdneri (Hagen, Gilbertson, 1973b); в озеро случайно попала трехиглая колюшка из соседнего оз. Шелан и размножилась. Лосось перешел на питание колюшкой: например, зимой 80 % лососей питались колюшкой, а летом—весной переходили на другой корм, и только 10—12 % лососей имели в желудках колюшку. Несмотря на сильное селективное выедание колюшки лососем, все эти годы популяция колюшки поддерживалась стабильной, и только вселение в озеро южного элемента — рыбы Ptychocheilius oregonesis в конце 70-х гг. привело (Kynard, 1978) к резкому уменьшению численности колюшки за последние годы.
В последние годы в водоемах нашей страны наблюдается нарушение равновесия в ихтиоценозах в пользу малоценных видов, в частности колюшек. Так, по данным Максимова и Долгова (1983), за последние несколько лет на восточном побережье Камчатки снизилась численность тихоокеанских лососей и сельдей и резко увеличилась численность Gasterosteus aculeatus. Начиная с 1979 г. по всему восточному побережью Камчатки весной наблюдается массовый заход Gasterosteus aculeatus из моря в реки. По расчетам авторов, лишь в одну реку Камчатку заходило ежегодно около 500 млн. штук колюшки при средней плотности 1000 экз/м2 и продолжительности хода 40 дней. Биомассу всей этой колюшки авторы оценивают в 1.5 тыс. т ежегодно, но она практически не используется промыслом — 340 т в год. Поднимаясь по р. Камчатке, огромная масса колюшки заполняет почти все пойменные речки, ручьи и озера на расстоянии до 200 км от устья. Интенсивно питаясь планктоном и бентосом, колюшка, видимо, конкурирует с неркой, кижучем и чавычей, которые несколько лет проводят в пресной воде. Вместе с тем ею интенсивно питаются голец, кунджа, микижа, хариус, а также крачки, чайки, гагары и даже медведи. Интересно, что за это время увеличился темп роста гольцов, кунджи и микижи, что, по мнению Максимова и Долгова (1983), связано с вспышкой численности колюшки. Авторы полагают, что вспышка численности колюшки может неблагоприятно отразиться на численности других промысловых рыб (сельди в море, лососевых и карася в пресных водоемах).
За последние годы отмечается вспышка численности колюшки и на Балтике. Так, Прокопенко (1983) сообщил, что в Финском заливе за последние 5 лет численность ее увеличилась настолько, что улов ее составляет 48.7 % от вылова рыбы прибрежным промыслом и 13.7 % от общего вылова рыбы в восточной части Финского залива. Вспышка численности колюшки в Финском заливе наблюдается одновременно с уменьшением численности основных промыслов рыбы, запасы которых находятся в напряженном состоянии. Например, увеличение уловов колюшки совпало с резким уменьшением уловов ерша, сократившихся с 1976 по 1982 г. в 7 раз. Прокопенко (1983) объясняет это снижением уровня воспроизводства ерша в связи с загрязнением вод Невской губы. В то же время уловы колюшки у южного, наиболее загрязненного побережья самые высокие. Автор полагает (и видимо справедливо, как это будет видно из данных, приведенных в этом разделе ниже, — В. З.), что колюшка, более устойчивая к загрязнению, с успехом использует освободившиеся территории и становится основным обитателем мелководной зоны Финского залива.
В последние годы увеличилась численность колюшки и в Рижском заливе. Так, Гомелюк (1980) сообщает, что только рыбколхоз «Узвара» в предустьевых пространствах рек Лиелупе и Даугавы за последние годы вылавливает от 2 до 4.5 тыс. т колюшки в год. Автор отмечает, что строительство старых и расширение новых портов, углубление фарватеров, рытье мелиоративных канав, намывка дамб — все это увеличивает площади мелководий, которые являются потенциальными нерестилищами, трехиглой колюшки. Поскольку колюшка устойчива к загрязнению и низкому содержанию кислорода, она находит на мелководьях оптимальные условия для нереста. Обильно развивающийся в прогреваемых солнцем слоях воды планктон создает хорошую кормовую базу для молоди колюшки (Гомелюк, 1980). Смирнов (1951) отмечал, что колюшка способна размножиться (и икра ее успешно развивается) даже «в ручьях, сильно загрязненных городскими отбросами».
Увеличение запасов трехиглой колюшки в Куршском заливе отмечает Носкова (1975): по данным опытного лова в уловах колюшка занимает 46 % по биомассе (кроме нее в уловах были снеток, ерш, уклея, окунь и др. рыбы). В Куршском заливе колюшка только в июне потребляет 150 т. зоопланктона. По данным Костричкиной (1970), в Рижском заливе, по расчетам годовых рационом, колюшка съедает за 1 год примерно 200 тыс. т планктона и нектобентоса. По расчетам Крохина (1970), колюшка Gasterosteus aculeatus оз. Дальнего площадью 136 га (Камчатка) в пик своей численности потребляет 1/3 от общего потребления пелагических ракообразных рыбами-планктофагами, а во время депрессии своей численности 5—10 %. Численность колюшки по этим расчетам колеблется от 1 до 6 млн. особей, или в весовом выражении 2—12 т; численность же молоди красной в весовом выражении колеблется от 15 до 30 т. Крохин (1970) оценил, что для продуцирования 1 г сырой массы колюшки ей необходимо съесть примерно 15 г зоопланктона. Вуттон (Wootton, 1976) рассчитал, что для пресноводных водоемов южной Англии, где плотность колюшек в среднем 3—15 особей на 1 м2, колюшки съедают за год 10—100 г корма с 1 м2 площади за год.
Все эти данные показывают, что роль колюшки в биоценозах морских, солоноватых и пресных водоемов как потребителя пищи весьма велика, что колюшка действительно конкурирует в питании с другими рыбами, хотя и использует свои механизмы эврифага, чтобы уменьшить эту конкуренцию. Однако в связи с интенсивным промыслом хозяйственно ценных видов рыб и уменьшением их численности в последние годы колюшка резко увеличила свою численность, заполняя освободившуюся пищевую нишу. Если анализировать в целом факторы, способствующие увеличению численности колюшковых, то можно выделить следующие основные.
1. Освобождение пищевых ниш из-за перелова промысловых рыб.
2. Короткоцикловость колюшек, связанная с ранней половозрелостью, пополнением, превышающим остаток, и всем комплексом приспособлений саморегуляции численности короткоциклового вида при повышении обеспеченности пищи.
3. Активная забота о потомстве.
4. Эврибионтность: эврифагия, устойчивость к загрязнениям и т. д..
5. Интенсификация гидротехнических и ирригационных работ в наших водоемах приводит к расширению площади нерестилищ колюшек, проникновению их по сети канав в выростные и нагульные пруды рыбоводных хозяйств (Гомелюк, 1978), проникновению из бассейна одной реки в другую, например проникновению Pungitius platygaster из Нуры в бассейн Оби (Зюганов, 19846) и т. д. Создание водохранилищ, например Каунасского (Бубинас, 1979), способствует проникновению в них и вспышке численности колюшек.
6. Эвригалинность. Вследствие зарегулирования стока рек (например, Дона и Кубани) в Азовское море повышается соленость солоноватых водоемов — отсюда сокращение нерестилищ других видов рыб и проникновение на них колюшек.
Гомелюк (1980) отмечал, что особую угрозу представляют колюшки для выращивания рыб в садках на прибрежных участках моря. Кроме того, проникая в рыбоводные хозяйства, колюшки поедают корм и создают условия для инвазии. Уничтожить проникшую в рыбоводные пруды колюшку уже невозможно, даже заливая в водоем аммиачную воду (Гомелюк, 1978). Пинский (1967) изучал пищевые взаимоотношения Pungitius pungitius с молодью лосося Salmo salar в прудах рыбоводного завода «Томе» Латвийской ССР и нашел, что индексы пищевого сходства обоих видов колеблются в летние месяцы (июнь—сентябрь) от 38 до 72. Он пришел к выводу, что колюшка является серьезным конкурентом молоди лосося, поэтому лососевые пруды необходимо очищать от колюшки, а на водовпусках ставить фильтры.
Третье «обвинение», предъявляемое колюшкам, — разносчик паразитарных инфекций по ихтиоценозу. Паразитизм на колюшковых проанализирован в разделе 2.5. Действительно, колюшки являются промежуточными и окончательными хозяевами необычайно большого числа паразитов. Так, Gasterosteus aculeatus только в пределах СССР является хозяином 50 видов, относящихся к 6 типам. В целом же по всему ареалу Gasterosteus aculeatus известно 94 вида паразитов (Wootton, 1976). Pungitius pungitius из водоемов СССР является хозяином 49 видов (Определитель..., 1962). Банина и Исаков (1972) полагают, что такому большому набору паразитов колюшки способствуют следующие биологические особенности хозяина: малые размеры, отсутствие чешуи, гнездовое выращивание молоди, растянутость нереста, стадный образ жизни, обитание в биотопах, богатых растительностью и органикой. К этому можно добавить широкий спекр питания. Вместе с тем в каждой локальной популяции колюшки несут гораздо меньший набор паразитов. Так, в одном пруду графства Йоркшир (Англия) Gasterosteus aculeatus заражены 8 видами паразитов (Cheppel, 1969), и только небольшая часть рыб поражена всеми 8 видами, тогда как большинство особей поражено 2—3 видами паразитов. Самый широко распространенный эндопаразит трехиглой колюшки — Schistocephalus solidus (Cestoda, Ligulidae), но это специфический паразит, и даже близкий вид Pungitius pungitius устойчив, к инвазии им — экспериментальные попытки заразить Pungitius pungitius Schistocephalus solidus не привели к успеху (Огг, 1968). У девятииглой колюшки есть близкий вид паразита Schistocephalus pungitii, который достигает экстенсивности инвазии 17 %, как это произошло в оз. Маныч-Гудило, бассейн г. Маныч (Кафанов, Языкова, 1971). Остальные рыбы им не поражаются. Однако Gasterosteus aculeatus и Pungitius pungitius могут играть роль в эпидемии дифиллоботриоза, распространяя личинок широкого лентеца (Diffyllobotrium latum, Diffyllobotrium dentritieum) среди хищных рыб (щука, налим, окунь) в водоемах Карелии, причем экстенсивность инвазии достигает иногда 70 %. В то же время колюшки не имеют значения в непосредственном заражении человека, так как не используются непосредственно в пищу (Гофман-Кадошников и др., 1963).
Банина и Исаков (1972) отмечали, что колюшки, населяющие водоподающую систему рыбозаводов и пруды рыбхозов, могут быть прямым источником паразитарных заболеваний (эктопаразитическими простейшими) молоди рыб, выращиваемых в прудах.
Таким образом, колюшки могут играть определенную роль в распространении ряда видов паразитов по ихтиоценозу, как например дифиллоботриоза и эктопаразитических простейших, но не следует преувеличивать роль колюшек в этом процессе. Как отмечал Вуттон (Wootton, 1976), анализировавший паразитизм на колюшках, для многих экто- и эндопаразитов колюшка является видоспецифичным окончательным хозяином, так что эти виды паразитов не могут заражать другие виды рыб. Тем не менее такой паразит, как Argulus folliaceus (эктопаразит «карповая вошь»), может, видимо переходить с колюшек на других рыб в условиях плотной посадки, и проникновение колюшек в рыбоводные хозяйства действительно в таком случае крайне нежелательное явление, которое не следует допускать. Гомелюк (1978) в этой связи рекомендует ввести запрет на мелиоративные работы на рыбзаводах, так как по образующейся сети канав Pungitius pungitius, например в Латвии, легко проникает в выростные и нагульные пруды. Пинский (1967) считает, что на водовпусках рыбзаводов надо ставить фильтры, которые, на мой взгляд, вряд ли обезопасят рыбзаводы от проникновения молоди колюшки.
Полезный эффект колюшек. Вуттон (Wootton, 1976, с. 99), анализировавший экономическое значение трехиглой колюшки, пришел к выводу, что «в общем балансе колюшки приносят больше пользы, чем вреда». Он также отмечал, что хотя и полагают, что «колюшки являются важным хищником икры молоди рыб или, экономически ценных или представляющих интерес для спортивного рыболовства... но детальный анализ спектров питания Gasterosteus aculeatus обнаруживает, что она ест преимущественно свою икру и не является существенным хищником икры и молоди таких рыб, как семга и форель» (с. 99), и далее «полезен эффект симпатричного обитания колюшки с лососем и форелью, так как они питаются колюшкой, которая является важной составной частью их диеты» (с. 100).
В отечественной литературе с легкой руки Сабанеева (1982) утвердилось мнение, что колюшка недоступна для других рыб как объект питания: «сами колюшки, особенно трехиглая, вооруженная более твердыми, длинными и твердыми колючками, крайне редко достаются в добычу щукам, окуням и прочим хищникам» (Сабанеев, 1982, с. 99). В разделе 2.7.4. уже подчеркивалось, что колючки и наружный скелет колюшковых является не абсолютной, а лишь относительной защитой от хищных рыб. Действительно, в эксперименте установлено (Hoogland et al., 1957), что щука и окунь при наличии альтернативных «бесколючковых» жертв — гольяна, плотвы, красноперки и карася действительно избегали трехиглую колюшку (и в меньшей степени девятииглую), но в эксперименте использовались хищные рыбы размером 15—25 см. Однако Фрост (Frost, 1954) отмечал, что в оз. Виндермере щуки длиной более 40 см выедали колюшек избирательнее, чем карповых рыб, хотя тех в озере было больше, чем колюшек. В озерах Ирландии даже щуки длиной 25—40 см выедали колюшек (Healy, 1956), а в озерах Западной Англии Salmo trutta (кумжа) длиной 30 см и более выедали трехиглую колюшку (Hunt, Jones, 1972). Хаген и Гильбертсон (Hagen, Gilbertson, 1973b) сообщили, что в оз. Вапато (США) лосось Salmo gairdneri сильно выедал колюшку, причем в зимнее время 80 % лососей имели в желудках колюшку размером 30—34 мм. К сожалению, авторы не приводят размеров лосося. В бассейне реки Камчатки во время вспышки численности колюшки микижа, арктический голец и кунджа размерами свыше 30 см полностью переходят на питание колюшкой во время ее хода (К. А. Савваитова и В. А. Максимов, личн. сообщ.).
Таким образом, колючки мало помогают колюшке в случае, когда хищник имеет крупные размеры тела и соответственно зевка. Кроме того, хищники интенсивно потребляют молодь колюшки (McPhaill, 1969; Hagen, Gilbertson, 1972). По данным зарубежных авторов, проанализированных в разделе 2.4, всего около 16 видов рыб в Европе питаются колюшкой. Это лососи рода Salmo (Salmo salar, Salmo trutta trutta, Salmo trutta farlo, Salmo gairdneri), голец (Salvelinus alpinus), щука (Esox lucius), окунь (Perca fluviatilus, Shizostedion lucioperca), каменный окунь (Morane labraes), голавль (Leuciscus cephalus), угорь (Anguilla anguilla), треска (Gadus morhua), сайда (Gadus virens), сарган (Belone belone), сельдь (Clupea harengus) (Gross, 1978a). В Северной Америке, кроме того, колюшкой питаются Salvelinus fontinalis, американские щуки рода Esox, Ptychocheilius oregonensis, окунь Perca flavescens, Lepomis gybbosus, Novumbra hubbsi, Dallia pectoralis (Hagen, Gilbertson, 1972; Kynard, 1978). Кроме того, колюшковыми питаются около 10 видов рыбоядных птиц (цапли, чайки, нырковые утки) (см. раздел 2.4). В водоемах Дальнего Востока СССР Gasterosteus aculeatus и Pungitius pungitius потребляют гольцы рода Salvelinus, микижа, хариус, окунь, щука (Карпов и др., 1969; Кохменко, 1972; Гриценко, Чуриков, 1977; Максимов, Долгов, 1983). Никольский (1971) отмечал, что в водоемах бассейна Ледовитого океана Pungitius pungitius в большом количестве служит пищей гольцов рода Salvelinus. Кириллов (1972, с. 285) указывает, что «значение pungitius как объекта питания многих рыб огромно: в бассейне верхнего и среднего течения Колымы она встречается в желудках щуки и налима, а в озерах тундры и лесотундры бассейна Колымы и Лены колюшка служит постоянным объектом питания пеляди». Кириллов и Тетерин (1979), например; отмечали, что в 1977 г. вскрытие желудков налимов показало в среднем наличие 50 экз. девятииглой колюшки на 1 налима. Фортунатова (1959) сообщила, что в дельте Волги весной и летом щука, окунь, судак и сом питаются малой южной колюшкой Pungitius platygaster, и по встречаемости она составляет у них 10—15 %.
Алтухов с соавт. (1958, с. 113) отмечали, что в Белом море в июле после окончания нереста Gasterosteus aculeatus молодью колюшки «питаются почти все рыбы: треска, бычки, сельдь, бельдюга, маслюк и другие». Троицкий и Фролов (1949, с. 200) отмечали питание молодью трехиглой колюшки таких рыб Азовского моря, как судак, бычок (Gobius sirman), окунь и красноперка. Гомелюк (1978) отмечал, что в лиманах Черного моря колюшкой во время ее нерестового хода питаются керчак и бычок-кругляк.
Таким образом, имеется много данных, что молодью колюшек питаются многие виды хищных рыб в разных районах, а взрослыми колюшками питаются крупные хищные рыбы, в частности лососевые и сиговые. Так что колюшковые имеют определенное рыбохозяйственное значение как объект питания хозяйственно ценных рыб. Тем не менее в литературе имеется мало работ, на основании которых можно было бы количественно оценить важность колюшек как компонента пищевого спектра промысловых рыб.
Непосредственное практическое значение. Вуттон (Wootton, 1976) отмечал, что в странах бассейнов Балтийского и Северного морей, где велика численность проходной формы Gasterosteus aculeatus, колюшек варят для вытопки жира, а осадок используют на удобрение полей, их также используют как корм для кур и уток, а на севере для корма ездовых собак. Кириллов (1972) сообщил, что в Якутии в Среднеколымском районе отдельные хозяйства вылавливают Pungitius pungitius до 3 т ежегодно и используют в качестве приманки на горностая. Кириллов и Тетерин (1979) обращали внимание на то, что в Якутии запасы девятииглой колюшки не затронуты практически промыслом и рекомендовали использовать их на рыбную муку для подкормки крупного рогатого скота, птиц на птицефабриках и в качестве привады пушных зверей: Кроме того, в рационе звероводческих ферм колюшка должна вытеснить дорогостоящих сиговых рыб, что повысит рентабельность хозяйств и высвободит для населения значительное количество деликатесной рыбы.
Европейцева (1946) привела интересные данные по использованию жира Gasterosteus aculeatus в Ленинграде в военные годы в качестве нового медицинского препарата для лечения ран и ожогов, поскольку жир колюшки в отличие от трескового рыбьего жира содержит каротин, ускоряющий течение регенерационных процессов в ранах, и много витамина «А» (Гербильский, Европейцева, 1945). Европейцева (1946) проанализировала использование колюшки для прудового и сельского хозяйства в прибалтийских странах. Она отмечает, что раньше жир из колюшки добывался примитивным способом, путем выварки рыб в металлических котлах, снятия поверхностного слоя жира и прессования вываренных остатков. Но начиная с 1980 г. завод в Альт-Пиллау (Восточная Пруссия), по данным Гейнемана (1896) и Кайзера (1900) (цит. по: Европейцева, 1946), применил экстракционный способ добывания жира, при котором рыба подвергается быстрому высушиванию, а из высушенной массы жир извлекается растворителями и химически очищается. Употреблялся он немцами для мыловарения и жирования кож. Сухая обезжиренная масса размалывалась на кормовую муку, которая содержит 10 % азота, 9 % фосфорно-кислой извести и около 62 % протеинов. Мука применялась в прудовом хозяйстве для корма карпов и форели и в животноводстве для корма скота. Она имеет преимущества перед мукой из других рыб вследствие отсутствия в ней специфического рыбного привкуса, передающегося мясу и молоку. Для получения одной единицы массы жира требуется в среднем 10 единиц массы колюшки. Мухомедияров (1966) отмечал, что в военные годы на Белом море жир колюшки также использовался для заживления ран, а отходы после вытопки шли на корм скоту и птице, что увеличивало яйценоскость кур.
Таким образом, подводя итоги хозяйственного использования колюшки, можно заключить, что колюшка может давать медицинский высококачественный жир (богатый витамином «А», каротиноидами, быстро заживляющий раны), жир также может иметь техническое применение в мыловаренной, кожевенной, химической (для производства линолеума, — Дмитриев, 1953) промышленности. Отходы после вытопки жира используются на изготовление высокосортной кормовой муки, идущей на корм рыбе в прудовых хозяйствах, скоту и птице. Высокое содержание легко усвояемого кальция, в виде органических соединений, приводит к повышению яйценоскости кур и молока у скота (лишенного при этом рыбьего запаха). Свежая или консервированная серной кислотой с последующей расконсервировкой (Мухомедияров, 1966) колюшка может быть использована на зверофермах как один из компонентов корма. В сушеном и раздробленном виде колюшка может скармливаться в птицеводческих хозяйствах. Выгода приготовления кормовой пасты для звероферм пушных зверей из колюшек, а не сиговых рыб очевидна. Кроме того, отходы после вытопки из колюшки жира могут использоваться на удобрения.
Промысел.
Общий вылов колюшки трудно оценить по нескольким причинам: 1) потому что данные в литературе по вылову появляются спорадически по разным районам и годам; 2) из-за резких колебаний численности колюшки как короткоцикловой рыбы; 3) из-за того, что часто колюшки вылавливаются попутно в качестве прилова при промысле других рыб.
По данным Троицкого и Фролова (1949), в Кубанских лиманах Азовского моря Азчеррыбводом в 1940 г. выловлено 14.1 т колюшки и в 1941 — 23.4 т. Колюшек ловили в гирлах во время ее нерестовой миграции хамсоросовыми каравами и вентерями, а также мальковой волокушей. В послевоенные годы запас колюшек в Азовском море снизился, и в 1945—1947 гг. вылавливалось не более 0.9 т, но с 1948 г. количество колюшки в лиманах заметно увеличилось. Авторы призывают увеличить вылов колюшки, поскольку ее запасы оказываются мало затронутыми промыслом, к сожалению, некоторые рыбзаводы отказывали в приемке колюшки, и рыбаки выбрасывали живую рыбу обратно в море.
По данным Мухомедиярова (1966), на Белом море (Кандалакшский залив) в 1950—1954 гг. ежегодно добывали от 13.5 до 48.5 т колюшки, правда, в 1955—1956 гг. вылов сократился до 2.5—6.5 т вследствие лимитирования, а затем полного прекращения ее приема на рыбоперерабатывающие пункты. Колюшка попадалась как прилов в ставные сельдяные невода, но из-за большой ячеи в большинстве случаев уходила. По расчетам Мухомедиярова (1966), запасы колюшки в Белом море так велики, что даже в одном Лоухском р-не с береговой линией в 100 км 5—6 бригад, состоящих в среднем из 3 рыбаков, могут в один сезон ловить 0,5—0.6 тыс. т колюшки. Мухомедияров (1966) рекомендовал использовать такие орудия лова: закидной невод длиной 40 м, ставной невод или ловушку типа завески, мережи, котец или ловушку этого типа для установки в узких проходах или в устьях речек.
До 70-х гг. на Белом море был пик численности колюшки, а с 1972—1973 г. началось падение численности, и в 1984 г. морскую колюшку крайне редко можно было увидеть, например в Кандалакшском районе. Выше уже отмечалось, что на Камчатке сейчас наблюдается пик численности проходной формы колюшки, но Усть-Камчатский рыбкомбинат слабо использует ее промыслом (Максимов, Долгов, 1983).
Намного больше колюшку промышляют на Балтике. Гомелюк (1980) сообщил, что в водоемах Латвийской ССР она составляет основную долю вылова туводных рыб. Только рыбколхоз «Узвара», промышляющий колюшку ставными ловушками и тралами в приустьевых пространствах рек Лиелупе и Даугавы, в последние годы вылавливает от 2 до 4.5 тыс. т колюшки ежегодно.
Прокопенко (1983) сообщил, что в восточной части Финского залива из 2 тыс. т общего вылова рыбы в 1981 г. доля колюшки составила 13.7 %, а от вылова прибрежным промыслом — 48.7 %, или 2.8 тыс. т. В общем вылове рыбы в восточой части Финского залива колюшка занимает сейчас первое место (промысловая статистика не разделяет Pungitius pungitius и Gasterosteus aculeatus), но автор отмечает, что доля девятииглой колюшки в уловах очень незначительна. Уловы колюшки подвержены сильным колебаниям: годовая добыча в 1976—1982 гг. изменялась в 13 раз (табл. 28). В Финском заливе Балтийского моря колюшку ловят мелкочастиковыми заколами и донными тралами.
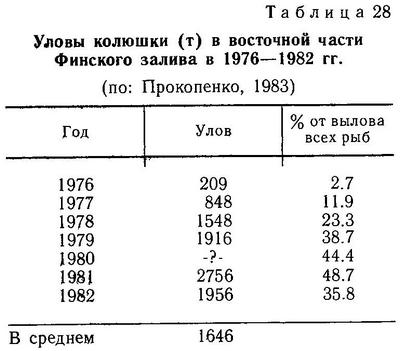
Борисов (1952) отмечал, что колюшка лучше других рыб Балтийского моря положительно реагирует на свет. Колюшек ловили жаберной сетью с подводным электрическим освещением. Во время экспериментального лова в Балтийском море у о. Найсааре скопления колюшки в освещенной зоне были настолько велики, что электрическая лампа 500 Вт на глубине 5 м становилась плохо видимой. Это указывает на большие запасы колюшки в Финском и Рижском заливах (Борисов, 1952).
В Куршском заливе Балтийского моря запасы колюшки, по данным Носковой (1975), таковы, что ежегодно можно отлавливать не менее 0.5 тыс. т колюшки.
Все авторы, описывающие промысел колюшки, настаивают на интенсификации промысла.
Способы регулирования численности колюшки.
Традиционным способом уменьшения численности колюшки является промысел, но как видно из предыдущего материала, даже интенсивный промысел не может подорвать запасов короткоцикловой рыбы, характеризующейся почти всеми приспособлениями саморегуляции численности при повышении обеспеченности пищей (Никольский, 1974, с. 295). Кроме того, колюшки характеризуются ранней половозрелостью, пополнением, превышающим остаток, высокой воспроизводительной способностью и тем, что при любом промысловом воздействии невозможно достичь коэффициента естественной смертности. Однако вылов колюшки в целом применяется слабо и в наши дни, несмотря на то что колюшка передвигается значительными скоплениями часто у поверхности воды и вблизи берегов и поэтому ее легко вылавливать при осенних и весенних миграциях.
Троицкий и Фролов (1949) в осторожной форме предлагали воздействовать на количество колюшки в лиманах, уничтожая растительность, которой колюшка строит свои гнезда. Этот способ борьбы с ней уже подвергался критике Смирновым (1951), который подчеркивал, что растительность не является безусловно необходимой для постройки гнезда. В разделе 2.8 приводились данные, подтверждающие, что колюшка может строить гнезда из песка и других субстратов, так что действительно этот метод борьбы ничего не даст. Необходимо добавить, что и Pungitius pungitius, оказывается, может строить гнезда не на растениях, а на грунте, так что, если бы в прудовых хозяйствах стали бороться с ней таким образом, эта мера ничего бы не дала. Кроме того, с технической точки зрения тоже трудно представить себе полное уничтожение растительности в водоеме (лиманах, прудах, озерах и т. п.), поскольку сам рельеф ложа водоема может затруднить выкос травы косилками.
Гомелюк (1978) отмечал, что гидротехнические работы — углубление фарватера, рытье мелиоративных канав, намывка дамб приводят к увеличению нерестовых площадей. Появление в устье реки участка глубиной 0.5—1.0 м означает новое нерестилище для колюшки, а обилие биогенных веществ, прогрев воды автоматически обеспечивают взрослым и молоди колюшек хорошую кормовую базу. Для снижения численности колюшек Гомелюк (1978) рекомендует ликвидировать мелководья в устьях рек и запретить сброс земснарядами, углубляющими фарватер, грунта, при котором эти мелководья образуются. Вблизи рыбзаводов автор рекомендует запретить мелиоративные работы, так как по образующейся сети канав в рыбхозы проникает Pungitius pungitius. Помимо запретов автор рекомендует специально создавать искусственные мелководья, перегораживая малые речкц и ручьи плотинами. Этим самым достигается концентрация в море и районе стока нерестовых мигрантов колюшки (поскольку они обладают выраженном положительным реотаксисом и отрицательным галинотаксисом), которых можно облавливать неводами или с помощью рыбонасоса. Кроме того, Гомелюк (1978) предлагает по другую сторону плотины создать искусственные нерестилища, отвлекающие стаи колюшек от дальнейшего продвижения в глубь реки, и полученную на них молодь использовать как корм для лосося и форели. Несомненно, этот метод регуляции численности связан с большими экономическими затратами; поскольку придется не только строить плотины и создавать мелководья, но и закреплять за этими сооружениями людей, чтобы они поддерживали эти нерестилища в надлежащем виде (не допускали их заиливания, очищали от коряг, камней и т. д.). Кроме того, мероприятия эти придется продумать так, чтобы не мешать нерестовым миграциям других промысловых рыб. Несомненно, эти рекомендации вызывают интерес, и нужно их экономическое обоснование.
Кроме того, при зарыблении прудов рыбопосадочным материалом необходимо тщательно следить за его чистотой. Так, в Московской обл., где никогда раньше не было колюшки, в 70-х гг. Pungitius pungitius вдруг обнаружилась в р. Сходня. Колюшка здесь быстро достигла высокой численности и стала распространяться по бассейну реки Москвы, спускаясь вниз по течению (Зюганов, 19846; Зюганов, Гомелюк, 1985). По сообщению местных жителей, впервые колюшка появилась вблизи форелевого хозяйства «Сходня». Возможно, попала она туда случайно, вместе с рыбопосадочным материалом (лососевыми), недостаточно тщательно отобранным.
Нужно сказать, что для основания новой популяции колюшки в новом для нее водоеме, где раньше ее не было, достаточно иногда всего пары разнополых особей. Так, судя по опытам, проведенным мной в бассейне Белого моря, интродукция 9 пар особей Gasterosteus aculeatus в 9 карьерах, площадь каждого из которых в среднем 10х30 м (300 м2 и глубина 2—3 м), привела к успеху в 4 случаях (Зюганов, 1983), когда через несколько лет после интродукции в эти водоемы там наблюдались тысячи особей в каждом. Интродукция 10—20 основателей Gasterosteus aculeatus и Pungitius pungitius в карьеры, площадью в среднем 15х100 м (1500 м2) и глубиной 20 м, во всех случаях (около 20) приводила к образованию новых популяций. В этих водоемах, правда, не было других видов рыб, т. е. потенциальных хищников, но там часто бывает богатая фауна беспозвоночных животных (личинки стрекоз, жуки-плавунцы), являющихся потенциальными хищниками для молоди колюшки, а также есть лягушки, которые тоже могут выедать молодь колюшек, сами же водоемы часто посещаются рыбоядными птицами (утки, чайки, крачки), и, несмотря на это, внесение в водоем столь малого числа основателей всегда приводило к успеху интродукции. Поэтому нужно иметь в виду, что проникновение, скажем, в вырастные пруды рыбхозов даже нескольких экземпляров колюшек приведет к вспышке ее численности, а, насколько видно из данных Гомелюка (1978), уничтожить проникшую в пруды колюшку уже невозможно, даже заливая в водоем аммиачную воду.
Для того чтобы оценить применимость биологических мер борьбы с колюшкой в прудовых хозяйствах, необходимо обратиться к примерам, известным из природных популяций, когда по каким-либо причинам резко уменьшалась численность колюшки в естественных водоемах. Известно, что колюшка имеет большой набор паразитов, но они редко приводят к массовой смертности в большинстве популяций Gasterosteus aculeatus. Однако отмечены случаи, когда паразитарные инвазии вызывали почти 100 % смертность рыб в ряде водоемов. Так, Трелфалл (Threlfall, 1968) сообщил, что на о. Ньюфаундленд (Канада) популяция колюшек в Океан-пруде была поражена Schistocephalus solidus и Argulus canadiensis (эктопаразит, карповая вошь), а, кроме того, Crepidostomum farionis (дигенетический сосальщик в желчном пузыре) и Thersitina gasterostei (копеподы на жабрах). Автор полагает, что необычайно высокая смертность была вызвана стрессом из-за комбинации тяжелого поражения (высокой экстенсивности и интенсивности инвазии эндопаразитом) щелеголовом Schistocephalus solidus и эктопаразитом карповой вошью Argulus canadiensis.
В одном из шотландских, озер популяция Gasterosteus aculeatus была почти вся «выбита» из-за инвазии ихтиофтириуса (эктопаразит кожи), погибли все сеголетки и почти все рыбы более старых возрастов (Hopkins, 1959). В пруду Придди-пул (Англия) популяция Gasterosteus aculeatus почти исчезла из-за инвазии Schistocephalus solidus и Diplostomum gasterostei (эндопаразит глаз).
Из этих примеров видно, что часто именно комбинированное воздействие 2 или 3 паразитами приводило к сильной смертности колюшек. Естественно, было бы неразумно бороться с колюшкой в прудах, заражая ее карповой вошью, которая паразитирует и на других рыбах. Однако метод направленного поражения колюшек паразитами, только им свойственными, при полной гарантии того, что другие рыбы не поразятся ими, было бы, возможно, эффективной мерой по уменьшению численности Gasterosteus aculeatus и Pungitius pungitius в прудах. Из экспериментальных работ и полевых наблюдений известен сильно ингибирующий (сублетальный) эффект щелеголова Schistocephalus solidus на колюшку; зараженные колюшки плохо растут по массе и длине, большинство не созревает, наличие плероцеркоидов в полости тела вызывает тяжелую деформацию, они не выдерживают голода и погибают за 25—30 дней без еды, плавание их замедленно, и теряется маневренность, пораженные рыбы плавают у поверхности воды, где они доступны птицам (окончательным хозяевам Schistocephalus solidus, который не задерживается более суток в кишечнике рыбоядных птиц) и другим хищникам. Пораженные самцы не могут закончить постройку гнезд из-за ухудшения продуцирования клея почками, а пораженные самки не отвечают на ухаживания самца и разрушают гнезда при входе в него (Wootton, 1976). Действия других паразитов на обмен веществ или поведение колюшек менее известны. Вуттон (Wootton, 1976) отмечает, что цисты Glugea anomala (эндопаразит соединительной ткани) мешают плавательным и респираторным движениям, а присутствие Diplostomum gasterostei в глазах колюшек затрудняет их зрение, что способствует более легкому выеданию пораженных рыб птицами — окончательными хозяевами этих паразитов.
Кинард (Kynard, 1978, 1979b) сообщил, что в 1970 г. резко упала численность популяции Gasterosteus aculeatus в оз. Вапато (штат Вашингтон, США) из-за того, что самцы стали в массовом порядке покидать на произвол судьбы охраняемые ими гнезда, где в большинстве случаев икра погибала. Он считает, что это произошло из-за каких-то «внутренних» причин. В частности, Кинард приводит данные Смита и Хоара (Smith, Hoar, 1967), экспериментально показавших, что кастрация самца приводит через 2—3 дня к такому же явлению, поэтому явление в оз. Вапато можно объяснить, по его мнению, нарушением гормонального равновесия гонадных гормонов. Если бы удалось найти вещество-агент, вызывающее нарушение такого равновесия, то, обрабатывая этим веществом водоемы, мы могли бы легко управлять численностью колюшек.
В литературе нет указаний об акклиматизации колюшковых как кормовых объектов для питания хозяйственно ценных хищных рыб. Однако, с учетом того, что девятииглая колюшка в водоемах тундровой зоны является одним из немногих потребителей бентоса и зоопланктона и в то же время широко используется гольцами рода Salvelinus (McPhail, Lindsey, 1970; Никольский, 1971; Кохменко, 1972; Scott, Crossman, 1973; Максимов, Долгов, 1983) и сигами (пелядь) (Кириллов, 1972), можно обсудить возможность акклиматизации Pungitius pungitius в горные озера Кавказа и Средней Азии, Алтая, Саян как пищевого объекта для форелей, ленка, хариуса, тайменя и других хищных промысловых рыб. В принципе Pungitius pungitius — рыба равнинных водоемов, но в СССР известна популяция, Pungitius pungitius из горного оз. Большое Чебачье (Кокчетавской обл. Казахской ССР) на высоте 305 м над ур. м. Горные озера характеризуются слабой выраженностью или отсутствием укореняющейся водной растительности в литоральной зоне, поэтому ранее считалось, что фитофильно-гнездующая девятииглая колюшка не может нереститься на грунте. Однако недавно было показано (Зюганов, 1986), что самцы типичной равнинной популяции Pungitius pungitius способны к грунтогнездостроению (см. раздел 2.8.1) и популяции Pungitius pungitius успешно освоили водоемы-карьеры (в бассейне Белого моря) без зоны растений с каменистым ложем, холодной и чистой водой, т. е. прототипы горных озер. Акклиматизировать колюшку в горные озера имеет смысл там, где бедны ихтиоценозы и где имеется экологическая ниша планктофага и бентофага, каковой является Pungitius pungitius. Хищные же рыбы могут питаться молодью Pungitius pungitius и взрослыми девятииглыми колюшками, у которых защитный игольный аппарат развит намного слабее, чем у Gasterosteus aculeatus.
Прикладное значение колюшковых.
Дылько (1973) экспериментально изучил возможность использования рыб (карпа, карася, колюшки и вьюна) для биологической борьбы с кровососущими комарами в Белорусской ССР. Им установлено, что 1 колюшка (трехиглая) за сутки съедает до 50 личинок Aedes canians, до 200 личинок Aedes communis, до 90 особей Aedes flavescens, в среднем за сутки колюшка поедала 70 куколок Aedes communis и 30 куколок Aedes cantans. Выедаемость колюшкой личинок комаров в 5—10 раз превышала аналогичный показатель карпа и карася. Вьюн личинок и куколок комаров вообще не ел. Автор рекомендует применять карпа и карася как биологический метод борьбы с комарами, ничего не говоря в выводах о колюшке. Видимо, автор опасается рекомендовать колюшку для этого, поскольку считает, что вреда от нее будет больше. Обилие комаров летом в тундровой зоне СССР (где широко распространена Pungitius pungitius) показывает, что колюшка не подрывает там численности комаров. Во всяком случае, по данным Кириллова и Тетерина (1979), в Якутии колюшка питается в основном личинками хирономид, кладоцерами и копеподами. Поэтому применение колюшки как хищника личинок комаров не имеет больших перспектив.
Поскольку содержание колюшковых в аквариуме не вызывает затруднений, их можно использовать как экспериментальные организмы для изучения действия химического загрязнения воды на рыб. Джонсом (Jones, 1952) выполнен ряд исследований токсических эффектов солей тяжелых металлов на колюшек, обитающих в реках Западного Уэльса (Великобритания), загрязненных солями свинца, цинка, меди и других. Он установил, что самым токсичным оказался сульфат меди, колюшки выживали всего 160 ч при концентрации 0.03 ‰-1 сульфата меди, в близких концентрациях солей свинца и цинка колюшки выживали 204—336 ч, однако токсичность этих металлов была меньшей при добавлении в воду солей кальция, так что в водоемах с более жесткой водой эффект загрязнения ослаблен по сравнению с водоемами с мягкой водой. Им было определено, что соли свинца, алюминия, меди, ртути и серебра (в восходящем порядке) самые токсичные поллютанты рек индустриальных районов. Было установлено, что рыбы при помещении в воду с солями тяжелых металлов сначала увеличивают потребление кислорода, а затем его прекращают и умирают от удушья, так как жабры покрываются толстым слоем коагулировавшей слизи, предотвращающей диффузию кислорода в кровь.
Джонс (Jones, 1947, 1948) показал, что колюшки способны определять концентрацию нитратов меди, цинка, ртути и свинца. В частности, в эксперименте колюшки предпочитают (при наличии выбора) двигаться в воду, содержащую нитрат свинца концентрацией 0.04 N (хотя он токсичен), но избегают воду с нитратом свинца концентрацией от 0.004 до 0.00002 N (2 мг/л). Также колюшки могут избегать и предпочитать разные концентрации аммония, хотя он также токсичен. Джонс (Jones, 1948) определил, что колюшки предпочитают рН воды в пределах 5.6—11.4, а выше и ниже этих пределов — избегают. Минимальная концентрация кислорода, при которой живут Gasterosteus aculeatus, 0.5‰-1, a Pungitius 0.25. Девятииглая колюшка даже не задыхается при концентрации О2 0.3 мг/л (Jones, 1952). Поскольку биология колюшек хорошо известна, оценивать результаты опытов по загрязнению воды с их помощью легче, и они могут явиться очень удобным тестовым животным для оценки качества воды. Колюшек можно использовать как вид-индикатор загрязненности водоемов и другим методом. Так, Захаровым и Зюгановым (1980) было обосновано применение оценки асимметрии билатеральных признаков трехиглой колюшки как популяционной характеристики. Дело в том, что еще в 50-е гг. (Mather, 1953; Thoday, 1958) на дрозофиле была показана возможность использования флуктуирующей асимметрии, выражающейся в незначительных ненаправленных отклонениях от строгой билатеральной асимметрии как показателя гомеостаза развития. Раньше исследователи трехиглой колюшки просто отмечали процент (долю) асимметричных по боковым пластинам особей в популяциях (Hagen, 1973; Paepke, 1982, и др.). Но этот показатель мало о чем говорил. Захаров и Зюганов (1980) предложили иной метод подсчета асимметрии. Сначала для выяснения того, что исследуемая асимметрия не является направленной, вычисляются значения средней арифметической для коррелированных выборок (в качестве коррелированных выборок рассматриваются значения используемого на двух сторонах тела признака слева и справа 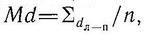 , где dл-п — разность между значениями признака на левой и правой сторонах тела у каждой особи). Далее, если значение достоверно не отличается от нуля (а так и было при анализе всех популяций), это свидетельствует об отсутствии какой бы то ни было направленности асимметрии анализируемого признака. В этом случае можно применять в качестве показателя асимметрии величину
, где dл-п — разность между значениями признака на левой и правой сторонах тела у каждой особи). Далее, если значение достоверно не отличается от нуля (а так и было при анализе всех популяций), это свидетельствует об отсутствии какой бы то ни было направленности асимметрии анализируемого признака. В этом случае можно применять в качестве показателя асимметрии величину 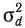
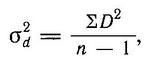
где 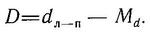 . Достоверность отличия между выборками определяется по значению F-критерия Фишера (Захаров, Зюганов, 1980). Оказалось, что уровень асимметрии по числу боковых пластин был сильно увеличен у трехиглой колюшки из зоны контакта между морской trachurus и пресноводной leiurus, а также при вселении морской формы в пресноводные водоемы (карьеры), характеризующиеся резкой выраженной олиготрофностью (Захаров, Зюганов, 1980; Зюганов, 1980). Кроме того, у потомков от группового скрещивания Pungitius pungitius х Pungitius platygaster также возрастает величина асимметрии по боковым пластинам и жаберным тычинкам в 3—4 раза (наши данные). Таким образом, этот показатель чувствителен к необычным условиям среды и к дисбалансу, возникающему от обмена генами между разными формами одного вида или разными видами. Кроме того, этот показатель может очень тонко реагировать на загрязнение химическими веществами водоемов. Так, мною, совместно с В. М. Захаровым, были обработаны выборки Gasterosteus aculeatus из 2 водоемов Латвийской ССР — рек Гауйи и Бульупе в окрестностях г. Риги (предоставленные сотрудником Рижского ун-та В. Е. Гомелюком). Эти реки расположены рядом и являются водоемами одного типа — одинаковый температурный режим, фауна, минерализация, флора и т.п. (Гомелюк, 1978), но в р. Бульупе производится сток промышленных вод целлюлозно-бумажного комбината. Оба эти водоема населены жилой морфой trachurus, Уровни асимметрии (
. Достоверность отличия между выборками определяется по значению F-критерия Фишера (Захаров, Зюганов, 1980). Оказалось, что уровень асимметрии по числу боковых пластин был сильно увеличен у трехиглой колюшки из зоны контакта между морской trachurus и пресноводной leiurus, а также при вселении морской формы в пресноводные водоемы (карьеры), характеризующиеся резкой выраженной олиготрофностью (Захаров, Зюганов, 1980; Зюганов, 1980). Кроме того, у потомков от группового скрещивания Pungitius pungitius х Pungitius platygaster также возрастает величина асимметрии по боковым пластинам и жаберным тычинкам в 3—4 раза (наши данные). Таким образом, этот показатель чувствителен к необычным условиям среды и к дисбалансу, возникающему от обмена генами между разными формами одного вида или разными видами. Кроме того, этот показатель может очень тонко реагировать на загрязнение химическими веществами водоемов. Так, мною, совместно с В. М. Захаровым, были обработаны выборки Gasterosteus aculeatus из 2 водоемов Латвийской ССР — рек Гауйи и Бульупе в окрестностях г. Риги (предоставленные сотрудником Рижского ун-та В. Е. Гомелюком). Эти реки расположены рядом и являются водоемами одного типа — одинаковый температурный режим, фауна, минерализация, флора и т.п. (Гомелюк, 1978), но в р. Бульупе производится сток промышленных вод целлюлозно-бумажного комбината. Оба эти водоема населены жилой морфой trachurus, Уровни асимметрии ( ) этих популяций были подсчитаны вслепую (счетчики не знали, какая выборка из какой реки) и оказались соответственно равны 0.34 (всего было просчитано 94 особи) и 1.44 (68 особей). Позже сборщик материала сообщил, что первая выборка была взята из р. Гауйи, а вторая из р. Бульупе. Полученные данные свидетельствуют о 4-кратном увеличении уровня асимметрии в загрязненном водоеме по сравнению с чистым. Это открывает возможность использования уровня асимметрии как индикатора загрязнения среды.
) этих популяций были подсчитаны вслепую (счетчики не знали, какая выборка из какой реки) и оказались соответственно равны 0.34 (всего было просчитано 94 особи) и 1.44 (68 особей). Позже сборщик материала сообщил, что первая выборка была взята из р. Гауйи, а вторая из р. Бульупе. Полученные данные свидетельствуют о 4-кратном увеличении уровня асимметрии в загрязненном водоеме по сравнению с чистым. Это открывает возможность использования уровня асимметрии как индикатора загрязнения среды.
Поскольку колюшковые рыбы широко распространены в морских солоноватых и пресных водоемах СССР (см. раздел 3) и имеют удобные для оценки уровня асимметрии билатеральные признаки (боковые пластины, жаберные тычинки, лучи в грудном плавнике, колючки брюшные, тазовый пояс), то перспективно использовать их в работах по биомониторингу (слежению за состоянием природной среды). Легкость содержания колюшковых в аквариуме делает их удобным объектом для разного рода экспериментальных паразитологических исследований (Гофман-Кадошников и др., 1963). Исаков (1970) отмечал, что колюшки Gasterosteus и Pungitius представляют большой интерес для экспериментальных работ в области экологической паразитологии по причине их эвригалинности. Выяснилось, что они обладают целым набором эктопаразитов, приспособленных, как и хозяева, к резким изменениям солевого режима водоема. Эвригалинность этих рыб делает возможным экспериментальное исследование спектров солеустойчивости многих эктопаразитов.
Эвригалинность колюшек также позволила выяснить на них многие вопросы механизмов осморегуляции, факторов внешней среды и внутренних (гормональных) факторов, контролирующих осморегуляцию и миграции (см. разделы 2.7 и 2.8). Поскольку ряд хозяйственно ценных видов рыб, таких как кефали, сиги, лососевые, корюшки и другие, многие из которых являются или будут являться в ближайшие годы объектами искусственного разведения, имеет в жизненном цикле много общего с колюшковыми, можно надеяться, что результаты исследований колюшек помогут в изучении этих ценных рыб.
Исследования сложного характера репродуктивного поведения колюшковых привлекают большое внимание этологов. По свидетельству одного из них (Wootton, 1976), этология трехиглой колюшки изучена лучше, чем какого-либо другого вида позвоночных животных мировой фауны. Кроме того, отмечает Вуттон (Wootton, 1976, с. 104), «экспериментальные исследования репродуктивного поведения колюшек сформировали один из краеугольных камней в развитии этологической теории и революционизировали науку о поведении животных», подразумевая при этом работы Н. Тинбергена.
Исследования эволюции морфологического разнообразия колюшковых внесли большой вклад в теорию микроэволюции, экологической и эволюционной генетики (Bell, 1984). Колюшки обладают рядом особенностей, которые делают их достойными особого внимания генетиков, экологов, эволюционистов, так как характеризуются большим морфологическим разнообразием, высокой экологической пластичностью, их легко разводить в лаборатории, они быстро созревают. Особенно интересны результаты, полученные при изучении внутри- и межпопуляционных различий по числу и расположению боковых пластин, жаберных тычинок, строению тазового пояса и других «защитных» структур, окраски в связи с различиями в условиях обитания, а также при изучении абберантных популяций. В частности, исследования факторов, детерминирующих фенотипическое разнообразие Gasterosteus aculeatus, четко показали, что отбор по данному признаку может косвенно влиять на эволюцию других признаков и что один и тот же фенотип может иметь разную приспособленность в разных условиях и на разных стадиях жизненного цикла (см. раздел 4.5).
Принимая во внимание неослабевающий и все увеличивающийся интерес биологов к этой группе рыб, особенно в Западной Европе и Сев. Америке, есть основания надеяться на более широкое использование колюшек в прикладном значении в ближайшие годы.
6. МЕТОДЫ ИССЛЕДОВАНИЯ
В целом методы измерения морфологических признаков у колюшковых соответствуют таковым, применяемым к другим рыбам (Правдин, 1966), однако для колюшковых характерны свойственные только им некоторые особенности морфологии и биологии, так что ниже будут рассмотрены приемы и способы описания морфологии колюшек, облегчающие исследования этой группы. Кроме того, при экспериментальных исследованиях эмбриологии, экологической паразитологии, физиологии, биохимии, поведения, генетики, микроэволюции колюшек часто бывают необходимы их содержание в аквариуме, скрещивание и выращивание молоди, поэтому следует описать методику содержания этих рыб в аквариумных условиях.
Сбор материала в природе. Лов колюшек в водоемах не составляет большого труда. Можно использовать невод (мальковую волокушу) длиной 5, 10, 15 или 20 м с ячеей 10—15 мм, что обеспечит несмещенную выборку в отношении пластинковых морф, числа боковых пластин, жаберных тычинок и т. п. Колюшек также можно ловить сачком диаметром 30 см, сеткой Киналева и другими подобными орудиями. Реймчен (Reimchen, 1980), Рейст (Reist, 1981) и другие авторы отмечали, что разные методы сбора дают сходные выборки в отношении особенностей разных признаков, так что проблема «смещенности» выборок здесь не играет большой роли. Поскольку ряд видов колюшек (Gasterosteus aculeatus, Pungitius pungitius, Pungitius sinensis) ищет пищевые объекты главным образом с помощью зрения (Tugendhat, 1966; Popham, 1966; Вечкета, 1968) и питающаяся одиночная колюшка быстро привлекает на свой участок других рыб, так что вокруг собирается стая (Black, Wootton, 1970), — это можно использовать при сборе материала. Мой собственный опыт сбора колюшек показывает, что эффективность лова возрастает в десятки раз, если привлекать колюшек приманкой. Обычно достаточно насадить на крючок белую бумажку (или фольгу), забросить эту приманку на удочке (с грузилом, но без поплавка — поскольку он только мешает) на расстояние нескольких метров и, подергивая частыми движениями удилище, постепенно по извилистой траектории подводить приманку к сачку, который заранее опущен в воду и находится без движения. Когда стая колюшек, пытающихся хватать приманку, зафиксируется над сачком, необходимо быстрым, но плавным движением поднять его, и несколько десятков экземпляров окажется в сачке. Этот метод «работает» при воде любой мутности, важно, чтобы было соблюдено условие: приманка была яркая и бросалась в глаза колюшкам. Если колюшка есть в данном водоеме, она обязательно попадется в сачок. Такой способ лова дает результат в водоемах любого района, в бассейнах Белого, Балтийского, Черного, Японского, Охотского морей, в реках и других водоемах. При достаточно большой плотности колюшек в водоеме за 30 мин без особого труда можно вылавливать этим способом 100—500 экз. рыб. Второе условие — неподвижность ловца, так как колюшки очень пугливы и остро реагируют на движение, при малейшей опасности быстро уплывают в сторону. Нужно сказать, что к колюшкам видов Pungitius platygaster и Pungitius tymensis этот способ не применим, поскольку они стараются прятаться в слое водной растительности. Их ловить можно только путем «прочесывания» растительности сачком или неводом.
Для колюшек разных фенотипов характерно избирательное предпочтение разных биотопов. Так, Хаген (Hagen, 1967), Хойтс (Heuts, 1947b), Баумгартнер и Белл (Baumgartner, Bell, 1984) и другие авторы показали, что в реках и ручьях нижние, средние и верхние течения занимают разные пластинковые фенотипы Gasterosteus aculeatus. Ларсон (Larson, 1976), Мак-Фейл (McPhail, 1984), Рейст (Reist, 1981) и другие показали, что в озерах могут обитать «бентические» и «лимнетические» генетически изолированные линии Gasterosteus aculeatus и Culaea inconstans. Муди (Moodie, 1972а, 1972b), Мак-Фейл (McPhail, 1969) показали, что в озерах и устьях ручьев, туда впадающих, могут обитать разные формы колюшек. Кинард (Kynard, 1978, 1979а, 1979b) показал, что даже в пределах однородного ландшафта рядом могут иметь гнездовые участки самцы разных «пластинковых» фенотипов, которые занимают разные «микрообитания». Поэтому с учетом этой микрогеографической изменчивости необходимо брать выборку из одной точки как можно большую, а также стараться брать выборки из нескольких точек даже небольшого водоема и из нескольких (по возможности разных) местообитаний одного и того же водоема. Иначе характеристика популяции на основании только одной выборки рискует оказаться неполной и искаженной. То же самое относится и к колюшкам Pungitius. Очень хорошо видно гетерогенное распределение разных форм Pungitius на примере оз. Тунайча (юго-восточный Сахалин), описанного в разделе 4.4.6. Озеро это пресное в удаленной от моря части и солоноватое в месте соединения с морем протокой. В солоноватой части обитает Pungitius pungitius, а в нескольких десятках метров в пресной части обитают Pungitius sinensis (в открытой воде) и Pungitius tymensis (в зоне зарослей), причем две последние формы разделяет граница буквально в несколько сантиметров, но граница эта устойчива.
Фиксация и окрашивание материала. Выловленных колюшек фиксируют обычным способом или в 4%-ном формалине, или в 70%-ном этиловом спирте. Американские ихтиологи (Bell, 1984) фиксируют их еще и в 50 %-ном изопропиловом спирте. Необходимо учесть, что определение возраста колюшек по отолитам (Jones, Hynes, 1950; Тиллер, 1972) возможно только на фиксированном спиртном материале (формалин замутняет отолиты); определение возраста по жаберным крышкам и размерному составу менее надежно (Jones, Hynes, 1950).
Количество боковых пластин можно считать под бинокуляром с помощью препаровальной иглы только на подсушенном материале, наличие воды и влаги на поверхности тела рыбы может исказить подсчеты. Американские и европейские авторы широко применяют окрашивание колюшек для подсчета признаков «костного вооружения». Пластины окрашиваются ализарином Red-S, так как мелкие пластины в передней части тела могут быть незаметны у неокрашенных рыб. Методика окраски изложена в ряде работ (Nelson, 1971а; Bell, 1976b, 1981, 1982, 1984). Рыбы, взятые из спирта, окрашиваются в 2%-ном (масса/объем) растворе КОН, в котором растворяется такое количество ализарина, чтобы раствор сделался непрозрачным. Окраска рыб завершилась, когда у вынутой из раствора и отмытой от налипшей краски колюшки лучи плавников имеют глубоко пурпурный цвет. Окрашенные рыбы вынимаются из раствора ализарина и пропитываются чистым 2%-ным р-ром КОН, а затем помещаются на 24 ч в воду для уменьшения концентрации КОН в теле рыбы, так как он просветляет рыбу. После прополаскивания водой рыбы помещаются в спирт. Их нельзя смешивать с неокрашенными, так как краска может вымываться из окрашенных и поглощаться неокрашенными тушками.
Просчет морфологических признаков.
Дискриминация колюшек на «пластинковые» морфы описана в разделе 1.7. В целом у взрослых рыб разделение на морфы не представляет затруднений. Иногда у морфы trachurus имеется разрыв в одну пластину между килем и пластинами на теле, но скрещивания таких рыб «самих на себя» показали, что это истинные trachurus, а не semiarmatus (Hagen, Gilbertson, 1973а). Обычно рыбы с аналогичным разрывом, но более, чем в одну пластину, вели себя в скрещиваниях как semiarmatus (Hagen, Gilbertson, 1973а). Если же с одной стороны тела у рыб пластины идут, как у trachurus, а с другой, как semiarmatus, то эту сторону следует считать недоразвитием признака, и в целом такие морфы следует трактовать как trachurus (Зюганов, Захаров, 1980). Известно, что Gasterosteus aculeatus (морфы trachurus) в онтогенезе проходят стадии hologymna, leiurus и semiarmatus (Roth, 1920; Igarashi, 1964, 1970; Hagen, 1973; Bell, 1981), поэтому надежно можно определять морфы на рыбах длиной (до конца хвостового стебля) не менее 30—32 мм. Размер рыб, при котором развитие пластин завершается, имеет межпопуляционную изменчивость от 28 до 32 мм (Hagen, McPhail, 1970; Bell, 1981). Игараши (Igarashi, 1962, 1963, 1968) установил, что развитие пластин у рыб рода Pungitius завершается к 32—35 мм (у Pungitius sinensis, например, фенотип trachurus в своем развитии также проходит стадию semiarmatus). Все эти данные надо также учитывать при характеристике популяций по боковым пластинам. Иногда у фенотипа semiarmatus бывает группа пластин, изолированная от пластин на теле и пластин на киле, и необходимо отмечать, с какими пластинами автор объединяет эту группу. Некоторые авторы считают (и приводят в статьях) пластины на теле и на киле отдельно, некоторые — вместе, а некоторые вообще не считают пластин на киле у semiarmatus, trachurus и leiurus с килем. Это вызывает путаницу и затрудняет сравнение материала из разных районов. В разделе «Методика» в публикациях необходимо оговаривать эти «мелочи». Некоторые авторы считают пластины только слева, некоторые отдельно слева и справа, а некоторые суммарно на обеих сторонах тела. Лучше приводить данные по обеим сторонам тела отдельно, чтобы можно было вычислить индексы асимметрии по литературным данным.
Просчет таких признаков, как число колючек, жаберных тычинок, позвонков и лучей в плавниках, не вызывает затруднений. Зарубежные авторы позвонки считают с помощью рентгенограмм, что существенно сокращает время подсчета, так как очистка позвонков от мягких тканей требует времени.
Зарубежные авторы используют сравнительно немного пластических признаков: высоту тела, расстояние между спинными и брюшными колючками, длину брюшной колючки, длину первой спинной или средней колючки, длину жаберных тычинок. Кроме того, форма костей тазового пояса характеризуется такими показателями, как расстояние между основаниями брюшных колючек, длина и ширина передних, задних и восходящих отростков pelvis. Изменчивость тазового пояса у американских колюшек подробно охарактеризована в работах Нельсона (Nelson, 1969, 1971а, 1971b, 1977, и др.). Необходимо помнить, что зарубежные авторы в большинстве относят значения этих признаков не к общей длине тела (до конца хвостового плавника), а к стандартной длине (до конца хвостового стебля). Таких пластических признаков, широко распространенных в отечественной ихтиологической литературе, как диаметр глаза, длина рыла, антедорсальное, антеанальное, вентроанальное, постдорсальное расстояние и т. п., в зарубежной литературе по колюшковым почти не используется.
Плодовитость колюшек необходимо измерять с учетом того, что это порционнонерестующие рыбы, способные нереститься несколько раз в сезон. Так, Смирнов (1951) указывал, что черноморская колюшка Gasterosteus aculeatus нерестится с марта по июль (5 мес) и имеет обычно 6 порций икры разного диаметра, причем плодовитость (число икринок всех порций) колеблется от 782 до 1381. Автор считает, что колюшка на Черном море нерестится 4 и более раз. По данным Вуттона (Wootton, 1973а), колюшка в Англии может нереститься за сезон до 20 раз при хорошей обеспеченности пищей, при этом крупные самки, весящие 3 г и более, продуцируют только за один нерест 300—400 икринок. Таким образом, общая плодовитость может достигать 6000 икринок. Белл (Bell, 1984) указывал, что в южной Калифорнии колюшки нерестуют круглый год. В связи с этим ошибочными являются данные авторов, оценивающих общую плодовитость колюшки в 150—300 икринок (Троицкий, Фролов, 1949, и др.), поскольку они считали плодовитость по одной (наиболее зрелой) порции икры.
Определение пола у колюшек не представляет трудностей и уже начиная с длины рыбы 15—20 мм мужские и женские гонады можно дифференцировать (Stanworth, 1953). Яичники слабо пигментированы меланофорами, полупрозрачны и содержат ооциты, а семенники хорошо пигментированы и наполнены аморфным непрозрачным белым материалом. Иногда для выполнения экспериментальных работ живых колюшек приходится переводить от места поимки в лабораторию на значительные расстояния. Многие водоемы, в которых обитают колюшки, расположены в «комариных» районах. Если колюшки необходимы в живом виде для экспериментальных работ, то сборщику необходимо при их сборе из водоемов отказаться от использования репеллентов (ДЭТА) и др., так как это может привести к гибели или пониженной жизнеспособности рыб и их икры.
Перевозка живых колюшек. Колюшки довольно успешно переносят кратковременную (1—2 сут) перевозку. Взрослых рыб можно перевозить в полиэтиленовых пакетах (продаваемых в зоомагазинах) емкостью 3 л. В пакет заливается 1 л отстоенной воды, помещаются 10—15 особей и закачивается кислород из обычной кислородной подушки, продаваемой в аптеке. Причем резиновую трубку от подушки нужно опустить в воду и «пробулькать» воду кислородом. В это время ту часть пакета, где нет воды, надо обжать вокруг резиновой трубки от подушки (для удаления воздуха из пакета), одновременно закрыв другой рукой свободный край пакета, чтобы кислород не выходил из него. После того как пакет постепенно наполнится кислородом, трубка быстро вынимается, и пакет закупоривается эластичной резинкой, которую также можно приобрести в аптеке. Первоначальные опасения, что колюшки могут проколоть колючками полиэтилен, не оправдались — колюшки довольно спокойно себя ведут в этих условиях и не пытаются растопыривать колючки. Таким способом автору удавалось перевозить несколько сотен колюшек Pungitius sinensis, Gasterosteus aculeatus из Хабаровского края, из Камчатской обл. в Москву (на самолете) и с побережья Черного моря на Беломорскую биостанцию ЗИН АН СССР (поездом) практически без отхода. Если перевозка длится свыше суток, то через каждые сутки воду в пакете и кислород желательно менять, для чего необходимо заранее приготовить воду и запасные подушки с кислородом. Пакеты можно помещать в картонные ящики. В. Е. Гомелюк (личн. сообщ.) использовал другой способ — перевозку колюшек в пластмассовых канистрах емкостью 20 л с периодической продувкой воды с помощью накачанной воздухом волейбольной камеры. В этом случае плотность посадки колюшек составляла 100 особей на канистру, и рыбы были успешно перевезены из Черного моря в г. Ригу. Фостер (Foster, 1977) перевозил колюшек из Англии в Канаду также без потери ими жизнеспособности.
Содержание в аквариуме. Содержание колюшек в аквариуме не вызывает особых проблем, и можно рекомендовать методики содержания аквариумных рыб для разведения колюшек. Однако некоторые особенности поведения колюшек все же необходимо учитывать. В частности, если не достигших половозрелости колюшек можно держать в 57-литровом аквариуме (с продувкой микрокомпрессором) плотностью 15—20 особей на 1 аквариум, то по достижении ими половозрелости плотность надо разряжать. Самцы, с начинающей только проявляться у них брачной окраской, становятся «воинственными», и один такой самец, кусая и преследуя других самцов и самок, может вогнать в глубокий «психологический» стресс остальных рыб в такой степени, что они начинают поражаться сапролегнией, слабеть и погибать. Половозрелого территориального самца необходимо отсаживать отдельно. «Скученность» самок ингибирует созревание у них икры (Schneider, 1969). Взрослых колюшек можно кормить трубочником, мотылем, планктоном: дафнией, циклопом, личинками Артемии. Вуттон (Wootton, 1976) отмечал, что колюшки в аквариуме едят сухой корм для рыб и даже мясной фарш, но, по моим наблюдениям, эти корма отечественные колюшки отвергали. От кормления водяной пылью из прудов лучше воздержаться из-за опасности заражения. При создании «летних» условий в аквариуме: хорошее питание, температура 20 °С, световой режим — 16 С и 8 Т в сутки, колюшек можно заставить созреть даже зимой в возрасте 4 мес (Baggerman, 1957).
Созревшего самца легко выявить по брачной окраске — у Gasterosteus aculeatus красное брюхо, голубые глаза, у всех видов Pungitius — черное тело, белые колючки, а созревшую самку по раздутому брюху. Кроме того, зрелость самки можно определить, поместив ее вместе с окрашенным самцом — она должна ответить на его приближение позой «голова вверх под углом 45° и лицом к самцу».
Скрещивания. Методы скрещивания изложены в работах, приведенных в разделе 4.5.1 (Münzing, 1959; Lindsey, 1962а; Hagen, 1967, 1973; McPhail, 1969; Hagen, Gilbertson, 1973a; Ross, 1973; Avise, 1976; Paepke, 1982; Зюганов, 1983).
Существуют два метода скрещивания: искусственное, когда экспериментатор осеменяет икру самки молоками самца, и естественное, когда самцу предоставляется возможность построить гнездо, ухаживать, оплодотворить самку и заботиться об икре и молоди. Оба метода имеют свои плюсы и минусы. При первом способе икру «текучей» самки получают путем мягкого надавливания на брюхо самки и помещают в чашку Петри. Если самку нужно оставить в живых, то при выдавливании из нее икры голову самки держат обернутой в мокрую марлю, чтобы предотвратить ее асфиксию и ожог от пальцев экспериментатора. Семенники самцов можно добыть, к сожалению, только после вскрытия их брюшной полости. Это один из недостатков этого метода, так как самец погибает и не может использоваться в других скрещиваниях. Оплодотворение производится в чашке Петри сухим способом. Семенники разрушаются скальпелем, на них выдавливается икра, и все это перемешивается (желательно птичьим пером). Через несколько минут добавляют воду, остатки семенников удаляются и икру «укладывают» в чашки Петри в один слой, склеившиеся комки икры разъединяются для лучшей аэрации. Можно продолжать развитие икры в чашках Петри, меняя при этом воду не менее 2 раз в сутки, но лучше поместить в инкубационную камеру. Наличие оплодотворения икры проверяется по возникновению перивителлинового пространства между яйцом и вителлиновой мембраной в течение часа.
Инкубационная камера представляет собой плексигласовый сосуд с сетчатым дном из мельничного газа, камера эта подвешена в воде, может быть и иная конструкция камеры — главное, чтобы икра не вымывалась из нее током воды и хорошо аэрировалась. Температура и соленость воды в лотке должны соответствовать природным параметрам воды водоема, откуда выловлены производители. Если икру начинает поражать грибок, ее в течение часа необходимо выдержать в растворе Малахитового зеленого в концентрации 1 : 200 000 (Hagen, 1967). Погибшие икринки мутнеют и должны удаляться. Сведения о развитии икры даны в разделе 2.1.
После вылупления молоди она должна отсаживаться в отдельный аквариум объемом 30—40 л, причем вода в нем должна быть «старой», а на дне слой песка. Воду необходимо аэрировать и фильтровать, но не допускать, чтобы молодь присасывалась к фильтру, иначе она может повредиться. Воду необходимо периодически частично заменять. Плотность посадки подрастающей молоди не должна превышать 30 особей на 57-литровый аквариум. Личинки, переходящие на внешнее питание, подкармливаются инфузориями, дафнией, циклопами, а подрастающие — достигшие длины 15—20 мм — трубочником и личинками хирономид.
Во время эмбрионального и раннего постнатального развития температура воды влияет на меристические признаки — позвонки, жаберные тычинки, лучи в плавниках, костные пластинки (Heuts, 1949; Lindsey, 1962а, 1962b), поэтому нужно контролировать постоянство температуры, пока исследуемые признаки полностью не заложились.
При втором способе самцу дается возможность самому построить гнездо, и после этого к нему подсаживается зрелая самка. На дне аквариума объемом не менее 40—60 л обязательно должен быть грунт: песок, мелкие камешки (для трехиглой колюшки) и укореняющиеся растения на грунте (для девятииглых колюшек — Elodea, Vallisneria и др.). Необходимо обеспечить самца растительным материалом. Лучше для этого использовать те фрагменты растений, которые тяжелее, чем те, которые легче воды. Например, нежелательно давать самцу ряску, так как гнездо из ряски все время подвсплывает. Различные нитчатые водоросли — хороший материал для гнезда. После того как самец оплодотворил самку, ее необходимо удалить из аквариума, поскольку самец может ее «забить», так как воспринимает ее (не без оснований) как угрозу икре. После того как молодь вылупится из гнезда, самец и трехиглой, и девятииглой колюшки около 5—6 дней заботится о молоди, а затем теряет к малькам «родительские чувства» и может съесть их. Поэтому лучше через 3—4 дня после вылупления отсадить самца от мальков.
Недостатком второго способа является его большая трудоемкость по сравнению с первым: большие затраты времени и количества аквариумов. Однако преимущества его перед первым способом очевидны. 1. Одного и того же самца можно несколько раз использовать в скрещиваниях с разными самками (что часто требуется в генетических экспериментах). 2. Как правило, выживаемость икры и личинок, когда их выращивает самец, приближается к 100 %, тогда как при искусственном выращивании в среднем 30—40 %. 3. Во время инкубации икры экспериментатору не нужно за ней следить (удалять погибшие икринки, прополаскивать икру дезинфицирующими растворами и т. п.), за икрой прекрасно следит самец. Недостатки первого метода уже указывались. Преимущества первого метода заключаются в том, что не требуется больших аквариумов в большом количестве, где самец бы строил гнездо, не нужно следить за завершением постройки гнезда, за завершением нереста и вылуплением молоди (экономия материалов, труда и времени).
Методы этологических исследований. За размножением колюшек в естественных условиях легко наблюдать с берега, так как они нерестятся в прибрежной зоне, на мелководье. Методы этих наблюдений изложены в ряде работ (Hagen, 1967; McPhail, 1969, 1984; Hay, McPhail, 1975; Kynard, 1978; Ridgway, McPhail, 1984, и др.) (см. разделы 2.8 и 4.5.4, 4.5.6). В ряде этих работ описаны методы искусственного вмешательства экспериментатора в нерест колюшек в естественных условиях, например огораживание гнездовых участков самцов прозрачными и непрозрачными перегородками (Kynard, 1978), перемещение гнезд с икрой на другое место (Гомелюк, 1978), перемещение самих самцов на другие участки (Hagen, 1973) и т. д. Хаген (Hagen, 1967) применял также мечение колюшек вкупе с взаимным перемещением trachurus и leiurus в «чужие» биотопы. По его утверждению, мечение путем отрезания спинной колючки не влияет на жизнеспособность рыб, хотя по моим наблюдениям такая операция приводит к их худшему плаванию.
Для исследования этологической репродуктивной изоляции между разными видами и формами колюшек в аквариумах используются разные методы, их можно найти в работах, изложенных в разделах 2.8.2 и 3.5.6. Один из наиболее распространенных методов — тесты на предпочтение. В этом случае обычно 2 самца разных форм помещаются в аквариум с непрозрачной перегородкой, им дается возможность построить гнезда, а затем перегородка удаляется, и в аквариум одновременно с этим подсаживается самка. Она выбирает того или иного самца (рис. 39). После того как эти опыты повторяются несколько раз (или несколько десятков раз), статистически определяется, есть ли этологические барьеры между разными формами, ассортативность скрещиваний и т. д. В этих опытах важно, чтобы расстояние между самцами было не менее 0.5 м, иначе будет искажение эксперимента из-за «конфликтов» между самцами. Важно также воссоздание в аквариуме обстановки, приближенной к природной (набор видов и плотность растений, камни, грунт и т. д.). Необходимо также, чтобы условия в разных аквариумах были стандартизированы.
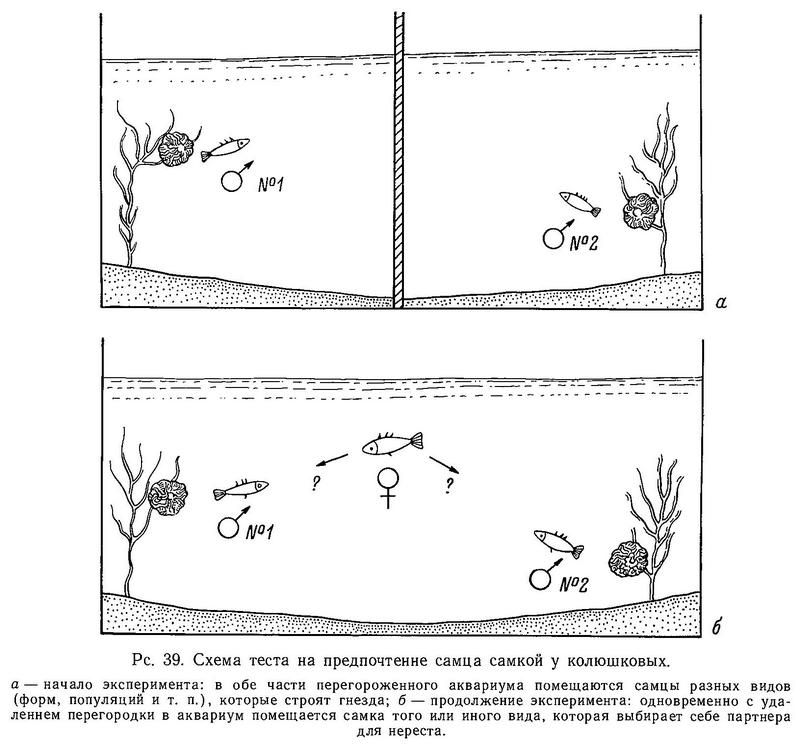
Во время этологических, физиологических, паразитологических и других экспериментов колюшек иногда приходится вынимать из воды и «прижизненно» снимать с них показания или делать инъекции. Обычно колюшки неплохо переносят операцию вынимания из воды. Но при этом надо следить, чтобы голова рыбы была обернута в мокрую марлю, а также чтобы тело рыбы не обсыхало и не «обжигалось» пальцами экспериментатора. При снятии с колюшек «морфологических» показаний можно применять анестетики, чтобы избегать резких движений рыбы.
При лабораторных исследованиях колюшек, когда лаборатория находится недалеко от водоема, следует избегать помещения колюшек в садки. Опыт автора показывает, что в садки часто проникают разного рода беспозвоночные хищники (пиявки, жуки-плавунцы, гладыши, личинки стрекоз и т. п.), которые сильно поражают колюшек, так как последним трудно в тесном пространстве увернуться от этих врагов. Возможный выход: садки должны быть сделаны из мелкоячеистой сети (диаметр ячеи не более 2—3 мм).
СИСТЕМАТИЧЕСКАЯ ЧАСТЬ
Сем. GASTEROSTEIDAE Bonaparte, 1831 — Колюшковые
— Gasterosteini Bonaparte, 1831 : 90, 103 (pro subfam.).
— Gasterosteidae Bertin, 1925 : 1—8; Nelson, 1971a : 427—442; Wootton, 1976 : 1—381; Bell, 1984 : 431—528.
Тело веретенообразное или вытянутое, голое или покрытое костяными пластинками. Рыло коническое или слегка трубковидное. Рот выдвижной. Перед спинным плавником 16 или менее (до 2, редко 1 или 0) свободных колючек (игл), способных складываться. Колючки растопырены слегка в стороны или направлены вертикально вверх, длина их варьирует. Число мягких лучей в спинном и анальном плавниках 6—14, в хвостовом 12 (редко 11 и 13), в грудном 10 (редко 9 или 11), в брюшном 1 или 2 (редко 0—3). Перед анальным и брюшным плавниками по 1 колючке (перед анальным колючка свободная, брюшная колючка связана с мягкими лучами). Форма хвостового плавника слегка закругленная или усеченная (слегка вильчатая у ряда видов рода Pungitius). Форма хвостового стебля изменчива (короткий или длинный). Posttemporale и надключичная кость имеется (кроме Gasterosteus wheatlandi). Отверстие в коракоиде отсутствует (слабые следы отверстия найдены у Apeltes, Pungitius, Culaea); лопаточное отверстие есть и направлено вперед; передний край коракоида примыкает и касается клейтрума выше нижнего конца клейтрума. Передние отростки тазовой кости намного короче, чем задние (у Spinachia они равной длины). Восходящий отросток тазовой кости есть или нет (нет у Spinachia и Apeltes).
Циркуморбитальные кости не замыкаются в кольцо позади глаза. Позвонков 28—42. Первый хвостовой позвонок обычно имеет гемальную дугу, и первый гемальный отросток позвонка примыкает к птеригиофору анальной колючки. Лучей жаберной перепонки (бранхиостегальных) 3 (2 цератогиале и 1 эпигиале). Эпиплевральные и плевральные ребра хорошо развиты, свободные и не прикреплены к накожным костным пластинам. Эпиплевральные ребра имеются у всех туловищных позвонков, так же как и плевральные, но последние отсутствуют на первых двух туловищных позвонках.
Задний конец maxilla не выступает за задний конец premaxilla. Зубы есть на челюстях и на глоточно-жаберных костях, на сошнике и небных костях зубов нет. Жаберные перепонки сращены между собой и образуют свободную складку поперек межжаберного промежутка или приращены к межжаберному промежутку. Каналы боковой линии на теле, и особенно на голове, развиты слабо.
Мелкие рыбы длиной 5—10 см (Spinachia до 20 см) распространены в морских и пресных водах бассейнов Тихого, Атлантического и Северного Ледовитого океанов (в северном полушарии). 5 родов (Gasterosteus, Pungitius, Culaea, Apeltes, Spinachia) и, из-за спорности таксономического статуса некоторых из них, 7—9 видов. Таксономические проблемы существуют в родах Gasterosteus и Pungitius. Для всех представителей характерна забота о потомстве: самец строит гнездо из растительных остатков, куда самка откладывает икру, охраняемую затем самцом.
ОПРЕДЕЛИТЕЛЬНАЯ ТАБЛИЦА РОДОВ
(Указанные в таблице признаки годны для определения особей всех возрастов — от мальков до рыб максимальных размеров.)
1 (6). Восходящий отросток тазовой кости имеется. Левый и правый задние
отростки тазовой кости примыкают друг к другу, образуя брюшной щит, и расположены медиальнее оснований брюшных колючек.
2 (3). Спинных колючек 3 и менее. 1. Gasterosteus L.
3 (2). Спинных колючек более 3.
4 (5). Спинных колючек 5—6. 2. Culaea Whitley
5 (4). Спинных колючек 7—12. 3. Pungitius Coste
6 (1). Восходящий отросток тазовой кости отсутствует. Левый и правый задние
отростки тазовой кости расположены латеральнее оснований брюшных колючек, не примыкают друг к другу и не образуют брюшного щита.
7 (8). Спинных колючек 4—5. 4. Apeltes Dekay
8 (7). Спинных колючек 14—16. 5. Spinachia Fleming
Жизнь животных. Том 4. Рыбы Под редакцией профессора Т.С.Расса 1971 г.
Семейство Колюшковые (Gasterosteidae)
Колюшковые — мелкие, от 3,5 до 20 см,
морские и пресноводные рыбы северного
полушария. Тело стройное, удлиненное,
сжатое с боков. Хвостовой стебель тонкий,
обычно с боковыми килями. Все колюшки
более или менее сильно вооружены как
для нападения, так и для защиты. На
спине и на брюхе имеются складные шипы;
чешуи нет, но у большинства видов бока
тела покрыты броней из больших
костных пластинок. Различают колюшек по
числу шипов или игл на спине: трехиглая,
пятнадцатииглая колюшка и т. п. В
семействе колюшковых 5 родов, 12 видов.
Рыбы Японского моря и сопредельных частей Охотского и Желтого морей. Часть 2. (Acipenseriformes — Polynemiformes). Г.У.Линдберг, М.И.Легеза 1965 г.
LXIX. Сем. GASTEROSTEIDAE — КОЛЮШКОВЫЕ
Тело веретенообразное, голое или покрытое костяными пластинками. Рыло коническое, иногда слегка трубковидное. Рот выдвижной. Перед спинным плавником 2 или более свободных игол. Кости жаберной крышки хорошо развиты. Зубы на челюстях и на глоточно-жаберных костях; на сошнике и на нёбных зубов нет. Радиальные элементы грудных конечностей малы, без отверстий между ними. Posttemporale и надключичная кость есть. (Берг, 1949 : 965). Колючек впереди спинного не более 16; колючки крупные.
Для рыб этого семейства характерна забота о потомстве. Самец строит гнездо из растительных остатков, куда самка откладывает икру.
5 родов, в водах Японского моря 2 рода.
ОПРЕДЕЛИТЕЛЬНАЯ ТАБЛИЦА РОДОВ СЕМ. GASTEROSTEIDAE
1 (2). Перед спинным плавником 3 колючки. 1. Gasterosteus Linne.
2 (1). Перед снинным плавником 7—13 колючек. 2. Pungitius Coste.
Рыбы северных морей СССР. А.П.Андрияшев 1954 г.
XXVI. Сем. GASTEROSTEIDAE — КОЛЮШКОВЫЕ
Bertin, Ann. Inst. Oceanogr., Paris, II, 1, 1925 : 1—204, fgs. (систематика, биология, библиография семейства). — Берг, Рыбы пресн. вод СССР, III, 1949 : 965.
Сем. Gasterosteidae. Новые данные о возрасте и темпе роста (по отолитам) трехиглой, девятииглой и морской колюшек у берегов Англии см.: J. W. Jоnеs а. Н. В. N. Нynеs, Journ. Anim. Ecol., XIX, 1, 1950 : 59—73. Авторы показывают, что Gasterosteus и Pungitius живут до 3.5 лет, достигая половозрелости в течение первого года жизни; после этого рост колюшек почти прекращается. На отолитах Spinachia прозрачных колец нет, что подтверждает мнение многих авторов об одногодичном жизненном цикле морской колюшки.
Тело веретенообразное или сжатое с боков, покрыто костяными пластинками или голое. Рыло коническое, иногда слегка трубковидное. Рот выдвижной, окаймлен межчелюстными. Зубы на челюстях и глоточных костях; на сошнике и нёбных зубов нет. Лучей жаберной перепонки 3. Кости жаберной крышки хорошо развиты. Перед спинным плавником от (2) 3 до 16 свободных складных шипов, не связанных общей перепонкой. Брюшные плавники расположены недалеко за грудными, представлены сильной колючкой с 1—2 зачаточными лучами или совсем без лучей. Postcleithra отсутствуют. Ребра не прикреплены к накожным щиткам тела. Вторая подглазничная косточка соединена с praeoperculum. Закрытопузырные. Известны с миоцена.
5 родов в пресных, солоноватых, а также в морских водах северного полушария. В северных морях 3 рода.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ РОДОВ
1 (4). Тело умеренно удлиненное, сжатое с боков. Хвостовой стебель короче головы, верхняя и нижняя стороны его голые. Перед спинным плавником не более 12 колючек. Рыло короткое.
2 (3). Колючек впереди спинного Плавника не более 5 (обычно 3). Жаберные перепонки узко приращены к межжаберному промежутку, не образуя складки поперек него. 3. Gasterosteus L.
3 (2). Колючек впереди, спинного плавника более 5 (обычно 7—12). Жаберные перепонки соединены, образуя широкую складку поперек межжаберного промежутка. 2. Pungitius Coste.
4 (1). Тело сильно удлиненное, спереди пятигранное. Хвостовой стебель длиннее головы, верхняя и нижняя стороны его покрыты костными щитками. Перед спинным плавником 14—16 колючек. Рыло трубковидно удлиненное. 1. Spinachia Cuv.
Рыбы пресных вод СССР и сопредельных стран. Л.С.Берг 1948 г.
XX. Семейство GASTEROSTEIDAE. — Колюшковые
(Обзор семейства см. в работе: L. Bertin, Ann. Inst. Ocean., II, № 1, 1925 (биология, систематика, список литературы; русская литература автору не известна). По биологии см.: М. Leiner, Zeitschr. f. Morph. u. Oekol. d. Tiere, v. 28, 1934, p. 107—154.)
Тело веретенообразное, голое или покрытое костяными пластинками. Рыло коническое, иногда слегка трубковидное. Рот выдвижной. Перед спинным плавником 2 или более свободных игол. Кости жаберной крышки хорошо развиты. Зубы на челюстях и на глоточно-жаберных костях; на сошнике и на нёбных зубов нет. Лучей жаберной перепонки 3. Радиальные элементы грудных конечностей малы, без отверстий между ними. Posttemporale и надключичная кость есть. Ребра свободные, не прикрепленные к накожным щиткам.
5 родов в солоноватых (реже соленых) и пресных водах Европы, Алжира, сев. и средн. Азии, Сев. Америки: Gasterosteus, Pungitius, Apeltes, Eucalia, Spinachia. В пресных водах Старого Света 2 рода.
1 (2). Перед спинным плавником 7—12 колючек. 1. Pungitius Coste
2 (1). Перед спинным плавником 2—3 колючки. 2. Gasterosteus L.











































































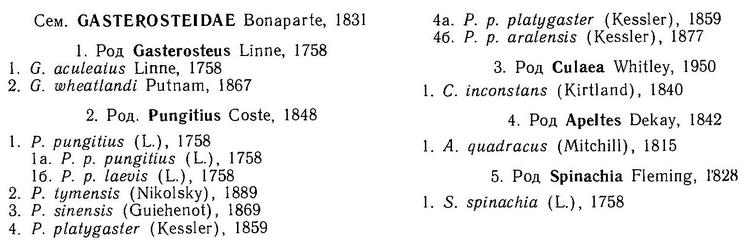

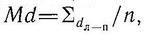 , где dл-п — разность между значениями признака на левой и правой сторонах тела у каждой особи). Далее, если значение достоверно не отличается от нуля (а так и было при анализе всех популяций), это свидетельствует об отсутствии какой бы то ни было направленности асимметрии анализируемого признака. В этом случае можно применять в качестве показателя асимметрии величину
, где dл-п — разность между значениями признака на левой и правой сторонах тела у каждой особи). Далее, если значение достоверно не отличается от нуля (а так и было при анализе всех популяций), это свидетельствует об отсутствии какой бы то ни было направленности асимметрии анализируемого признака. В этом случае можно применять в качестве показателя асимметрии величину 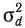
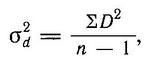
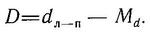 . Достоверность отличия между выборками определяется по значению F-критерия Фишера (Захаров, Зюганов, 1980). Оказалось, что уровень асимметрии по числу боковых пластин был сильно увеличен у трехиглой колюшки из зоны контакта между морской trachurus и пресноводной leiurus, а также при вселении морской формы в пресноводные водоемы (карьеры), характеризующиеся резкой выраженной олиготрофностью (Захаров, Зюганов, 1980; Зюганов, 1980). Кроме того, у потомков от группового скрещивания Pungitius pungitius х Pungitius platygaster также возрастает величина асимметрии по боковым пластинам и жаберным тычинкам в 3—4 раза (наши данные). Таким образом, этот показатель чувствителен к необычным условиям среды и к дисбалансу, возникающему от обмена генами между разными формами одного вида или разными видами. Кроме того, этот показатель может очень тонко реагировать на загрязнение химическими веществами водоемов. Так, мною, совместно с В. М. Захаровым, были обработаны выборки Gasterosteus aculeatus из 2 водоемов Латвийской ССР — рек Гауйи и Бульупе в окрестностях г. Риги (предоставленные сотрудником Рижского ун-та В. Е. Гомелюком). Эти реки расположены рядом и являются водоемами одного типа — одинаковый температурный режим, фауна, минерализация, флора и т.п. (Гомелюк, 1978), но в р. Бульупе производится сток промышленных вод целлюлозно-бумажного комбината. Оба эти водоема населены жилой морфой trachurus, Уровни асимметрии (
. Достоверность отличия между выборками определяется по значению F-критерия Фишера (Захаров, Зюганов, 1980). Оказалось, что уровень асимметрии по числу боковых пластин был сильно увеличен у трехиглой колюшки из зоны контакта между морской trachurus и пресноводной leiurus, а также при вселении морской формы в пресноводные водоемы (карьеры), характеризующиеся резкой выраженной олиготрофностью (Захаров, Зюганов, 1980; Зюганов, 1980). Кроме того, у потомков от группового скрещивания Pungitius pungitius х Pungitius platygaster также возрастает величина асимметрии по боковым пластинам и жаберным тычинкам в 3—4 раза (наши данные). Таким образом, этот показатель чувствителен к необычным условиям среды и к дисбалансу, возникающему от обмена генами между разными формами одного вида или разными видами. Кроме того, этот показатель может очень тонко реагировать на загрязнение химическими веществами водоемов. Так, мною, совместно с В. М. Захаровым, были обработаны выборки Gasterosteus aculeatus из 2 водоемов Латвийской ССР — рек Гауйи и Бульупе в окрестностях г. Риги (предоставленные сотрудником Рижского ун-та В. Е. Гомелюком). Эти реки расположены рядом и являются водоемами одного типа — одинаковый температурный режим, фауна, минерализация, флора и т.п. (Гомелюк, 1978), но в р. Бульупе производится сток промышленных вод целлюлозно-бумажного комбината. Оба эти водоема населены жилой морфой trachurus, Уровни асимметрии (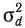 ) этих популяций были подсчитаны вслепую (счетчики не знали, какая выборка из какой реки) и оказались соответственно равны 0.34 (всего было просчитано 94 особи) и 1.44 (68 особей). Позже сборщик материала сообщил, что первая выборка была взята из р. Гауйи, а вторая из р. Бульупе. Полученные данные свидетельствуют о 4-кратном увеличении уровня асимметрии в загрязненном водоеме по сравнению с чистым. Это открывает возможность использования уровня асимметрии как индикатора загрязнения среды.
) этих популяций были подсчитаны вслепую (счетчики не знали, какая выборка из какой реки) и оказались соответственно равны 0.34 (всего было просчитано 94 особи) и 1.44 (68 особей). Позже сборщик материала сообщил, что первая выборка была взята из р. Гауйи, а вторая из р. Бульупе. Полученные данные свидетельствуют о 4-кратном увеличении уровня асимметрии в загрязненном водоеме по сравнению с чистым. Это открывает возможность использования уровня асимметрии как индикатора загрязнения среды.
