Pungitius pungitius (Linnaeus, 1758)
Девятииглая колюшка, обыкновенная девятииглая колюшка, малая колюшка, многоиглая колюшка, десятииглая колюшка (Rus),
Ninespine stickleback, Needle-mackerol, Stickle-back, Ten-spined stickleback, Tinker
(Eng)
Синонимы:
Gasterosteus blanchardi Sauvage, 1874
Gasterosteus concinnus Richardson, 1836
Gasterosteus dekayi Agassiz, 1850
Gasterosteus globiceps Sauvage, 1874
Gasterosteus mainensis Storer, 1837
Gasterosteus nebulosus Agassiz, 1850
Gasterosteus occidentalis Cuvier, 1829
Gasterosteus pungitius brachypoda Bean, 1879
Gasterosteus pungitius Linnaeus, 1758
Pygosteus pungitius Jordan & Evermann, 1896
Pygosteus pungitius carinata Bertin, 1925
Pygosteus pungitius semiarmata Bertin, 1925
Pygosteus pungitius trachura Bertin, 1925
Атлас-определитель рыб: Книга для учащихся. Н.А.Мягков 1994 г.
Колюшка девятииглая — Pungitius pungitius (Linnaeus, 1758)
Рыло умеренной длины, не трубковидное. Тело голое, на задней части тела и хвостовом стебле есть костные пластинки с общим килем. Перед спинным плавником лежат 6—12 колючек, направленных в разные стороны. D1 VI—XII (колючки). D2 10—12. А I 8—11. Окраска тела серебристо-серая, спинка чуть темнее боков и брюшка. Плавники бесцветные. Длина тела 8 см. Широко распространена в пресных и солоноватых водах от Балтики до Дальнего Востока. Полиморфный вид, представленный в пределах ареала рядом форм и подвидов, из последних наиболее известные:
1. Колюшка амурская — Pungitius pungitius sinensis
Воды Сахалина, нижнего течения Амура и рек Приморья (пресные и морские участки).
2. Колюшка аральская — Pungitius pungitius aralensis
Водоемы Средней Азии.
Декоративное рыбоводство. А.М.Кочетов 1991 г.
Девятииглая колюшка — Pungitius pungitius (Linnaeus, 1758). Родина — Северная Европа, Азия и Америка; размер 5—9 см. На спине 7—12 колючек. Самец во время размножения черный. Вид образует 3 подвида. Гнездо рыбы строят среди растений.
Девятииглая колюшка - Pungitius pungitius (Linnaeus, 1758), циркумполярный вид, 5—9 см.
Фауна СССР. Рыбы. Том V, вып. 1. Семейство Колюшковых (Gasterosteidae) мировой фауны. В.В.Зюганов 1991 г.
Pungitius pungitius (Linne), 1758 (рис. 46).
— Gasterosteus pungitius Linne, 1758 : 296 (Европа).
— Pygosteus pungitius Bertin, 1925 : 161 (синонимия, распространение).
— Pungitius pungitius, Берг, 1949 : 966 (описание, распространение, синонимия); Münzing, 1960 : 210 (описание, синонимия, эволюция); Nelson, 1971a : 438 (морфология, анатомия); Wootton, 1976 : 266 (биология, распространение).

D (VI) VII—XII 9—12 (Число спинных колючек менее 6 (вплоть до 1) зафиксировано в популяциях из Ирландии (Ure, 1962, — цит. по: Nelson, 1971а) и Греции (Stephanidis, 1971).), A I 7—11, P (9) 10, V I (Колюшки Pungitius pungitius без брюшных колючек встречаются в Северо-Восточной Канаде, Ирландии, Греции и Карелии (СССР) (см. раздел. 1.6).), С 12.
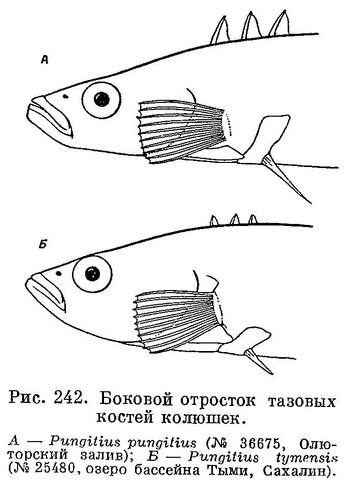
Позвонков 30—35 (туловищных 14, хвостовых 18—19). Спинных колючек чаще всего 8—10. Все примерно равной высоты. Тело голое или покрыто мелкими (1—5) пластинами над грудным плавником. На хвостовом стебле есть киль, сформированный костными пластинами, расположенными перпендикулярно по отношению к боковой поверхности хвостового стебля. Киля нет у подвида Pungitius pungitius laevis. Восходящий (боковой) отросток тазовой кости хорошо развит и достигает верхней части основания грудного плавника. Брюшные колючки длинные, 2.5—3 раза в длине головы. Спинные колючки высокие — 2/3—3/4 от диаметра глаза. Высота последней примерно равна высоте предыдущих или лишь слегка превышает их. Высота тела меньше его длины (без С) в 4.7—6 раз, длина головы меньше длины тела в 3.6—4.3 раза. Длина половозрелых особей 50—60 мм, но иногда достигает 90 мм (табл. 26).
Вне нерестового сезона верх головы и спина темно-голубоватого цвета, бока серебристо-белые с мелкими черными пятнами. Во время нереста самец делается угольно-черного цвета, а брюшные колючки белыми. В брачный период у самок развивается так называемое зеркальце — блестящее пятно, не покрытое пигментом кожи, на боках тела.
Изменчивость. Подвержен многочисленным вариациям в отношении числа боковых пластин на теле и на киле, числа жаберных тычинок, степени развития брюшных колючек и тазового пояса, числа спинных колючек и окраски. В Сев. Америке выделяют две формы (McPhail, 1963): берингийскую и миссисипскую. Первая приурочена к морскому побережью и имеет 0—15 (мода 3—5, обычно 4) пластин на теле, более длинные брюшные колючки, больше спинных колючек и меньше жаберных тычинок, чем вторая (приуроченная к континентальным водам), у которой 0—2 (в среднем 0) пластин на теле. Наличие большого числа популяций с плавным переходом по этим признакам между двумя формами не позволило Мак-Фейлу (McPhail, 1963, р. 38) придать этим формам ранг подвидов. В Евразии также существуют несколько алло-, пара- и симпатричных форм, которым придавался ранг подвидов вида Pungitius pungitius. Берг (1949, с. 967), Никольский (1956, с. 458), Линдберг и Легеза (1965, с. 260—264), Мюнцинг (Münzing, 1969, р. 206) и вслед за ними Вуттон (Wootton, 1976, р. 266), Белл (Bell, 1984, р. 431) и многие другие европейские и американские авторы ошибочно считали дальневосточную форму «sinensis» (имеющую полный ряд боковых пластин на теле и киль) подвидом Pungitius pungitius sinensis. На самом деле эта форма симпатрично обитает с Pungitius pungitius в водоемах Сахалина, Курильских островов, Хоккайдо и Хонсю (Kobayachi, 1957; Ishigaki, 1967; Tanaka, 1982; Зюганов, личн. наблюдения), что противоречит ее подвидовому статусу. Японские авторы придают ей видовой статус (Tanaka, 1982), с чем я, с оговорками, изложенными в разделе 4.5.6, согласен.
Линдберг и Легеза (1965, с. 260—264) ошибочно придавали подвидовой статус Pungitius pungitius tymensis форме «tymensis», отличающейся от Pungitius pungitius очень короткими спинными и брюшными колючками и слабо выраженным килем на хвостовом стебле. В частности, авторы ссылаются на Берга (1949, с. 969), допускавшего возможность того, что «это одна из форм Pungitius pungitius». Однако в действительности «tymensis» симпатрично и маргинально симпатрично (парапатрично) обитает с Pungitius pungitius и Pungitius sinensis на Сахалине (наши данные) и на восточном побережье о. Хоккайдо (Ishigaki, 1967), что противоречит ее подвидовому статусу. Японские исследователи считают ее самостоятельным видом Pungitius tymensis (Kobayashi, 1957; Ishigaki, 1967, и др.), что подтвердили наши исследования на о. Сахалине (см. раздел 4.5.6). В Японии на островах Хоккайдо и Хонсю совместно с Pungitius pungitius встречается форма, покрытая пластинами, как Pungitius sinensis, но пластины эти очень мелкие и покрывают тело лишь в районе боковой линии. Японские авторы (Ikeda, 1933; Igarashi, 1968, 1969; Muramoto et al., 1969) называют эту форму «trachura — тип Pungitius pungitius» и рассматривают ее как внутривидовую форму Pungitius pungitius.
В Западной Европе (Южная Франция, Юго-Западная Англия, Ирландия) встречается форма, лишенная пластин на теле и киля, имеющая самостоятельный ареал, соприкасающийся во Франции и Англии с ареалом Pungitius pungitius. Эту форму ряд авторов (Münzing, 1969; Wootton, 1976) считает подвидом Pungitius pungitius laevis. Берг (1949, с. 969) считал ее самостоятельным видом, а Гросс (Gross, 1979) рассматривает ее как внутривидовую форму Pungitius pungitius. Мы не исследовали этой формы, но по литературным данным полагаем, что она удовлетворяет критериям подвида, и признаем ее подвидовой статус.
В канадской провинции Альберта (Nelson, 1971b), в р. Сперхиос, Греция (Stephanidis, 1971), и в Карелии, СССР (Зюганов, Розанов, 1987) встречаются популяции Pungitius pungitius, лишенные тазового пояса.
Несмотря на относительно хорошую изученность морфологической изменчивости и популяционной структуры Pungitius pungitius, в отношении этого таксона имеются таксономические проблемы, в частности, еще окончательно не ясно таксономическое положение формы «laevis», таксономические взаимоотношения Pungitius pungitius и Pungitius sinensis, а также взаимоотношения североамериканских и европейских колюшек.
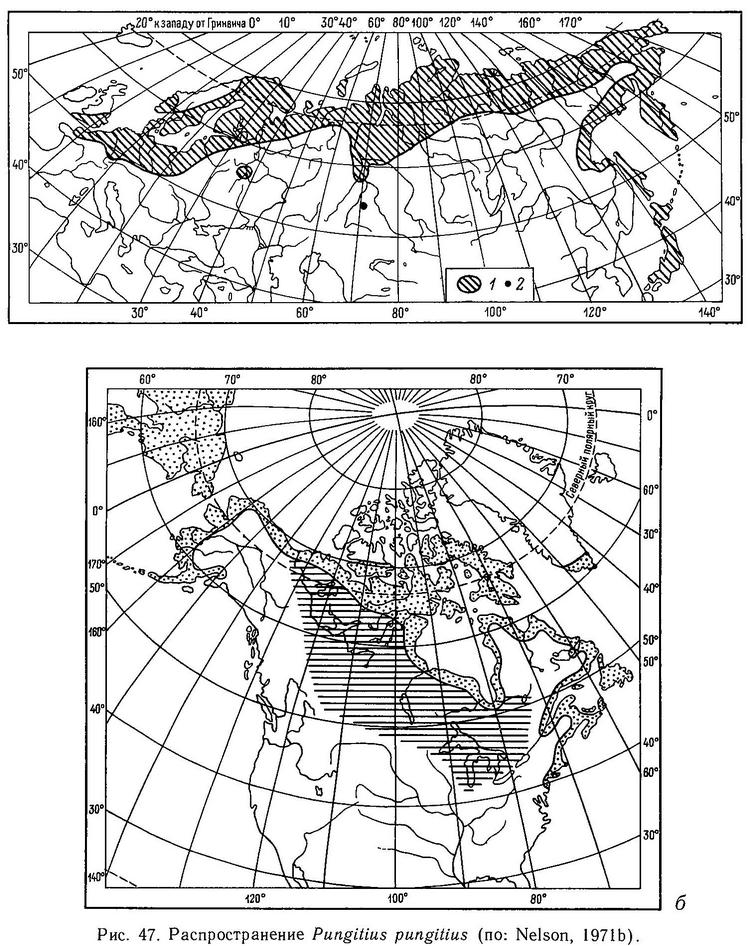
Распространение (рис. 47, а, б). Циркумполярный вид, распространенный в континентальных и островных пресноводных водоемах и частично в морских прибрежных водах. В Европе: бассейны Средиземного, Северного, Балтийского, Норвежского, Баренцева и Белого морей. На юге распространена до рек Лаура и Рона (Pungitius pungitius laevis, Франция) и р. Сперхиос (форма «hellenicus» Pungitius pungitius laevis), Греция, Англия, Ирландия. В Исландии отсутствует. На север до Новой Земли (губа Белушья). В Норвегии лишь в бассейне р. Гломен у Трондгейма и в Финмаркене. Швеция, Финляндия, Дания — повсюду, Бельгия, Голландия, северные части ФРГ, ГДР и Польши. В бассейне Черного, Каспийского, Аральского морей нет. Входит в реки Балтийского моря: Литвы, Латвии, Эстонии, Белоруссии. Есть в псковско-чудских, Ладожском и Онежском озерах, в Карелии и Мурманской обл. повсюду. В бассейнах рек Великой, Онеги, Мезени — до среднего течения, в бассейне р. Печора — нижняя треть (до Усть-Цильмы). Далее на восток по всему бассейну Северного Ледовитого океана. Выше всего поднимается по Оби до Иртыша у Тобольска. В Хатанге до Боганиды, в Енисее до Туруханска, в Лене в нижней четверти реки. Есть изолированная популяция в оз. Большое Чебачье в кокчетавских горах (пос. Боровое, Казахская ССР), в соседнем оз. Майбалык была обнаружена Г. В. Никольским в 40-х гг. (Берг, 1949, с. 967), но сейчас там вымерла из-за повышения солености озера до 50 ‰. По Тихоокеанскому побережью в водоемах Чукотки и Камчатки, Курильских островов, на островах Японии — Хоккайдо и Хонсю. В бассейне Охотского моря по материковому побережью до устья Амура, далее на юг сменяется Pungitius sinensis, на островах Шантарских и по всему Сахалину. На Шантарских, Курильских островах, Сахалине, Хоккайдо, Хонсю обитает совместно с Pungitius sinensis. В Сев. Америке на Алеутских островах, Аляске и до о. Кадьяк на юг. На восток от Аляски обитает в бассейне р. Маккензи, озерах Медвежьем и Большом Невольничьем. Далее на восток в водоемах побережья Гудзонова залива, на Баффиновых островах и по Атлантическому побережью Америки на юг до штата Нью-Джерси. В континентальных водоемах Сев. Америки в системе Великих Озер (кроме оз. Эри), в канадских провинциях Манитоба, Альберта, Саскачеван, а также в бассейне верхней Миссисипи (штат Индиана, США). В Сев. Америке, таким образом, она широко распространена восточнее Скалистых гор. Есть на юге Гренландии.
Образ жизни. Имеется два типа жизненного цикла: типично пресноводный (жилой) и полупроходной. Полупроходная форма обитаете прибрежной части морей, а размножается либо в солоноватых лагунах, заливах, эстуариях, либо поднимается выше по течению рек и нерестится в пресной воде. Морфологические различия между этими экологическими формами обнаружены только в Сев. Америке (см. берингийская и миссисипская формы). В Евразии между ними четких различий нет, и, очевидно, эти формы взаимопереходящи и обратимы.
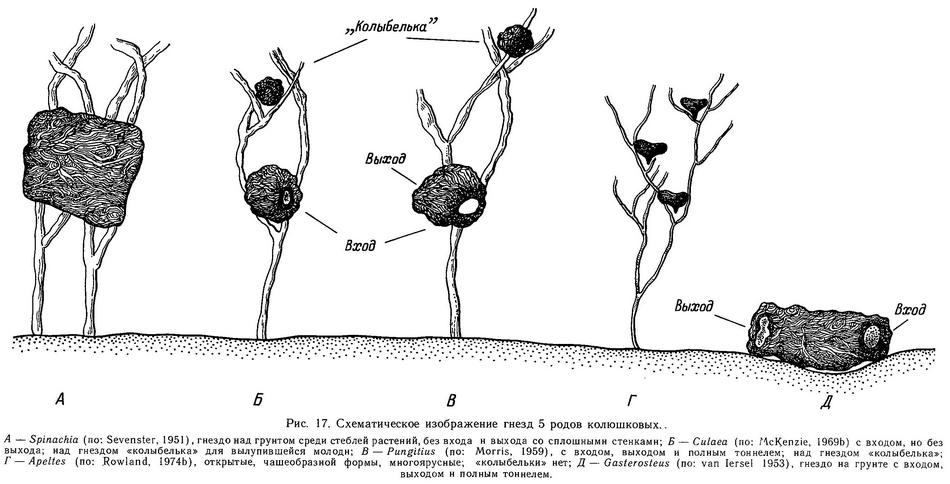
Pungitius pungitius живет максимум до 5 лет, но в большинстве популяций 2—3 года. В бассейне р. Матамек (Канада) большинство рыб живет 1 год и лишь незначительная часть достигает возраста 2 лет (Coad, Power, 1973d). Репродуктивная биология Pungitius pungitius в общих чертах сходна с таковой Gasterosteus aculeatus, но имеется и ряд своеобразных черт. Нереститься начинает на следующее лето после рождения. Нерест в апреле—июле в зависимости от географической широты (температурно-светового режима). Нерест порционный. Интервалы между нерестовыми актами 6—48 ч, наблюдается до 6—8 актов размножения в сезон. Одноразовая плодовитость 60—160 икринок в зависимости от размера самки. Самец строит гнездо из растительности, но в отличие от Gasterosteus aculeatus не на дне, а над грунтом среди растений. Однако имеются популяции в Великих Озерах (США), где самцы строят гнезда на грунте под камнями в отсутствие зоны растений на литорали (McKenzie, Keenleyside, 1970; Griswold, Smith, 1972). Кроме того, самцы из водоема, где имеется укореняющаяся растительность, будучи интродуцированными в водоем, лишенный растительности, начинают строить гнезда на грунте под камнями из растительных остатков, водорослей и т. п. Самец охраняет икру и личинок в течение 5 дней после выклева. Для личинок он строит специальное второе гнездо — «колыбельку», располагающуюся выше первого. После нереста полупроходная форма уходит зимовать в море, пресноводная остается в пресном водоеме.
Спектр питания широк и сходен с таковым Gasterosteus aculeatus: зоопланктон, бентос, личинки хирономид, моллюски, собственная икра. Является объектом питания щуки, окуня, кумжи, гольцов рода Salvelinus, налима, пеляди, микижи, кижуча, рыбоядных птиц. Pungitius pungitius, хотя и имеет костное вооружение — брюшные и спинные колючки, скрепленные брюшным щитом, восходящим отростком тазового пояса и боковыми пластинами, но на приближение хищных рыб реагирует с большей дистанции, чем Gasterosteus aculeatus, и спасается бегством, укрываясь в зарослях водной растительности. Таким образом, этот вид имеет поведенческие «противохищнические» адаптации.
Является хозяином 49 видов паразитов, относящихся к 5 типам (см. табл. в разделе 2.5). 29 видов из них являются также паразитами Gasterosteus aculeatus. Отличается достаточно высокой эвригалинностью, выдерживает морскую соленость 32 ‰ (Nelson, 1968b). Более устойчива к дефициту кислорода, чем Gasterosteus aculeatus, и к более низким температурам пресной воды, судя по более северному распространению, чем Gasterosteus aculeatus.
Практическое значение. Небольшое. Вылавливается в водоемах тундровой зоны Сибири (в Якутии) и идет на корм ездовым собакам, а также для приманки на пушных зверей. В Финском заливе вылавливается в качестве прилова при лове Gasterosteus aculeatus и идет на рыбную муку. Необходимы интенсификация вылова и использование огромных запасов девятииглой колюшки в северных водоемах, практически не тронутых промыслом.
2 подвида: Pungitius pungitius pungitius (Linne) и Pungitius pungitius laevis (Cuvier).
la. Pungitius pungitius pungitius (Linne) 1758 — Малая, или девятииглая колюшка (рис. 46).
— Gasterosteus pungitius Linne, 1758 : 296 (Европа).
— Pungitius pungitius Berg, 1949 : 906 (описание, синонимия, распространение).
D VII—XII 10—12, А I 8—11, Р (9) 10, V 1, С 12.
Спинных колючек чаще всего 8—10. Тело голое или покрыто в передней части мелкими пластинами. На хвостовом стебле киль есть. Стебель тонкий, вытянутый. Форма его в разрезе овальная, высота больше, чем ширина. В остальном, как Pungitius pungitius.
Изменчивость. Изменчив в отношении числа боковых пластин, жаберных тычинок, структуры тазового пояса, окраски.
Распространение. Циркумполярный подвид. Распространение аналогично описанному для Pungitius pungitius в целом, кроме Ирландии, Юго-Западной Англии, Южной Франции и Греции, где обитает подвид Pungitius pungitius laevis.
Образ жизни. Полупроходной и пресноводный. Соответствует описанному для Pungitius pungitius в целом.
Хозяйственное значение. Вылавливается в небольшом количестве в тундровых водоемах Сибири и идет на корм ездовым собакам, приманку для горностая и подкормку пушных зверей. Промыслом запасы затронуты мало.
Изменчивость окраски девятииглых колюшек рода Pungitius также значительна. Зимой верх головы и спина Pungitius pungitius темно-голубого цвета, бока серебристо-белые с очень мелкими черными пятнышками, сходную окраску имеет и амурская колюшка, Pungitius sinensis, обитающая, как и Pungitius pungitius, вне сезона размножения в открытых частях водоемов. У всех видов и форм девятииглых колюшек рода Pungitius самцы в нерестовый сезон претерпевают одинаковые изменения — тело их становится черным (спина, бока тела и брюхо), а брюшные колючки белыми (они являются ориентиром для самки при ведении ее к гнезду). Тем не менее различия между видами наблюдаются и по брачной окраске самцов. Так, брюшные колючки Pungitius pungitius приобретают интенсивную голубовато-белую окраску и хорошо различимы в воде, у самцов же Pungitius platygaster вся передняя часть брюшных колючек темного цвета, светлеет лишь задняя, обращенная к самке во время ведения ее к гнезду. Внутри вида Pungitius pungitius имеется межпопуляционная изменчивость по брачной окраске самцов: в отличие от самцов «типичных» популяций, самцы из озера Гурон (Великие озера), где отсутствует зона растительности, не становятся черными по всей поверхности тела; вместо этого на брюшной стороне тела развивается «серый лоскут», на фоне которого хорошо заметны голубовато-белые колючки. Этот «лоскут» становится блестяще-черным во время фазы ухаживания и охраны икры.
Популяции Pungitius pungitius с высокой частотой фенотипов с редуцированным тазовым поясом найдены в 5 районах ареала: в бассейне р. Солт (Северо-Восточная Канада), бассейне р. Шэннон (Ирландия) (Nelson, 1971а), бассейне р. Сперхиос (Греция) (Stephanidis, 1971), бассейне Кандалакшского залива Белого моря (Зюганов, 1989) и в бассейне р. Тымь (Сахалин) (Таранец, 1937). Это явно свидетельствует о политопном происхождении редукции таза. В канадских выборках из бассейна р. Солт наблюдался следующий размах изменчивости тазового пояса: от полной выраженности через присутствие одной из колючек и части брюшной пластины до наличия лишь остатка одной маленькой косточки брюшной пластины (Nelson, 1971а).
В 10 ирландских популяциях, обнаруживающих редукцию таза, 86% особей были лишены таза вообще (суммарно для всех популяций), 6.5% имели промежуточную степень редукции и 7.5% имели нормальный тазовый пояс (всего n=109) (Nelson, 1971b). Среди 3 популяций бассейна р. Солт (Канада), имеющих ту или иную степень редукции таза, 1 (оз. Фокс Хольс) обнаружила 100%-ное отсутствие таза, а в 2 других примерно 30% особей имели полную или частичную редукцию (Nelson, 1971b). Судя по канадским и ирландским выборкам, редукция таза возникает в одном бассейне реки, а популяции из сопредельных бассейнов такой редукции не обнаруживают. Коад (Coad, 1973) на большом числе выборок, собранных на востоке и северо-западе Канады, обнаружил, что феномен редукции пояса имеет место во многих популяциях, но с очень низкой частотой — около 2%. Видимо, «редуцированные» фенотипы достигают высокой частоты в каких-то отдельных географических точках, где для них имеются благоприятные условия. Попытки определить, что это за условия, пока больших успехов не имели. Нельсон (Nelson, 1971b) отмечал некоторое уменьшение у «редуцированных» фенотипов длины брюшных, спинных колючек и расстояния между основаниями брюшных колючек, однако это уменьшение укладывается в размах изменчивости тех же признаков у «нормальных» фенотипов. Белл (Bell, 1984) полагает, что уменьшение у «редуцированных» фенотипов вышеуказанных 3 признаков в совокупности приводит к уменьшению поперечной площади сечения рыбы. По его мнению, все это связано с различиями в интенсивности давления хищничества на разные фенотипы и отражает отбор структуры тазового пояса у Pungitius. Однако Gasterosteus aculeatus, симпатричная с ирландскими популяциями Pungitius (с редуцированным тазом), имеет нормальный тазовый пояс, в то время как Culaea inconstans, симпатричная с одной из канадских популяций Pungitius pungitius с редуцированным поясом, также полностью утратила pelvis, и редукция pelvis у Culea из этого региона Канады — обычное явление (Nelson, 1971b). В Греции в бассейне р. Сперхиос обитает Pungitius pungitius с редуцированным тазовым поясом (причем есть серия переходов от наличия брюшной пластины до наличия лишь одной — остатков левой или правой небольшой косточки pelvis). В том же водоеме обитает Gasterosteus aculeatus с нормальным pelvis (Stephanidis, 1971).
На территории СССР редукция тазового пояса у Pungitius pungitius отмечена только для Северной Карелии (Лоухский р-н, побережье Кандалакшского залива, Белое море). Интересно, что 100%-ную утрату таза обнаруживают не только озерные пресноводные популяции (озера Машинное, Безымянное), но и солоноватоводная форма из морских заливов (губа Чупа, Левин Наволок). Если редукцию таза у озерных популяций и можно объяснить отсутствием пресса хищников в озерах, то для морской популяции это объяснение не годится, поскольку в прибрежной зоне Белого моря разнообразие хищников велико: навага, сельдь, бельдюга, маслюк, различные бычки, тресковые и т. д. (Алтухов и др., 1958). Кроме того, в тех же озерах (например, Машинное, Безымянное), где нет других видов хищных рыб, симпатрично обитают популяции трехиглой колюшки с нормальным тазовым поясом.
Несмотря на то что брюшные колючки играют у колюшек важную сигнализирующую роль при нересте (например, ярко-белые брюшные колючки самца Pungitius pungitius на фоне угольно-черного тела помогают ориентированию самки при ведении ее самцом к гнезду), диморфизм (присутствие — отсутствие колючек) не приводит к репродуктивной изоляции между этими двумя фенотипами. Например, групповые скрещивания между самцами Pungitius pungitius из р. Сходня (с колючками) и самками из оз. Машинного (без колючек), а также реципрокное скрещивание в небольших изолированных прудах дали плодовитое потомство (Зюганов, Розанов, 1987).
Плечевой пояс колюшковых состоит из следующих костей: cleithrum, scapula, coracoid и ectocoracoid, а также костей posttemporale и supracleithrum, связывающих грудной скелет с черепом (рис. 9). Лучи грудного плавника, за исключением самого верхнего, сочленены с 4 actinost (radialii), которые расположены сразу же за scapula и coracoid. Наиболее дорсально расположенная posttemporale (на самом деле являющаяся костью головного отдела) примыкает к черепу. Связь posttemporale с черепом самая прочная у Gasterosteus aculeatus, а самая непрочная у Culaea; у других родов степень прочности сочленения промежуточна. У Gasterosteus wheatlandi posttemporale отсутствует, у Gasterosteus aculeatus она имеет ромбическую форму. Supracleithrum — маленькая узкая кость, которая связана с posttemporale и cleithrum. Cleithrum у всех колюшковых имеет вид длинной и прямой рукоятки с широкой треугольной головкой в верхней дорсальной части кости (Nelson, 1971а). Gasterosteus, Spinachia и Pungitius имеют cleithrum сходной формы: широкий край заднего конца рукоятки с острым дорсальным выступом на головке. Pungitius и Gasterosteus имеют гребень на заднем конце scapula, а под ним расположены несколько actinost. Coracoid расположен под scapula. В переднем отделе coracoid колюшковых нет отверстия, но следы его обнаружены у Apeltes, Culaea и Pungitius. У ближайших родственников колюшек — рыб сем. Aulorhynchidae — отверстие coracoid хорошо развито. Ectocoracoid (= infracleithrum) — наиболее вентрально расположенная кость плечевого скелета. У взрослых особей колюшек она частично сливается с вентральной частью coracoid. У Gasterosteus, Pungitius и Spinachia ectocoracoid вытянут вперед, вниз и по направлению к срединной линии тела рыбы.
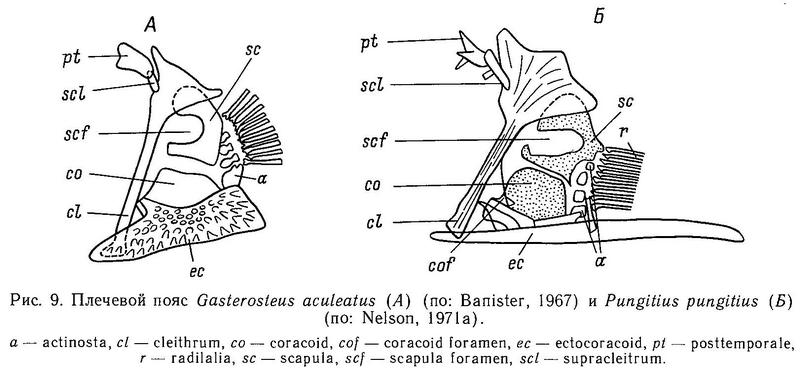
Ectocoracoid у Gasterosteus имеет треугольную форму, а у Pungitius и Spinachia — эта длинная и тонкая кость.
В целом наиболее сходные грудные скелеты (плечевые пояса) имеют Gasterosteus и Pungitius.
Эмбриональное развитие девятииглой колюшки Pungitius pungitius идет по той же схеме, что и у трехиглой колюшки, и в целом развитие обоих видов сходно. Различия между ними незначительны: диаметр икринок Pungitius pungitius (1.3—1.5 мм) меньше, чем у трехиглой (1.6—1.8), желточный мешок у Pungitius pungitius менее интенсивно окрашен. У предличинок Pungitius pungitius туловищных сегментов меньше (14), чем у Gasterosteus aculeatus (16), а хвостовых миотомов больше (16—18), чем у Gasterosteus aculeatus (14). Пигментация предличинок у Pungitius pungitius сильнее, чем у Gasterosteus aculeatus (Василевская, 1971). В отличие от Gasterosteus aculeatus эмбриональное развитие Pungitius pungitius идет несколько более быстрыми темпами: при температуре 13—17 °С выклев наступает на 7-е сутки (Василевская, 1971). При 18—19 °С выклев наблюдался на 4—5-е сутки (Morris, 1958).
Возрастная структура Pungitius pungitius сходна с таковой Gasterosteus aculeatus. Судя по отолитам, Pungitius pungitius из р. Биркет (Англия) живет 3.5 года и нерестится впервые на следующее лето после рождения (Jones, Hynes, 1950). Pungitius pungitius из оз. Икроавик (Аляска, США) живет 2.5 года (Cameron et al., 1973). Сходная возрастная стуктура наблюдается у Pungitius pungitius из р. Матамек (Восточная Канада) (Coad, Power, 1973d). В оз. Верхнем (Великие Озера, США) были найдены 5-летние самки, но самцы доживают лишь до 3-летнего возраста (Griswold, Smith, 1973). По нашим данным (Зюганов, 19846; Зюганов, Гомелюк, 1985), Pungitius pungitius из р. Сходня (Московская обл.) достигает половозрелости в годовалом возрасте, гибриды Pungitius pungitius х Pungitius platygaster, интродуцированные в карьеры на Беломорском побережье, также нерестились на следующее лето при длине 35—39 мм.
Начальная скорость роста Pungitius pungitius из р. Биркет (Англия) одинакова с симпатричной Gasterosteus aculeatus, но после первого года рост у нее почти прекращается (48 мм у трехгодовика против 46 мм у годовиков) (Jones, Hynes, 1950). Рыбы из североамериканских популяций Pungitius pungitius (оз. Икроавик, Аляска, — Cameron et al., 1973), из оз. Матамек, Канада (Coad, Power, 1973d), оз. Верхнее, Великие Озера, США (Griswold, Smith, 1973) достигают за год также длины 45 мм, но в последующие годы растут быстрее, достигая длины 80 мм.
2.3. ПИТАНИЕ
Пищевой спектр трехиглой колюшки из разных районов Европы, Азии и Сев. Америки довольно широк, и преобладание в спектре тех или иных пищевых компонентов зависит от конкретных пищевых ресурсов в каждом водоеме. Такой широкий спектр питания трехиглой колюшки приводит к неизбежной конкуренции с другими видами рыб, и прежде всего с девятииглой колюшкой Pungitius pungitius.
В р. Биркет (Англия) Gasterosteus aculeatus и Pungitius pungitius имеют сходные спектры питания и даже сходные количественные соотношения пищевых объектов по частоте встречаемости и по весовому выражению, за исключением того, что Pungitius pungitius меньше питается водорослями. Однако в сезон размножения Gasterosteus aculeatus предпочитает более открытые места, а Pungitius pungitius уходит в зону густой вегетации водных растений в литоральной зоне водоема, что уменьшает конкуренцию между ними.
В оз. Матамек (провинция Квебек, Канада), где Pungitius pungitius и Gasterosteus aculeatus также симпатричны, Pungitius pungitius питается кладоцерами и хирономидами в литоральной зоне, a Gasterosteus aculeatus — пелагическим зоопланктоном (Coad, Power, 1973d). Личинки хирономид, кладоцеры, копеподы и другие виды зоопланктона формируют летний спектр питания Pungitius pungitius из оз. Икроавик (Аляска, США) (Cameron et al., 1973). Напротив, Pungitius pungitius из оз. Верхнее (Великие Озера, США) питается главным образом амфиподой Pontoporea affinis и мизидой Mysis relicta, а кладоцеры и личинки хирономид составляют незначительную долю в ее питании (Griswold, Smith, 1973).
Состав пищи Pungitius pungitius из Каунасского водохранилища (Литва) более простой, чем у симпатричной трехиглой колюшки: личинки хирономид, гаммарусы, кладоцеры и моллюски (Бубинас, 1979). Pungitius pungitius из водоемов Якутии питается в основном мелкими личинками хирономид и планктонными рачками (Cyclops, Bosmina, Chydorus) (Кириллов, Тетерин, 1979).
Противохищнические адаптации. Такие факторы противохищнических адаптаций, как число, длина и крепость спинных и брюшных колючек, механизм фиксации в выпрямленном положении колючек, число боковых пластин, размер колюшек и окраска, рассмотрены ранее в соответствующих разделах (1.1, 1.4, 1.6, 1.7). Все эти «морфологические» адаптации лучше всего реализованы у трехиглой колюшки, и экспериментально доказано, что при наличии выбора в аквариуме хищники (окунь и щука) предпочитают охотиться на гольяна (Phoxinus phoxinus), красноперку (Scardinius erythrophtalmus), карася (Carassius carassius) и в последнюю очередь на девятииглую колюшку Pungitius pungitius, избегая Gasterosteus aculeatus (Hoogland et al., 1957). Однако если колюшкам отрезали колючки, то хищники выедали их так же, как и остальных рыб. Колючки для Pungitius pungitius менее надежная защита, чем для Gasterosteus, но все же девятииглая колюшка в эксперименте меньше выедалась, чем рыба с мягкими плавниками.
Pungitius pungitius по сравнению с Gasterosteus «опирается» в большей степени на поведенческие адаптации; она реагирует на хищника с большего расстояния и старается скрыться в зарослях растений. Pungitius pungitius имеет сходный с Gasterosteus aculeatus набор хищников (Scott, Crossman, 1973).
Девятииглая колюшка Pungitius pungitius является хозяином 43 видов паразитов. Ниже приведен список паразитов девятииглой колюшки для водоемов СССР (по: Определитель, 1962; Определитель, 1975).

Интересно, что в пределах СССР, судя по Определителю (1962), у Gasterosteus aculeatus и Pungitius pungitius 29 видов общих паразитов, что составляет примерно 60 % перекрывания между двумя видами колюшковых.
Баниной и Исаковым (1972) проанализированы закономерности становления паразитофауны трехиглой и девятииглой колюшек дельты р. Невы. Авторы отмечают сходство их паразитофауны как по видовому составу, так и по срокам заражения тем или иным видом паразита. Отличительная черта паразитофауны колюшек — необычайное обилие эктопаразитических инфузорий не только у молоди, но и у взрослых рыб. Это, по мнению авторов, объясняется малыми размерами рыб, отсутствием чешуи, что облегчает прикрепление эктопаразитических простейших. Гнездовое выращивание молоди колюшек самцом приводит к раннему заражению личинок колюшек триходинами и апиозомами от самца. В результате у колюшек молодь 3—4-дневного возраста (в котором у других видов рыб начинают проявляться только первые паразиты) оказывается сильно зараженной. Из других факторов, способствующих формированию богатой паразитофауны колюшек, авторы называют растянутость нереста (молодь от позднего нереста имеет возможность заражаться не только от взрослых рыб, но и от молоди более старшего возраста), стадный образ жизни, обитание в водоемах, богатых растительностью и содержащих повышенное количество органических веществ и бактерий. К факторам, перечисленным этими авторами, можно добавить еще и широкий спектр питания колюшковых. Несомненно, он способствует обогащению паразитофауны эндопаразитов колюшковых.
Девятииглая и трехиглая колюшки, как оказалось, могут играть роль в эпидемиологии дифиллоботриза, распространяя личинок широкого лентеца (Diphyllobotrium latum, Diphyllobotrium norvegicum) среди хищных рыб (щука, налим, окунь). В очагах массового скопления колюшки могут играть существенную роль. Из дифиллоботриид, паразитирующих у человека, колюшки легко заражаются лентецами: широким (Diphyllobotrium latum), чаечным (Diphyllobotrium dentdriticum) и норвежским (Diphyllobotrium norvegicum), причем экстенсивность инвазии в Карелии достигает 70 %. В то же время колюшки не представляют опасности для непосредственного заражения человека, так как не используются в пищу (Гофман-Кадошников и др., 1963).
Близкий вид паразита, Schistocephalus pungitii, поражает девятииглую колюшку, а экспериментальное заражение девятииглой колюшки Schistocephalus solidus приводило к гибели паразита из-за сильной иммунной реакции хозяина (Огг, 1968).
Вредные эффекты остальных паразитов на колюшек менее очевидны. Возможно, крупные цисты Glugea anomala (Sporozoa, Protozoa) — эндопаразиты в соединительной ткани трехиглой и девятииглой колюшки — мешают плаванию рыб, а метацеркарии ряда видов Diplostomum (Diplostomum spataceum, Diplostomum gasterostei, Diplostomum scudderi — Digenea, Plathyhelmintes) — эндопаразиты глаз Gasterosteus aculeatus и Pungitius pungitius — затрудняют зрение рыб, облегчая выедание их птицами — окончательными хозяевами (Arme, Oven, 1967; Lester, 1974).
Анадромные нерестовые миграции девятииглой колюшки Pungitius pungitius в литературе описаны не были. Известно, что подавляющее большинство популяций Pungitius pungitius обитает в пресных водах Евразии и Сев. Америки (Wootton, 1976). Однако Мак-Фейл (McPhail, 1963) обнаружил в Канаде прибрежную солоноватую форму (которую он называет берингийская). Мной наблюдалась солоноватоводная форма Pungitius pungitius на Белом море (Кислая губа, губа Чупа) в распресненных участках морских заливов, а также в солоноватых лагунах на о. Сахалин (Тунайча, Анива, Хангузе). Весной 1975—1978 гг. (май — начало июня) мне приходилось наблюдать нерестовый ход Pungitius pungitius из морского залива Кислая губа в пресное оз. Ершовское (близ Беломорской биостанции МГУ), а в июне 1983—1984 гг. нерестовый ход из зал. Левин Наволок в пресный ручей (близ пос. Чкалов Лоухского района Карельской АССР, губа Чупа). Очевидно, солоноватоводная форма Pungitius pungitius способна к небольшим анадромным миграциям.
У пресноводной Pungitius pungitius в том же эксперименте верхний предел солеустойчивости был равен сответственно 32 и 26 ‰. В Саскачеване (Канада) верхний предел солеустойчивости Pungitius pungitius был 20 ‰ (Nelson, 1968b). Мюнцинг (Munzing, 1966) полагает, что Pungitius pungitius нерестится лишь в пресной воде, однако я наблюдал размножение Pungitius pungitius в солоноватых озерах на Северном Сахалине (лагуна Хангузе, в 5 км от г. Оха) при солености 18 ‰. Близ Беломорской биостанции МГУ (Кандалакшский залив Белого моря) в проливе, отделяющем о. Еремеевский от материка, на мелководье также происходит нерест Pungitius pungitius при колебаниях солености 5—21 ‰. Culaea inconstans (пресноводный североамериканский эндемик) имеет верхний предел солеустойчивости 21 ‰ при 22 °С (Armitage, Olund, 1962) и, по данным Нельсона (Nelson, 1968b), 21 ‰ при 8 °С и 15 ‰ при 16 °С.
Описана популяция Pungitius pungitius в оз. Гурон (США), где нет укореняющихся растений в литоральной зоне (Gasterosteus aculeatus отсутствует) и самцы строят гнезда на грунте в расщелинах между камней. Кроме того, у гуронских самцов отсутствует элемент «поверхностное склеивание». Возможно, изменения в гнездостроительном поведении колюшек из оз. Гурон необратимы и генетически закреплены, так как в эксперименте при наличии выбора (когда самцам предлагались и укореняющиеся растения на песке, и каменный субстрат) они строили гнезда на грунте (McKenzie, Keenleyside, 1970). Самцы Pungitius pungitius из оз. Верхнее, пойманные в природе с илистого субстрата, где не было укореняющихся растений, а только слой водорослей (Nitella), также строили гнезда в аквариуме на грунте (Griswold, Smith, 1972, 1973).
Интересно, что интродукция 40 (20 самцов + 20 самок) основателей Pungitius pungitius из р. Сходня (Московская обл.), где самцы строят гнезда среди растений, в водоем, лишенный укореняющихся растений (карьер на побережье Белого моря), привела к тому, что самцы свободно перешли к постройке гнезд на грунте среди расщелин камней, как и в оз. Гурон. Обратное вселение самцов из карьера в водоем, имеющий растительность, привело к тому, что самцы снова стали строить гнезда среди растений. Это предполагает пластичность гнездостроительного поведения любой популяции Pungitius pungitius и приводит к заключению, что норма реакции по признаку «выбор субстрата для гнезда» весьма широка (Зюганов, 1986). Если нет привычного субстрата (растений), то в необычных условиях популяция перестраивается на «эксплуатацию» другого нерестового субстрата. Вуттон (Wootton, 1976) также полагает, что тип гнездостроительного поведения Pungitius — относительно пластичный признак, но приходит к выводу, что этот «тип» зависит от условий, в которых популяция эволюировала. Однако наши данные показывают, что это совсем не обязательно, и даже популяция, долгое время обитающая в «типичных» условиях, при попадании в необычные условия среды может изменить тип гнездостроительного поведения.
Сексуальная фаза Pungitius pungitius (как и у Gasterosteus) начинается только после завершения последнего элемента гнездостроительной фазы «проползание через гнездо». Сексуальное поведение Pungitius pungitius состоит из тех же элементов, что и у Gasterosteus aculeatus, но выполнение 3 (из 5) элементов иное. Так, при «зигзаг»-танце самец находится в позиции «головой вниз», что сходно с Gasterosteus wheatlandi более, чем с Gasterosteus aculeatus. В «зигзаг»-танце самец скачет вперед и одновременно вбок и вверх. Поза самки «головой вверх» аналогична таковой Gasterosteus aculeatus. Элемент самца «ведение к гнезду» опять же ближе таковому Gasterosteus wheatlandi — самец плывет медленно и по извилистой линии. Самка следует за ним в позе «головой вверх» (как и самка Gasterosteus wheatlandi), касаясь рылом брюха самца, причем угольно черное тело и выпрямленные ярко-белые брюшные колючки самца служат самке хорошим ориентиром в густых зарослях. Партнеры во время «ведения к гнезду» расположены ближе, чем у Gasterosteus aculeatus. На этом сходство с Gasterosteus wheatlandi заканчивается. При показе входа в гнездо самец помещает кончик рыла непосредственно над входом в гнездо, делает несколько глотательных движений и начинает вентиляцию гнезда грудными плавниками. Этот элемент по своей структуре не имеет ничего общего у Pungitius с Gasterosteus. Далее самка проникает в гнездо и самец «трясет» ее, как и у Gasterosteus. После вымета икры и покидания гнезда самкой самец проникает в гнездо и осеменяет икру, а затем прогоняет самку со своей территории (Leiner, 1931b; Morris, 1958). Самцы Pungitius значительно менее агрессивны, чем Gasterosteus aculeatus, у них отсутствуют также «dorsal pricking» и дополнительный цикл гнездовой активности во время фазы ухаживания (Wilz, 1971). В элементах ухаживания у Pungitius pungitius имеется межпопуляционная изменчивость. Так, у грунтогнездующих самцов в лишенном зарослевой зоны литорали оз. Гурон элемент «ведение к гнезду» выглядит как прямой бросок, т. е. аналогично таковому Gasterosteus aculeatus. Самка при этом следует за самцом не так близко, как у типичной Pungitius pungitius, в слабо выраженной позиции «голова вверх». У самцов не развивается угольно-черной брачной окраски, а на брюхе выражен лишь «серый лоскут». При показе входа в гнездо самке самец не вентилирует его, как типичный самец Pungitius pungitius (McKenzie, Keenleyside, 1970). Все это может привести к репродуктивной изоляции с остальными популяциями Pungitius.
Внутри рода Pungitius имеются и межвидовые различия в элементах ухаживания. Так, самцы Pungitius platygaster малой южной колюшки, чей образ жизни носит еще более скрытный, чем у Pungitius pungitius, зарослевый характер, отличаются от Pungitius pungitius менее броским рисунком «зигзаг»-танца и отсутствием характерных движений «твистинг», наблюдающихся у Pungitius pungitius при ведении самки к гнезду. («Твистинг» — резкие изгибания тела самца, стоящего на месте, побуждающие остановившуюся самку следовать за ним к гнезду). Нерест Pungitius platygaster носит более маскирующий, криптический характер, чем у Pungitius pungitius (у самок сохраняется камуфлирующая окраска, у самцов светлеет лишь задняя часть брюшных колючек, обращенная к самке во время ведения к гнезду). Нерест Pungitius platygaster имеет тенденцию к более быстрому завершению (самец подводит самку к гнезду в среднем за 10 с против 25 с у Pungitius pungitius) (Гомелюк, 1978). Впрочем, эти различия не означают, что между двумя видами выработалась репродуктивная изоляция: в эксперименте самки и Pungitius pungitius, и Pungitius platygaster равновероятно выбирали конспецифичных и «чужих» самцов; искусственно созданная в пруду гибридная популяция Pungitius pungitius х Pungitius platygaster существует в течение нескольких поколений, и гибриды плодовиты (Зюганов, Гомелюк, 1985). Видимо, дифференциация двух этих форм не дошла до видового уровня (подробнее этот вопрос будет рассмотрен в разделе 4.5.6).
Фостер (Foster, 1977), используя тесты по предпочтению, в аквариумных условиях обнаружил, что 3 аллопатрические формы Pungitius pungitius (берингийская, миссисипская и европейская — Pungitius pungitius laevis) в значительной степени репродуктивно изолированы. Более подробно его данные будут обсуждены также в разделе 4.5.6.
Выше уже отмечалось, что, несмотря на возможность получения гибридов Gasterosteus aculeatus х Pungitius pungitius искусственным путем (Leiner, 1940, 1934; Kobayashi, 1962), в природе они не найдены (Wilz, 1970с), хотя оба вида живут буквально бок о бок во многих водоемах Европы, Восточной Азии и Сев. Америки, но предпочитают разные биотопы для нереста. В тестах по предпочтению самцы Gasterosteus aculeatus и Pungitius pungitius ухаживали за самками обоих видов равновероятно, но самки прерывали свое следование за самцом «чужого» вида на стадиях «ведение к гнезду» и «показ входа в гнездо» (Wilz, 1970с). К тому же гибриды первого поколения, полученные в лаборатории, имели повышенную смертность на ранних стадиях развития (Kobayashi, 1962), а выращенные до взрослого состояния были стерильны, и самцы не могли строить гнезда (Leiner, 1940).
О том, насколько важную роль играет забота о потомстве у колюшковых, свидетельствует сравнение процента вылупления молоди из икры, выведенной в гнезде самцом и выращенной в искусственных и благоприятных (с точки зрения экспериментатора) условиях. Так, икра, полученная от самок Pungitius pungitius, оплодотворялась в чашках Петри сухим способом и помещалась в садках из мельничного газа в аквариумы с хорошей аэрацией (с помощью микрокомпрессоров). Для предотвращения поражения икры грибками вода обрабатывалась высококачественными импортными противогрибковыми препаратами, погибшие икринки ежедневно удалялись из кладок. Тем не менее процент вылупления не превышал 30—40 % (в лучшем случае 65 %). В той же воде (только не обработанной лекарствами, не аэрируемой и не проточной) в соседних аквариумах у самцов колюшек, выводивших икру от тех же самок в гнезде, процент вылупления был близок к 100 %! (личные аквариумные наблюдения автора).
Родительская фаза Pungitius pungitius сходна в общих чертах с Gasterosteus. Самец охраняет гнездовую территорию, преследует и кусает вторженцев. Главная поза угрозы — головой вниз, тело боком повернуто к противнику, брюшная колючка выпрямлена. У Pungitius в отличие от Gasterosteus эрекция брюшных колючек коррелирует с тенденцией к атаке (Morris, 1958). Потерпевший поражение в схватке самец принимает позу «хвост вниз» и теряет черную окраску (Barraud, 1955). После оплодотворения икры самец проталкивает икру глубже в гнездо. Затем в течение 1—2 ч самец занимается вентиляцией икры, после чего он готов принять в гнездо следующую кладку икры. Во время родительского цикла вентиляция икры становится главным компонентом родительской активности и достигает пика перед вылуплением. Тем не менее Pungitius проводит меньше времени, занимаясь вентиляцией, чем Gasterosteus. Вуттон (Wootton, 1976, с. 283) полагает, что это связано с тем, что гнездо Pungitius находится не на субстрате и окружено живой фотосинтезирующей тканью растений, т. е. в более благоприятном кислородном режиме. Вместе с тем он сам же (Wootton, 1976, с. 284) приводит два веских довода против этого объяснения: 1) у грунтогнездующих Pungitius pungitius оз. Гурон (McKenzie, Keenleyside, 1970) количество времени, затрачиваемого на вентиляцию, все равно меньше, чем у Gasterosteus, 2) у грунтогнездующих Gasterosteus wheatlandi количество времени, затрачиваемого на вентиляцию, сравнимо с таковым Pungitius pungitius (Mclnerney, 1969). Добавим к этому, что Apeltes, гнездующая на растениях (так что ее икра находится в условиях благоприятного газового режима), почти не отличается по этому показателю от Gasterosteus aculeatus (Mclnerney, 1969; Rowland, 1974). В итоге Вуттон приходит к обоснованному, на мой взгляд, выводу, что причины надо искать в таких факторах, как скорость метаболизма икры, размер кладки, количество яиц в гнезде и эффективность вентиляции гнезда. Несмотря на меньшее количество времени, затрачиваемое на вентиляцию икры, молодь Pungitius pungitius вылупляется на 6—7-й день после оплодотворения при 16 °С и на 4—5-й день при 19 °С, так что срок инкубации икры у Pungitius pungitius короче, чем Gasterosteus aculeatus (Morris, 1958).
Кроме вентилирования самец во время родительской фазы удаляет мертвые икринки и возвращает обратно выпавшие из гнезда на грунт (Morris, 1958). Главное отличие родительского цикла Pungitius от Gasterosteus состоит в том, что Pungitius после вылупления молоди строит над гнездом «колыбельку» (специальную ловушку для молоди), куда помещает вылупившихся предличинок. «Колыбелька» строится из растительного материала, часто используется материал из гнезда. Через 3—4 дня после вылупления молодь всплывает на поверхность для заполнения воздухом плавательного пузыря и постепенно рассеивается среди растений, так что самцу становится все труднее хватать личинок ртом и выплевывать в «колыбельку». Через 1—2 дня самец «теряет» родительское поведение и готов к следующему нересту (Morris, 1958). Во время родительской фазы сексуальное поведение у Pungitius прекращается, а агрессивное усиливается, как и у Gasterosteus, причем фактором, вызывающим агрессию — «рилизинг-фактором» у Pungitius является черный цвет, так же, как у Gasterosteus — красный (Morris, 1958). «Налеты на гнезда» у Pungitius так же имеют место, как и у Gasterosteus, и впервые были описаны Моррисом (Morris, 1952) именно у Pungitius pungitius.
3. ГЕОГРАФИЧЕСКОЕ РАСПРОСТРАНЕНИЕ И ИСТОРИЯ ФАУНЫ
Все представители семейства колюшковых обитают в прибрежных морских и пресных водах северного полушария: в бассейнах Атлантического, Северного Ледовитого и Тихого океанов. В бассейнах Атлантического и Тихого океанов распространение колюшковых амфибореальное — они обитают в северных частях этих океанов и не спускаются южнее 32° с. ш. Самыми обширными ареалами обладают 2 -вида: Gasterosteus aculeatus и Pungitius pungitius, которые распространены и в восточном, и в западном полушарии в бассейнах всех трех океанов. Трудно сказать, ареал какого их этих видов больше по площади: если Pungitius pungitius явно держит первенство по распространенности в пресных водах, то Gasterosteus aculeatus доминирует в морских водах (рис. 21, 22).
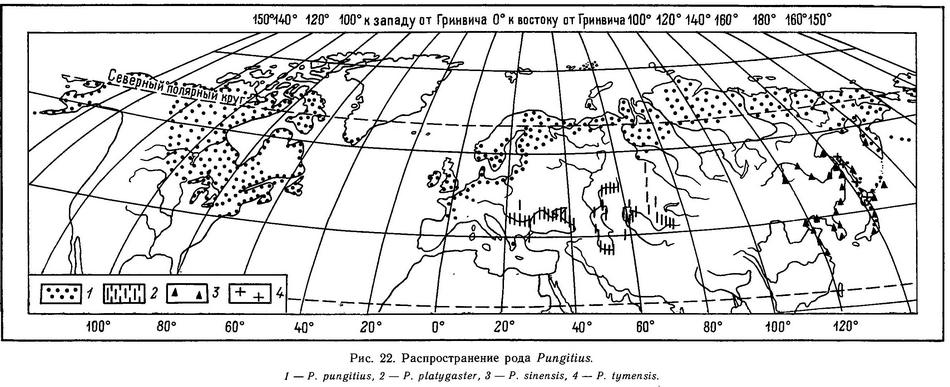
Pungitius pungitius (морфа leiurus с килем) как уже отмечалось, по масштабу ареала соперничает с Gasterosteus aculeatus. Pungitius pungitius более пресноводный вид и более северный. Это циркумполярный вид, распространенный по всему арктическому побережью Евразии и Сев. Америки. В Европе распространен до Южной Франции (бассейны рек Лауры и Роны) и в бассейнах Северного, Балтийского, Норвежского, Баренцева, Белого морей, Англии, Ирландии. В Исландии отсутствует (Берг, 1949; Münzing, 1969) (рис. 22). В Ирландии, Северо-Западной Англии и Южной Франции — подвид Pungitius pungitius laevis (морфа hologymna — голая и без киля) (Münzing, 1969). В Азии по Сибирскому побережью Северного Ледовитого океана, Чукотка, Камчатка, материковое побережье Охотского моря на юг до устья р. Амур. Есть на островах Шантарских, Курильских, Сахалине (СССР), Хоккайдо, Хонсю до южной оконечности (Япония) (Берг, 1949). В Сев. Америке Pungitius pungitius почти не встречается на Тихоокеанском побережье (кроме Алеутских островов, п-ова Аляска и о. Кадьяк); к востоку от Аляски — в р. Маккензи, Медвежьем и Большом Невольничьем озерах. Далее на восток девятииглая колюшка распространена по берегам Гудзонова залива, Баффиновых островов и по Атлантическому побережью на юг до штата Нью-Джерси (южнее Нью-Йорка). В континентальной части Сев. Америки она распространена в Великих Озерах (кроме оз. Эри), в канадских провинциях Манитоба, Квебек, Онтарио, Виннипег, Альберта, Саскачеван, а также в верховьях р. Миссисипи (штат Индиана, США) (McPhail, 1963). Найдена в южной части Гренландии (McPhail, Lindsey, 1970) (рис. 22).
В последнее десятилетие ареалы Pungitius pungitius и Pungitius platygaster оказались нарушенными в результате деятельности человека. Так, Pungitius pungitius попала в р. Сходня (приток р. Ока, Московская обл.), а Pungitius platygaster из р. Нура попала в р. Ишим и поднялась на север до р. Иртыш (приток р. Обь), где в районе Тобольска возможен ее контакт с Pungitius pungitius (Зюганов, 1984а).
В Сев. Америке четко различаются две формы Pungitius pungitius, имеющие морфологические различия подвидового ранга. Берингийская форма имеет до 5 пластин на теле, больше спинных колючек и меньше жаберных тычинок, чем миссисипская форма, у которой отсутствуют пластины на теле; обе формы мономорфны по наличию киля (McPhail, 1963). Первая форма имеет прибрежное распространение от Аляски до Атлантического побережья, вторая распространена более континентально: Великие Озера (США), оз. Виннипег, бассейн р. Маккензи (Канада). Мак-Фейл (McPhail, 1963) полагает, что берингийская форма распространилась из берингийского рефугиума на восток, а миссисипская — на северо-запад и северо-восток после отступления ледника в плейстоцене (Висконсинское оледенение). Хотя период изоляции между двумя формами был недостаточным для видообразования, и эти формы способны к гибридизации. Мак-Фейл (McPhail, 1963) считает, что морфологические различия между ними имеют генетическую основу. Но, воздерживаясь от придания им таксономического подвидового статуса, Фостер (Foster, 1977) экспериментально показал, что между ними есть почти полная поведенческая репродуктивная изоляция.
Позвонки. Скрещивания малопозвонковой (М=30.2) Pungitius platygaster и многопозвонковой (М=33.0) Pungitius pungitius дают потомство F1 с промежуточным числом позвонков (М=30.9) (Зюганов, 1984б).
Спинные колючки. По числу спинных колючек есть высокодостоверные различия между Pungitius tymensis (М=10.8) и Pungitius pungitius (М=8.8). Скрещивание самка Pungitius tymensis х самец Pungitius pungitius дало в F1 среднее число колючек 10.5 (материнский эффект), а реципрокное скрещивание выявило среднее число спинных колючек у гибридов 9.8 (промежуточное наследование) (Kobayashi, 1957). Длина спинных колючек у Pungitius tymensis (3.7 % от длины тела) намного короче, чем у Pungitius pungitius (5.8) и Pungitius sinensis (6.1). Межвидовых гибридов первого поколения tymensis х sinensis и tymensis х pungitius очень легко отличить по этому признаку: казалось бы, все колючки у гибридов должны быть промежуточной длины, однако у гибридов короткие колючки чередуются с длинными (аддитивный эффект) (Kobayashi, 1957, с. 375) (рис. 32).

Похожими были результаты межродовых скрещиваний Лейнера (Leiner, 1934) Gasterosteus aculeatus х Pungitius pungitius, гибриды имели от 3 до 8 колючек, и короткие колючки (влияние генов Pungitius) чередовались с длинными колючками (влияние Gasterosteus).
Тазовый пояс. Нами были проведены групповые скрещивания между особями с нормально развитым тазом и брюшными колючками и особями, лишенными таза и колючек. В одном карьере «Рецессивный» было поставлено скрещивание: 45 самок «норма» (из р. Сходня Московской обл.) х 30 самцов «редукция» (из оз. Машинное, Белое море). В другом карьере «Реципрокный» было поставлено реципрокное скрещивание: 15 самок «редукция» (из морского залива Левин Наволок, Белое море) х 30 самцов «норма» (из р. Сходня). Результаты в обоих случаях оказались одинаковыми: в F1 в обоих карьерах оказались только особи «норма» с тазовым поясом и брюшными колючками (n=115 для «Рецессивного» и n=86 для «Реципрокного» карьеров). Примерно у 30 % особей F1 из обоих карьеров наблюдалась асимметрия в длине левой-правой брюшных колючек, однако до полной редукции одной из колючек дело дошло только у одной особи. Затем из карьера «Рецессивный» было отсажено в другой водоем — «Смешанный» 15 самцов и 20 самок потомков F1 от этого скрещивания, имеющих фенотип «норма». В следующем году были выловлены в этом водоеме колюшки F2 — потомки от скрещивания гетерозигот самих на себя. Особи F2 имели следующие фенотипы: 116 «норма», 4 «промежуточные», 19 «редукция» (83.4 : 2.8 : 13.8%). Необходимо дальнейшее изучение наследования этого признака (Зюганов, Розанов, 1987).
У колюшковых имеется интересный случай межродового параллелизма по некоторым признакам репродуктивного поведения. Так, известно, что Gasterosteus aculeatus строит гнезда на грунте, не сооружает «колыбельку» и во время ухаживания ведет самку к гнезду по прямой линии (Van Iersel, 1953). Pungitius pungitius строит гнезда над грунтом на растениях, сооружает «колыбельку» и во время фазы ухаживания ведет самку к гнезду по «зигзагообразной линии» (Morris, 1958). Вместе с тем описана популяция Pungitius pungitius из оз. Гурон (Великие озера, США), где нет укореняющихся растений в литоральной зоне и отсутствует Gasterosteus aculeatus — в этом водоеме самцы строят гнезда на грунте в расщелинах между камнями (McKenzie, Keenleyside, 1970). Они не сооружают, «колыбельки» и при ухаживании ведут самку к гнезду по прямой линии — все, как у Gasterosteus aculeatus. Очевидно, изменения в гнездостроительном поведении колюшек из оз. Гурон необратимы и генетически закреплены, так как в эксперименте при наличии выбора, когда самцам предлагались и укореняющиеся растения на песке, и каменный субстрат, они строили гнезда на грунте (McKenzie, Keenleyside, 1970). Этот случай межродового параллелизма явно вызван сходным давлением отбора: адаптацией Pungitius к условиям в водоеме, где постройка гнезд на растениях не происходит из-за их отсутствия, и популяция «Гурон» была вынуждена перейти на тип гнездостроения, к которому уже давно перешли Gasterosteus. Но с переходом на этот тип у Pungitius соответственно изменились другие поведенческие признаки: прекращение сооружения «колыбельки» (ее просто негде сооружать из-за отсутствия стеблевых растений), прямое ведение к гнезду самки (так как нет густых зарослей, где нужно маневрировать) и т. д. Однако, судя по всему, любая популяция Pungitius pungitius при интродукции ее в водоем, лишенный укореняющейся растительности в литоральной зоне, может перейти на грунтогнездостроение в первом же поколении, судя по нашим экспериментам (Зюганов, 1986). Дело в том, что интродукция основателей из типичных популяций Pungitius pungitius, где самцы строят гнезда на растениях (р. Сходня Московской обл., оз. Машинное Карельской АССР), в водоемы, лишенные растений (карьер «Уютный») (см. раздел 2.8.1), приводила к переходу самцов к постройке гнезд на грунте среди расщелин камней. Это предполагает пластичность гнездостроительного поведения в любой популяции Pungitius pungitius и широкую норму реакции по признаку «выбор субстрата для гнезда». Если нет привычного субстрата — растений, то в необычных условиях популяция перестраивается на «эксплуатацию» другого нерестового субстрата.
Итак, параллелизм в репродуктивном поведении самцов Pungitius pungitius оз. Гурон и карьера «Уютный» носит лишь внешний характер, так как способность к грунтогнездостроению у гуронских колюшек необратима и наследственно закреплена. Колюшки же из карьера «Уютный» не утратили способности к постройке гнезд на растениях и при пересадке в водоем, богатый данной растительностью, снова перешли к гнездованию над грунтом. Исходя из наших данных, для объяснения происхождения популяции «Гурон» можно привлечь эффект Болдуина (ситуация, когда в результате удачной модификации фенотипа организм остаётся в благоприятных условиях среды до тех пор, пока отбор не приведет к генетическому закреплению этого фенотипа, — (Майр, 1974).
Дополнение
Нами (Зюганов, Розанов, 1987) проведен ряд межпопуляционных скрещиваний С х А, А х С, С х С, А х А из мономорфных популяций по методике, обработанной для трехиглой колюшки (Зюганов, 1983). Отсутствие уклоняющихся экземпляров в выборках из родительских популяций порядка 500 особей позволило непосредственно использовать эти природные линии в гибридологическом анализе как статистически «чистые» (табл. 29).

Результаты скрещивания № 1 и № 2 однозначно говорят о полном доминировании фенотипа С. Однако в популяциях существует скрытая гетерозиготность, обусловливающая появление среди гибридов F1 фенотипа «I» с частотой 1 /246. Соотношение фенотипов в потомстве от скрещивания № 3 (где гибриды F1 скрещивались с гомозиготной рецессивной линией) пропорционально соотношению разных типов гамет, продуцируемых гибридами F1. Результаты показывают, что гибриды F1 продуцируют 16 типов гамет, 14 из которых в комбинации с гаметами гомозиготной рецессивной линии дают фенотип «С» и по одному соответственно фенотипы «I» и «А». Возникает вопрос, не является ли фенотип «I» результатом модификационной изменчивости? Однако в нашем случае все 11 особей фенотипа «I» идентичны: имеют полностью развитые обе тазовые кости без следов редукции и одну полностью развитую брюшную колючку без рудиментов второй колючки, т. е. образуют дискретный фенотипический класс. К тому же онтогенез фенотипа «I» с самого начала закладки тазового пояса у личинок рыб идет совсем по-иному, нежели онтогенез фенотипа «С» (Nelson, Atton, 1971).
Учитывая однообразие гибридов F1 можно предложить логически простейшую схему, объясняющую расщепление 14:1:1 в скрещивании № 3 — 4 локуса по 2 аллеля в каждом. Присутствие в генотипе хотя бы 1 экземпляра нормального аллеля в одном из генов А, В и С достаточно для нормального развития тазового пояса. Аллели А, В, С — доминантные и взаимодействуют по типу некумулятивной полимерии. Такая система устойчива к действию мутационного процесса, поскольку вредные мутации практически никогда не проявляются в фенотипе. В 4-м локусе этой системы может быть доминантная мутация «D», дающая в отсутствие нормальных аллелей тератогенный эффект — фенотип «I». Предполагается, что все 4 локуса, скорее всего, представляют копии одного гена. В генетике эукариот известно, что многие структурные гены, как правило, представлены в геноме множественными копиями. Предложенная 4-локусная схема наследования хорошо соответствует полученным результатам. Другие схемы наследования, включающие до 6 локусов, давали высокодостоверные различия между ожидаемым и наблюдаемым соотношениями фенотипов в том или ином из скрещиваний № 1—5 (табл. 29).
Хотя предложенная схема соответствует всем опубликованным результатам по скрещиваниям разных видов рыб с признаками наличия-отсутствия тазового пояса, возможно, она не является окончательной, и для ее уточнения нужны дополнительные генетические исследования.
В исследуемом нами районе (Лоухский р-н КАССР) все мономорфные популяции дикого типа (фенотип «С») были найдены в водоемах, населенных хищными рыбами, а популяции бестазовых колюшек (фенотип «А») — там, где хищные рыбы отсутствуют. Нами экспериментально проверялась гипотеза Реймчена—Рейста, высказанная в отношении трехиглой и ручьевой колюшек, о том, что брюшные колючки, эффективно служащие колюшкам защитой от хищных рыб, становятся селективно вредными в водоемах, где хищных рыб нет, поскольку в последних развивается обильная фауна водных насекомых, имеющих хватательные придатки (личинки стрекоз, жуки-плавунцы и т. д.) (Реймчен, 1980; Рейст, 1980).
Был поставлен эксперимент. В 3 пруда вселили колюшек фенотипа «А» и «С» в соотношении 1:1. В один из прудов поместили хищных рыб (окуня), в другом были хищные насекомые (личинки стрекоз и плавунцы с высокой плотностью), в третьем ни окуня, ни насекомых не было (контроль). Через 55 сут провели контрольные обловы.
Результаты показали, что окунь селективно выедает колюшек фенотипа «А» (85 % выедания), а хищные насекомые — колюшек фенотипа «С» (80 %), в то время как отсутствие окуня и насекомых в водоеме приводит к паритету форм «А» и «С» — по 50 %. Из данных следует, что окуни сокращают численность хищных насекомых в водоеме в 3—6 раз (Зюганов, 1989).
Очевидно, основной причиной утраты тазового пояса у колюшек является давление такого селективного фактора, как обилие хищных насекомых, возникающее в условиях отсутствия хищных рыб. Скорость этого процесса высока, поскольку в оз. Машинном (100 лет назад отшнуровавшемся от моря) обитает мономорфная популяция колюшек фенотипа «А». К тому же в соседнем оз. Болотном, где 50 лет назад исчезла кумжа (форель) и за эти годы водоем сильно эвтрофицировался, что повлекло возникновение обильной фауны насекомых, в популяции колюшек выщепились фенотипы «А» (частота 0.12) и «I» (0.12). Нужно подчеркнуть, что в море и озерах, населенных хищными рыбами, которые расположены вокруг двух упомянутых озер, встречаются колюшки исключительно фенотипа «С».
В данном районе мы наблюдаем две стадии дифференциации между «С» и «А» — начальную и конечную. Начальную стадию демонстрирует популяция оз. Болотное: имеется промежуточный фенотип «I», по исследованным 3 морфологическим признакам между всеми 3 формами не выявлено различий, этологические опыты также показали отсутствие поведенческих изоляционных барьеров между ними. Конечную стадию демонстрирует ситуация в расположенной неподалеку системе «ручей—морской залив» Левин Наволок. Здесь обитают колюшки фенотипов «А» (в ручье) и «С» (в заливе), они совместно и одновременно нерестуют в узкой зоне шириной 100 м (в районе устья ручья). Однако в зоне контакта отсутствует промежуточная форма «I», а между обеими формами имеются морфологические различия по полигенным признакам — окраске тела, высоте спинных колючек, числу жаберных тычинок, а также по солеустойчивости взрослых особей и сперматозоидов. Кроме того, тесты на предпочтение полового партнера показали наличие хорошо развитых механизмов этологической изоляции. Ясно, что в последнем случае в процессе дифференциации между 2 формами, кроме олигогенных, накопились и полигенные различия (Зюганов, 1989).
В общей форме эколого-генетические механизмы утраты тазового пояса у колюшки, происходящие вслед за исчезновением из водоема хищных рыб, можно представить так.
— При вторжении высокогетерозиготных популяций колюшек в новую среду (водоемы, где нет хищных рыб) всего лишь несколько мутаций, находящихся ранее в гетерозиготном состоянии, обеспечивают выщепление фенотипа «А» при переходе в гомозиготное состояние. Фенотип «А» получает селективные преимущества в условиях обилия хищных насекомых.
— Процесс становления мономорфизма фенотипа «А» протекает очень быстро — за десятки и сотни поколений, причем новообразованная популяция проходит стадию переходного (транзитивного) полиморфизма.
— Полигенные различия между фенотипами «С» и «А» накапливаются позже.
— В исходных условиях среды мутантные «бестазовые» фенотипы «А» имеют сильно пониженную селективную ценность по сравнению с фенотипами «С».
Имеется сходство в механизмах образования «бестазовых» популяций и популяций leiurus трехиглой колюшки. В обоих случаях при переходе в альтернативные условия среды идут быстрые необратимые изменения по олигогенным признакам.
Приведем результаты экспериментов, где предпринята попытка проверки «на скрещиваемость» морф trachurus и leiurus из бассейна Белого моря (где наблюдаются стартовые стадии генетической дифференциации) и морф trachurus и leiurus из бассейна р. Камчатка (где наблюдаются конечные стадии видообразования) (Зюганов, 1988). Методом тестов на предпочтения половых партнеров выявлялось: имеются ли изоляционные барьеры между всеми 4 совокупностями. Иными словами, пытались выяснить, возможен ли принципиально обмен генами в многокомпонентной популяционной системе между любыми двумя совокупностями через третью, даже если эти две жестко репродуктивно изолированы друг от друга. Результаты представлены в табл. 30. Критерием успешных спариваний являлось оплодотворение самцом икры самки в ходе брачного ритуала. Всего проведено 189 аквариумных опытов.

Выяснилось, что камчатская морфа leiurus репродуктивно строго изолирована от симпатричной камчатской trachurus и от аллопатричной беломорской leiurus, т. е. по отношению к этим совокупностям она ведет себя как вид. Однако от беломорской trachurus она репродуктивно не изолирована и способна к обмену генами с последней. В свою очередь беломорская trachurus способна к обмену генами с камчатской trachurus, а та — с беломорской leiurus и т. д. Круг замкнулся. Понятно, что уже в этой 4-компонентной системе, несмотря на то что между некоторыми парами выявлена полная или почти полная репродуктивная изоляция, имеется принципиальная возможность обмена генами между двумя любыми совокупностями через какую-либо третью, даже если эти две между собой жестко изолированы. Важно подчеркнуть, что в такой системе имеется принципиальная возможность распространения генетического изменения части на все целое (Зюганов, 1988).
Иллюстрированная энциклопедия рыб. Ст.Франк 1983 г.
Девятииглая колюшка (Pungitius pungitius) имеет то же распространение, как и Gasterosteus aculeatus aculeatus Linnaeus, 1758. Гнездо, которое строит самец среди водных растений, более совершенно. Рыба эта достигает 9 см.
Словарь названий пресноводных рыб СССР. Г.У.Линдберг и А.С.Герд 1972 г.
20.2.3 (1). Pungitius pungitius (Linne, 1758) — Девятииглая колюшка (Б. : 966).
[1] русск. Девятииглая колюшка — Кессл., 1864 : 44. Малая колюшка — Варп., 1898 : 26. Многоиглая колюшка — Кессл., 1864 : 44. [4] польск. Cierniczek, Dziewie ciopromienny cierniczek, Koluska — Staff : 252. [14] дат. Nippigget — O-n : 120. [15] шведск. Smaspigg — O-n : 120. Smaspiggen — Smitt : 658. [16] норв. Nipigget, Stingsild — O-n : 120. [18] англ. Needle-mackerol, Stickle-back — CHPTO : 106. Ten-spined — O-n : 120.Ten-spined stickleback, Tinker — Smitt : 658. [19] нем. Krauser, Stichling — Benecke : 75. [36] финск. Kymmenpikki — Brofeldt : 158. Kymmenpikkinen — O-n : 120. Rantakala — Кессл., 1864 : 43. Rautakala — O-n : 120. [51] якут. Темир-атах Колыма — Б. : 366.
Жизнь животных. Том 4. Рыбы Под редакцией профессора Т.С.Расса 1971 г.
Девятииглая колюшка (Pungitius pungitius) имеет умеренно удлиненное голое
тело с тонким хвостовым стеблем и
коротким рылом; только на хвостовом стебле
боковые кили покрыты мелкими
костными пластинками. Жаберные перепонки
соединены и образуют широкую
свободную складку поперек межжаберного
промежутка. Перед спинным плавником
7—12 небольших шипов, направленных
зигзагообразно в разные стороны.
Брюшные плавники превращены в шипы.
Длина до 9 см, обычно 5—6 см. В брачный
период самец становится совершенно
черным.
Девятииглая колюшка — более
северный и более пресноводный вид, чем трехиглая. Широко распространена в
бассейне Северного Ледовитого океана,
Балтийского и Северного морей; не идет на юг
далее Средней Европы и штата
Нью-Джерси. В Тихом океане распространена у
берегов Аляски до о-ва Кадьяк, в бассейнах
Берингова и Охотского морей; южнее
встречаются только китайский подвид
(Pungitius pungitius sinensis) и сахалинский
подвид (Pungitius pungitius tymensis).
Живет преимущественно в пресной воде,
но попадается и в солоноватых водах лагун
и заливов. В бассейне Белого моря
нерестится в июне — августе. Как и у других
колюшек, несколько самок откладывают
икру в одно и то же гнездо. Икрометание
у них порционное, плодовитость 350—960 икринок. Строит гнездо и охраняет
развивающуюся икру самец. В отличие
от трехиглой колюшки, гнездо он
устраивает на стеблях подводных растений, а не
на грунте.
На Атлантическом побережье Северной
Америки эту колюшку называют десятииглой.
Рыбы Японского моря и сопредельных частей Охотского и Желтого морей. Часть 2. (Acipenseriformes — Polynemiformes). Г.У.Линдберг, М.И.Легеза 1965 г.
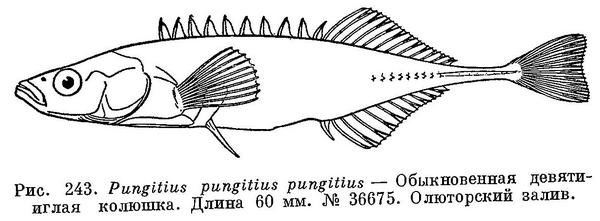
1. Pungitius pungitius pungitius (Linne, 1758) — Обыкновенная девятииглая колюшка (рис. 243).
Gasterosteus pungitius Linne, Syst. nat., ed. X, 1758 : 296 (Европа).
Pungitius pungitius, Берг, Рыбы пресных вод, 1949 : 966 (описание, синонимия).
D VII-XII 10—12, А I 8—11, Р 9—10, V I 1 (Берг, 1949).
Характеристика дана в определительной таблице. (Боковые (внешние, направленные вверх) отростки тазовых костей хорошо развиты, достигают горизонтали верхнего конца основания грудного плавника (рис. 242, А). Брюшные колючки длинные, 1.75—3 раза в длине головы. Спинные колючки высокие; высота средней колючки 2/3—3/4 диаметра глаза. Высота последней спинной колючки почти равна высоте предыдущих или лишь слегка превышает их. Киль на хвостовом стебле хорошо выражен.) Приводимый рис. 243 изображает экземпляр с Камчатки (№ 36675. Лагуна в Олюторском заливе. 7 VIII 1929).
Длина 50—60 мм, но встречаются и до 90 мм.
Распространение. В Японском море указывается из Хакодатэ (Jordan, Tanaka a. Snyder, 1913 : 105), из оз. Абасири на Хоккайдо (Okada a. Ikeda, 1938 : 138), района Ниигаты (Honma, 1952 : 142) и для восточных берегов п-ова Корея: Чхончжин-Сейсин (Matsubara, 1955 : 408). Просмотр коллекций музея Зоологического института Академии наук СССР показал, что принимавшиеся ранее за этот подвид экземпляры из Татарского пролива и лимана Амура, по-видимому, принадлежат к Pungitius pungitius sinensis, у которых костные пластинки в передней части тела отсутствуют и развиты только под спинным плавником. В связи с этим указания о нахождении этого циркумполярного подвида в бассейне Японского моря подлежат проверке. Указание Мацубары (Matsubara, 1955 : 408) на Чхончжинь основано, по-видимому, на данных Мори (Mori, 1928, 1952 : 73), который приводит для этого пункта п-ова Корея нахождение Pygosteus brevispinosus Otaki, 1908, описанного из района Саппоро на Хоккайдо и относящегося, как предполагал Л. С. Берг (1949 : 969), к подвиду Pungitius pungitius tymensis. Присутствие у п-ова Корея подвида tymensis также сомнительно, как и присутствие там типичного подвида. Однако типичный подвид указывается и для Китая из пров. Хэбэй (Hopei, Chihli) в районе Пекина (Shaw, 1932 : 339—343, fig. 1); судя по рисунку, это, по-видимому, подвид sinensis, но указанные в этой работе отношения не отвечают приводимому в ней рисунку.
У экземпляра из Балтийского моря (№ 26930, Аландские острова) киль на хвостовом стебле простирается до половины длины основания мягкого спинного, голый, не покрыт пластинками, но у экземпляров из бассейна Северного Ледовитого океана встречаются и с пластинками, какие имеются и у экземпляра из Олюторского залива. Вообще, этот вид нуждается в детальном анализе.
Рыбы северных морей СССР. А.П.Андрияшев 1954 г.
1. Pungitius pungitius (Linne) — Девятииглая, или малая, колюшка.
Gasterosteus pungitius Linne, Syst. Nat., ed. X, 1758 : 296 (Европа).
Pygosteus pungitius Berg, Proc. U. S. Nat. Mus., XXXII, 1907 : 451 (распространение, измерения). — Солдатов, Тр. Сев. научно-пром. эксп., 17, 1924 : 60 (молодь в Болванск. губе). — Пробатов, Мат. научно-пром. обслед. Карск. губы, 1934 : 95 (много в Карск. губе). — Агапов, Тр. Научно-иссл. инст. полярн. землед., сер. «Пром. хоз.», 16, 1941 : 104 (повсеместно в Анадырск. лимане).
Pungitius pungitius Берг, Рыбы пресн. вод СССР, II, 1933 : 718, фиг. 697— 698. — Бурмакин, Тр. Научно-иссл. инст. полярн. землед., сер. «Пром. хоз.», 15, 1941 : 157 (бассейн Гыданск. зал.; измерения 10 экз., питание).
Gasterosteus aculeatus. А. В. Подлесный и А. А. Лобовиков (Вопр. геогр. Сибири, 2, 1951 : 270) ошибочно указывают для Таймырского озера трехиглую колюшку (Gasterosteus aculeatus) вместо распространенной там девятииглой колюшки (Pungitius pungitius). Исследовавший это озеро В. С. Михин подтверждает отсутствие в нем трехиглой колюшки, ареал которой строго амфибореален. Н. А. Дмитриев (Природа, 1, 1953 : 106) указывает, что в последнее время наша промышленность предъявляет требования, на жир колюшки, который имеет лечебное значение, а также с большим успехом применяется при производстве линолеума и линкруста.
D VII—XII (наичаще IX—X), 10—12, А I 8—11, Р 9—10, V I 1.
Тело голое. На хвостовом стебле по боковому килю, покрытому мелкими костяными пластинками. Высота тела содержится 4.7—6.1 раза в длине тела без С. Длина до 9 см, обычно 5—6 см.
Распространение. Циркумполярный вид, широко распространенный в бассейне Сев. Ледовитого океана от Финмаркена, Мурмана и Белого моря на восток вдоль сибирских берегов до Берингова пролива и далее — до Гудсонова пролива и Гренландии. В Исландии отсутствует. В бассейне Атлантического океана по обоим берегам — в Америке до Нью-Йорка, в Европе — в бассейне Балтийского и Северного морей и далее к юго-западу до Луары. В Бассейне Средиземного и Черного морей этот вид отсутствует. В Тихом океане по американской стороне на юг до о. Кадьяк; обычен в бассейне Берингова и Охотского морей; южнее (до Кореи и Китая) встречается только подвид sinensis (Guich.). Живет в пресных водах, но довольно обычна также в солоноватых водах прибрежных лагун и заливов. Нерест в бассейне Белого моря, по данным В. В. Кузнецова, в июне—августе. Плодовитость 350—960 икринок; икрометание порционное.
Рыбы пресных вод СССР и сопредельных стран. Л.С.Берг 1948 г.
1. Pungitius pungitius (Linne). — Малая, или девятииглая колюшка
(Поляки — cierniczek, якуты на Колыме — темир-атах (= железная нога).)
Gasterosteus pungitius Linne, Syst. nat., ed. X, 1758, p. 296 (Европа). — Кесслер, Рыбы СПб. губ., 1864, стр. 43 (СПб. губ.). — Smitt, Scand. fish., II, 1895, p. 658, pl. XXVIII, fig. 3, 4 (исключить из синонимов Gasterosteus laevis) (Скандинавия, о. Беринга).
Gasterosteus pungitius brachypoda (Bean 1879) T. and B. Bean, Proc. U. S. Nat. Mus., XIX, 1896, p. 251 (о. Беринга), p. 392 (Петропавловск).
Pygosteus pungitius Jordan and Evermann, Fish. N. America, I, 1896, p. 745 (исключить из синонимов Gasterosteus laevis). — Berg, Proc. U. S. Nat. Mus., XXXII, 1907, p. 451 (Кольский п-ов, Архангельск, Печора, Хатанга, Яна, Колыма, Камчатка, Аляска, Сахалин, Иезо, Охотское море). — Bertin, Ann. Inst. Ocean., II, № 1, 1925, p. 161 (частью). — Wоlski, Arch. hydr. i ryb., II, № 1—2, Suwalki, 1927, p. 120 (Польша, в бассейне Балтийского моря). — Есипов, За рыбн. индустрию Севера, 1935, № 10, стр. 28 (Колгуев; Белушья губа на Новой Земле).
D VII—XII 10—12, А I 8—11, Р 9—10, V I 1. Спинных колючек наичаще 9—10. Тело голое; только на хвостовом стебельке киль, покрытый небольшими костяными щитками. Высота тела в его длине (без С) 4.7—6.1 раза, длина головы 3.6—4.3 раза. Длина средней спинной колючки 2/3—3/4 диаметра глаза. Длина брюшной колючки 2.33—3 раза в длине головы. Зимою верх головы и спина темноголубоватого цвета, бока серебристо-белые с чрезвычайно мелкими черными пятнышками. Летом верх тела оливково-зеленый, брюхо светлозеленое с медно-желтым налетом, низ головы красноватый; на теле ясно заметные черные пятна. Во время нареста у самцов бока тела и брюхо делаются черными, а брюшные колючки белыми. Длина 50—60 мм, редко больше (до 90 мм).

В Балтийском море и его заливах мечет икру с начала июня до начала августа. Самец вьет гнездо и охраняет его, пока не выйдет молодь.
Циркумполярный вид. Бассейны Северного, Балтийского, Белого морей; Мурман, Колгуев, Новая Земля (губа Белушья); на западе на юг до р. Луары. В Норвегии лищь в системе р. Гломен, у Трондгейма и в Финмаркене. Сибирь в бассейне Ледовитого моря (Г. В. Никольский доставил в Зоологический институт Академии Наук СССР несколько Pungitius pungitius из соленого озера Майбалык около курорта Боровое (в районе Чебачьих озер), в Кокчетавских горах, на высоте 305 м; соленость около 9 г в литре. По словам рыбаков, колюшка попадается и в Б. Чебачьем озере. Озера эти не имеют стока в бассейн Оби.). Анадырь, Камчатка, о. Беринга, Аляска (на юг до о. Кадьяк), берега Охотского моря, Сахалин, о. Хоккайдо (Хакодате), Курильские острова. Арктические и атлантические берега Сев. Америки на юг до Нью-Йорка; озера Верхнее и Б. Медвежье. Входит в реки; есть в Псковско-Чудском водоеме, в Ладожском и Онежском озерах, но обычно далеко вверх не поднимается. Однако есть в озерах Веряжа и Ясы в бассейне р. Великой (П. А. Дрягин), в оз. Воже в бассейне р. Онеги (П. А. Дрягин), в р. Мезени до среднего течения (П. Г. Данильченко), в Иртыше у Тобольска (М. И. Меньшиков), в Хатанге до Боганиды, в Колыме вверх до Верхнеколымска и массами в озерах по Колыме (П. А. Дрягин). В бассейне Средиземного (Однако встречается в бассейне Роны (Bertin, р. 69). Может быть проникла искусственным путем, через каналы.) и Черного морей отсутствует. В Охотском море и далее к югу сменяется подвидом sinensis.
Pungitius pungitius нередко наблюдается в озерках посреди верховых болот, т. е. в местах, не имеющих сообщения с реками.













